Method Article
Détection des métalloprotéinases matricielles fonctionnelle par zymographie
Dans cet article
Résumé
Ce protocole décrit une analyse basée sur les activités de détection des métalloprotéinases matricielles dans les surnageants de culture ou de fluides corporels.
Résumé
Les métalloprotéinases matricielles (MMP) sont des endopeptidases contenant du zinc. Ils dégradent les protéines par clivage des liaisons peptidiques. Plus de vingt MMP ont été identifiés et sont séparés en six groupes en fonction de leur structure et leur spécificité de substrat (collagénases, gélatinases, le type de membrane [MT-MMP], stromélysines, matrilysins, et autres). Les MMP jouent un rôle crucial dans l'invasion cellulaire, la dégradation du cartilage, le remodelage des tissus, cicatrisation des plaies, et l'embryogenèse. Ils participent donc à la fois dans les processus normaux et dans la pathogenèse de plusieurs maladies, telles que la polyarthrite rhumatoïde, le cancer ou maladie pulmonaire obstructive chronique 1-6. Ici, nous allons nous concentrer sur la MMP-2 (gélatinase A, collagénase de type IV), une MMP largement exprimé. Nous allons démontrer comment détecter la MMP-2 dans les surnageants de culture cellulaire par zymographie, une couramment utilisé, une technique simple, et pourtant très sensible d'abord décrite en 1980 par C. Heussen et EB Dowdle 7-10. Cette technique est semi-quantitatif, il peut donc être utilisée pour déterminer les niveaux de MMP dans les échantillons de test lorsque les concentrations de MMP connus recombinant sont chargés sur le même gel 11.
Les solutions contenant les MMP (par exemple, les surnageants de culture cellulaire, l'urine ou le sérum) sont chargés sur un gel de polyacrylamide contenant du sulfate de sodium dodécyl (SDD; pour linéariser les protéines) et de la gélatine (substrat pour MMP-2). Le tampon de l'échantillon est conçu pour augmenter la viscosité de l'échantillon (pour faciliter le chargement du gel), fournissent une teinture de suivi (bleu de bromophénol, à surveiller la migration de l'échantillon), fournir des molécules dénaturant (pour linéariser les protéines), et de contrôler le pH de l'échantillon. Les protéines sont alors autorisés à migrer sous un courant électrique dans un tampon de migration conçu pour fournir un taux de migration constante. La distance de migration est inversement corrélée avec le poids moléculaire de la protéine (petites protéines se déplacer plus rapidement à travers le gel de protéines de grande taille et donc ne migrent plus loin dans le gel). Après migration, le gel est placé dans un tampon de renaturation des protéines pour permettre de retrouver leur structure tertiaire, nécessaires à l'activité enzymatique. Le gel est ensuite placé dans un tampon de développement conçu pour permettre à la protéase à digérer son substrat. Le tampon contient également le développement p-aminophénylmercurique acétate (AFPA) pour activer le non-protéolytiques pro-MMP en MMP actives. La prochaine étape consiste à coloration du substrat (gélatine dans notre exemple). Après le lavage l'excès de colorant hors gel, les zones de la digestion de protéase apparaissent comme des bandes claires. Le plus clair de la bande, le plus concentré de la protéase qu'il contient. Intensité de coloration de bande peut alors être déterminée par densitométrie, en utilisant un logiciel tel que ImageJ, permettant une comparaison de l'échantillon.
Protocole
1. Chargement et exécution du gel
- Tous les échantillons doivent être préparés de manière adéquate afin de maintenir la fonction des enzymes et utilisé immédiatement après la collecte ou conservés congelés à -80 ° C. Les échantillons ne doivent pas contenir d'agents réducteurs (par exemple, une β-mercaptoéthanol) ou être bouillie avant le gel.
- Ouvrir le sachet contenant un gel à l'intérieur d'une cassette, rincer la cassette avec de l'eau déminéralisée.
- Retirer le ruban de protection de la partie inférieure de la cassette et le peigne du haut du gel.
- Rincer les puits trois fois avec le tampon de fonctionnement (diluée à 1X dans de l'eau déminéralisée).
- Placer le gel dans la mini-cellule, assurant que le petit côté de la cassette visages vers l'intérieur. Verrouiller en place avec le Wedge Tension Gel. La mini-cellule permet d'exécuter un ou deux gels en parallèle.
- Remplissez le haut (intérieur) de chambre avec 1X tampon courant au dessus du niveau des puits, vérifiez s'il ya des fuites. En cas de fuite, éliminer le tampon et de repositionner le gel.
- Remplir la chambre basse avec 1X tampon.
- Charge 10 uL du marqueur moléculaire de la protéine dans un puits.
- Mélanger une quantité égale de gel-tampon de chargement et de l'échantillon et la charge dans les puits du gel en utilisant un gel des conseils de chargement (changé entre chaque échantillon). Ces puits peuvent être chargés avec un maximum de 20 uL totale.
- Placer le couvercle sur la cellule et de mini-connecter les cordons d'électrode à l'alimentation. Mettre l'alimentation sous tension et réglez-le fonctionner à 125 V constante pendant 90 minutes. Vérifiez la formation de petites bulles sur le fil de la chambre basse, indiquant la circulation du courant.
- Lorsque vous exécutez votre premier gel, de suivre les progrès de la migration toutes les 15 minutes, en utilisant le bleu de bromophénol inclus dans le tampon de chargement comme un indicateur. Laissez le long de gel jusqu'à ce que le colorant indicateur atteint le bas du gel.
2. Renaturation et de développement du gel
- Pour chaque gel, préparer 100 ml de tampon 1X renaturation et 200 mL de tampon de dénaturation, à la fois dans de l'eau déminéralisée.
- Lorsque le colorant bleu de bromophénol suivi atteint le bas du gel, interrupteur de l'alimentation hors tension, ouvrez la cellule Mini-, et enlever le gel. Séparez les deux côtés de la cassette en utilisant le couteau gel (ou d'une spatule de pesage). Couper un coin pour marquer la direction du gel.
- Retirer délicatement le gel de la cassette et placer dans un récipient avec 100 ml de tampon de renaturation. Incuber pendant 30 minutes à température ambiante avec agitation douce.
- Retirer le tampon de renaturation et ajouter 100 ml de tampon pour développer le gel. Incuber pendant 30 minutes à température ambiante avec agitation douce.
- Retirez le tampon en développement et ajouter 100 ml de tampon plus de développement pour le gel. Incuber une nuit (16-18 heures) à 37 ° C.
- Retirez le tampon en développement et rincer trois fois (5 minutes chacun) avec de l'eau déminéralisée sous agitation douce à température ambiante.
- Balayage du gel pour sauver le positionnement exact des bandes standards de protéines car elles deviendront moins ou pas visible après coloration du gel.
- Tache le gel en ajoutant 20 mL de SimplyBlue Safestain au gel. Incuber pendant 1 heure à température ambiante sous agitation douce.
- Retirez le SafeStain SimplyBlue et de-tacher le gel dans 100 mL ou plus d'eau déminéralisée pendant une heure à température ambiante sous agitation douce.
- Pour de meilleurs résultats, remplacez l'eau déminéralisée frais et incuber pendant une heure ou plus à température ambiante sous agitation douce.
3. Analyse des données
- Retirer délicatement le gel de l'eau et le placer dans une feuille de plastique protectrice.
- Analyser le gel avec une résolution de 300 dpi ou plus. Enregistrez l'image au format TIFF (figure 1A).
- Mesure des intensités groupe avec ImageJ (ou autre logiciel similaire).
- Ouvrez le fichier TIFF dans ImageJ (figure 1A).
- Visualisez en noir et blanc en sélectionnant "Image>> Type 8-bit" (figure 1B).
- Utilisez l'outil de sélection rectangulaire aux lignes de la première bande, dessinant un rectangle au moins deux fois supérieure à ce qu'elle est large (ce qui est une exigence de logiciels).
- Appuyez sur "1" ou sélectionnez "Analyser> Gels> Sélectionner la voie d'abord» et la bande seront présentées.
- Un nouveau rectangle apparaît, déplacez-le vers la bande suivante et sélectionnez «Analyser> Gels> Sélectionner ruelle à côté". Répétez jusqu'à ce que toutes les bandes sont sélectionnés (figure 1B).
- Appuyez sur "3" ou sélectionnez "Analyser> Gels voies> Terrain" pour générer le tracé le profil de chaque bande (figure 1C).
- Utilisez la sélection de la ligne droite (devrait déjà être sélectionné automatiquement) pour tracer des lignes de base de sorte que le pic d'intérêt est un espace entièrement clos.
- Sélectionnez l'outil baguette magique et cliquez à l'intérieur de chaque pic pour le sélectionner.
- Sélectionnez "Analyser> Gels pics> Label" pour obtenir une table avec la région pour chaque pic sélectionné. Ces données peuvent être tracées en tant que tels (F1D IGURE) ou peut être normalisée à la valeur d'une bande choisie. Cette normalisation est particulièrement important lorsque la mise en commun des valeurs de plusieurs gels de reproduire pour déterminer la signification statistique des résultats.
4. Les résultats représentatifs
Nous montrons un gel à 11 puits chargés avec différents surnageants de culture cellulaire contenant différentes quantités de MMP-2 (figure 1A). L'observation directe de ce gel montre des différences évidentes dans les concentrations de MMP-2 entre certains des puits. Par exemple, il est clair que les puits n ° 4 et 5 contiennent beaucoup plus que de la MMP-2 et n ° 11 ou même bien # 10. Pour la quantification objective des bandes, nous avons utilisé la densitométrie avec le logiciel ImageJ (figure 1B-D), confirmant une différence d'environ 4 fois dans la MMP-2 et des montants compris entre 11 et # # puits 4 et 5 et une différence d'environ 2 fois dans MMP-2 et des montants compris entre # 10 et # puits 4 et 5.

Figure 1. Détection de la MMP-2 par zymographie gélatine. Une image, scannée d'un gel de gélatine. Nombre des puits sont indiqués en haut du gel. B, le gel de même que dans une montre en noir et blanc d'une densitométrie. Chaque bande a été sélectionné avec un rectangle dans ImageJ. C, deux exemples de profils de densitométrie pour le gel représenté en A et B (bandes # 4 et # 11). Une ligne droite a été élaboré à la base de chaque pic de créer une zone fermée. D, Terrain des domaines de pointe pour le gel représenté en A et B avant (à gauche) et après (à droite) la normalisation de la densité de la bande n ° 1.
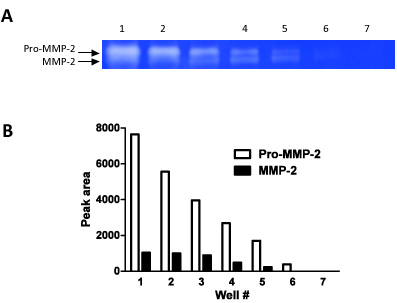
Figure 2. Ce chiffre montre comment zymographie peut être utilisé comme une technique semi-quantitative. Nous avons chargé des dilutions en série (les étapes de 1:1 dilutions) dans 7 puits consécutifs et mesuré la densité de la bande pour les deux pro-MMP-2 et MMP-2.
Discussion
Nous avons démontré comment effectuer une analyse des zymographique MMP-2 dans les surnageants de culture cellulaire.
La quantité d'échantillon à charger sur un gel doit être déterminée empiriquement en fonction de l'origine et la MMP d'intérêt. Chargement trop peu va empêcher la détection pendant le chargement trop peut conduire à une saturation car il ya tellement seul substrat une protéase peuvent digérer dans le domaine de la bande. Si nécessaire, l'échantillon peut être dilué dans de l'eau déminéralisée avant de les mélanger avec le tampon de chargement ou le temps de développement peuvent réduire d'une nuit à 4 heures. Il est également possible de concentrer les protéines dans une solution utilisant des concentrateurs (par exemple le numéro de catalogue Millipore UFC803024). Si les bandes restent à peine visible, il peut être nécessaire de développer les gels pour une plus longue période de temps, même jusqu'à 48 heures. Lors de la préparation des échantillons à partir de surnageants de culture de tissus, il convient de noter que sérum de veau fœtal (et autres sérums) contient les MMP qui peuvent affecter les résultats. Pour cette raison, nous recueillons l'ensemble de nos surnageants après culture dans un milieu sans sérum.
Les lavages décrits aux paragraphes 2.9 et 2.10 du protocole sont nécessaires pour supprimer le fond coloration des bandes digérées. Fois plus de temps lavez va supprimer plus de fond, mais aussi de baisser la coloration du substrat à travers le gel. Si les temps de lavage plus long sont nécessaires, nous vous conseillons de balayage du gel de toutes les quelques heures pour choisir le scanner avec le meilleur contraste.
Cette technique peut être utilisée pour détecter les autres MMPs. Par exemple, la MMP-9 peuvent être détectés sur des gels de gélatine, et aussi dans une moindre mesure de MMP-1, MMP-8 et MMP-13 que la gélatine n'est pas leur substrat préféré. MMP-1 et MMP-13 sont les meilleurs détecté sur zymographie collagène tout en caséine est le substrat préféré pour la MMP-11 et permet également la détection de la MMP-1, MMP-3, MMP-7, MMP-12 et MMP-13 9. MMP-7 (matrilysine) et collagénases (MMP-1 et MMP-13) sont difficiles à détecter quand il est présent à de faibles niveaux de la caséine ou des gels de gélatine. Ajout de l'héparine à l'échantillon au moment du chargement du gel améliore significativement la limite de détection de la MMP-7. Pour MMP-1 et MMP-13, l'héparine doit être ajouté au gel après la course électrophorétique est déjà en cours 12.
Depuis zymographie mesures d'activité enzymatique après dénaturation et la renaturation des enzymes, il permettra de mesurer l'activité de toutes les MMP présents dans l'échantillon. Ce sont des enzymes, des pro-enzymes, les enzymes et lié à des inhibiteurs endogènes (par exemple, TIMP-2). Il est cependant possible de déterminer le niveau d'activation de MMP dans l'échantillon en comparant la densité de la bande de l'enzyme active et de celle du pro-enzyme, ce qui aura un poids légèrement supérieur moléculaire.
Zymographie n'est souvent pas suffisante pour identifier une MMP. Comparaison du niveau de migration d'un RPM avec connues standards de poids moléculaire ne l'aide dans l'identification, mais il convient de noter que certaines de ces normes contiennent un agent réducteur et que lorsqu'ils sont utilisés dans des conditions non réductrices, ils peuvent indiquer des poids moléculaires différents 9. Une option consiste à charger une MMP solubles recombinantes sur le même gel que les échantillons d'essai. Les MMP peuvent toutefois être associés à d'autres protéines, induisant un changement de poids moléculaire apparent. Inhibiteurs de MMP sélectifs peuvent être ajoutés au gel (ou partie d'un coupé dans la moitié de gel) pendant l'incubation dans un tampon de développement comme outils pharmacologiques à l'identité de la MMP de interest.A seconde technique (Western Blot, immunocytochimie, ou ELISA) est recommandée pour aider à l'identification de la MMP d'intérêt. Il est à noter que les limites de détection pour Western Blot sont souvent bien inférieurs à ceux des gels zymographique, pouvant conduire à de faux résultats négatifs lors de l'utilisation de cette technique.
Déclarations de divulgation
Remerciements
Nous tenons à remercier le Dr S. Ressler (Département de Biologie Moléculaire et Cellulaire, Baylor College of Medicine) pour suggérer l'utilisation de protéines de concentrateurs d'augmenter la concentration de MMP dans les surnageants de culture cellulaire.
Ce projet a été soutenu par des subventions du Fonds de Mme Clifford Elder Graham White de recherche dotées et le NIH / NIAMS (AR059838) à CB. Le contenu est uniquement la responsabilité de leurs auteurs et ne représentent pas nécessairement les vues officielles de la NIH.
matériels
| Name | Company | Catalog Number | Comments |
| Xcell SureLock Mini-Cell CE mark electrophoresis apparatus | Invitrogen | EI0001 | |
| Power supply (model 302) | VWR international | 93000-744 | |
| Novex 10% gelatin zymogram gels, 1.0 mm, 12 wells | Invitrogen | EC61752BOX | |
| Blue Juice gel loading buffer | Invitrogen | 10816015 | |
| Gel loading tips | VWR international | 53509-015 | |
| Protein molecular weight standard | Invitrogen | LC5800 | |
| Novex Tris-Glycine-SDS running buffer | Invitrogen | LC2675 | |
| Novex zymogram renaturing buffer | Invitrogen | LC2670 | |
| Novex zymogram developing buffer | Invitrogen | LC2671 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | |
| Epson Perfection 4490 Photo Scanner | Amazon | n/a | |
| ImageJ software | http://rsbweb.nih.gov/ij/ | n/a | Authored by W. Rasband, NIH/NIMH |
Références
- Luo, J. The role of matrix metalloproteinases in the morphogenesis of the cerebellar cortex. Cerebellum. 4, 239-245 (2005).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors - diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Kessenbrock, K., Plaks, V., Werb, Z. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. 141, 52-67 (2010).
- Lagente, V., Boichot, E. Role of matrix metallopreoteinases in the inflammatory process of respiratory diseases. J. Mol. Cell. Cardiol. 48, 440-444 (2010).
- Rodríguez, D., Morrison, C. J., Overall, C. M. Matrix metallopreoteinases: what do they not do? New substrates and biological roles identified by murine models and proteomics. Biochim. Biophys. Acta. 1803, 39-54 (2010).
- Bourboulia, D., Stetler-Stevenson, W. G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): positive and negative regulators in tumor cell adhesion. Semin. Cancer Biol. , (2010).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochem. , 102-196 (1980).
- Lombard, C., Saulnier, J., Wallach, J. Assays of matrix metalloproteinases (MMPs) activities: a review. Biochimie. 87, 265-272 (2005).
- Snoek-van Beurden, P. A., Von den Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques. 38, 73-83 (2005).
- Kupai, K., Szucs, G., Cseh, S., Hajdu, I., Csonka, C., Csont, T., Ferdinandy, P. Matrix metalloproteinase activity assays: importance of zymography. J. Pharmacol. Toxicol. Methods. 61, 205-209 (2010).
- Kleiner, D. E., Stetler-Stevenson, W. G. Quantitative zymography: detection of pictogram quantities of gelatinases. Anal. Biochem. 218, 325-329 (1994).
- Yu, W. H., Woessner, J. F. Heparin-enhanced zymographic detection of matrilysin and collagenases. Anal. Biochem. 293, 38-42 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon