Method Article
ザイモグラフィーによる機能マトリックスメタロプロテイナーゼの検出
要約
このプロトコルは、アクティビティベースの培養上清や体液中マトリックスメタロプロテアーゼを検出するためのアッセイを説明します。
要約
マトリックスメタロプロテアーゼ(MMP)は亜鉛含有エンドペプチダーゼです。彼らは、ペプチド結合の切断によってタンパク質を分解。 20以上のMMPは同定されており、その構造と基質特異性(コラゲナーゼ、ゼラチナーゼ、膜の種類[MT - MMP]、ストロメリシン、matrilysins、など)に基づいて6つのグループに分けられます。 MMPは、細胞浸潤、軟骨の劣化、組織の再構築、創傷治癒、および胚形成において重要な役割を果たす。したがって、それらは両方とも通常のプロセスで、そのような関節リウマチ、がん、または慢性閉塞性肺疾患1から6のような多くの疾患の病因に関与。ここで、我々は、MMP - 2(ゼラチナーゼA、IV型コラゲナーゼ)、広く発現MMPに焦点を当てます。私たちは、ザイモグラフィーは、まずC. HeussenとEBドゥードル70から10が1980年に記載されて一般的に使用される、シンプルな、そして非常に敏感な技術によって、細胞の培養上清中のMMP - 2を検出する方法を説明します。この技術は半定量的である組換えMMPの既知の濃度は同じゲル11の上にロードされるとき、それは、したがって、試験サンプル中のMMPレベルを決定するために使用することができます。
とゼラチン(MMP - 2の基質)、MMPを(例えば細胞培養上清、尿、または血清)を含むソリューションは、ドデシル硫酸ナトリウム(タンパク質を線形化するためにSDS)を含むポリアクリルアミドゲル上にロードされています。サンプルのバッファは(ゲルローディングを容易にする)サンプルの粘度を高めるために設計されて、追跡用色素(ブロモフェノールブルー、サンプルの移行を監視する)を提供する、変性分子(タンパク質を線形化するために)提供し、サンプルのpHを制御する。タンパク質は、その後、一定の移行率を提供するように設計された実行中のバッファで電流下での移行が許可されています。移行の距離は反比例タンパク質の分子量(小さなタンパク質は大きなタンパク質に比べゲルを介して高速に移動するため、ゲルの下方に移行)と相関している。移行後は、ゲルは、タンパク質が酵素活性に必要なそれらの三次構造を、回復できるようにrenaturingバッファに置かれます。次いでゲルをプロテアーゼはその基質を消化できるように設計開発をバッファに置かれます。発展途上バッファはまた、アクティブなMMPをに非タンパク質分解プロMMPを活性化するためのp - aminophenylmercuric酢酸(APMA)が含まれています。次のステップは、基板を(この例ではゼラチン)染色で構成されています。ゲルから余分な色素を洗浄した後、プロテアーゼ消化の領域は明確なバンドとして表示されます。明確なバンドは、より濃縮されたプロテアーゼは、それが含まれています。バンドの染色強度は、サンプルの比較を可能にする、などのImageJなどのソフトウェアを使用して、デンシトメトリーによって測定することができる。
プロトコル
1。ジェルのロードと実行
- すべてのサンプルは、酵素の機能を維持するために十分に準備され、コレクションの直後に使用されるか、または-80℃で凍結保存する必要があります。℃にサンプルは、還元剤を含んではならない(例えば、β-メルカプトエタノール)またはゲルローディング前に一度沸騰させ。
- カセット内部にゲルを含んでいるポーチを開くと、脱イオン水でカセットをすすいでください。
- カセットとゲルの上から櫛の底から保護テープを取り外します。
- ランニングバッファー(脱イオン水で1Xに希釈)でウェル三回すすいでください。
- ミニ細胞、カセットの小さい側が内側を向くようにすることにゲルを置きます。ゲルテンションウェッジを所定の位置にロックします。ミニセルは並列に1つまたは2つのゲルを実行することができます。
- 井戸のレベル以上の1X泳動バッファーと上部(内側)室を埋めるため、任意の漏れをチェックします。漏れの場合には、バッファを削除し、ゲルを再配置する。
- 1X泳動バッファーと下室を埋める。
- よく一つにタンパク質分子マーカーの10μLをロードする。
- ゲルローディングチップを(各サンプルの間で変更)を用いてゲルのウェルにゲルローディング緩衝液の試料と負荷を均等に混ぜる。これらの井戸は20μL、合計すると、最大ロードすることができます。
- ミニセルにふたをし、電源に電極コードを接続します。の電源を切り替え、90分間一定の125 Vで実行するように設定します。現在の発行部数を示し、下室のワイヤーに小さな気泡の形成を確認してください。
- 最初のゲルを実行する際に、指標としてのローディングバッファーに含まれるブロモフェノールブルーを使用して、マイグレーション15分ごとの進行状況を監視。インジケータの色素がゲルの底に達するまでゲルの実行をしましょう。
2。ジェルをRenaturingと開発
- それぞれのゲルの場合は、脱イオン水で両方、1X renaturingバッファとバッファを変性200mLを100mLのを準備。
- ブロモフェノールブルートラッキング色素がゲルの底部に達すると、電源を切るミニセルを開いて、ゲルを取り外します。ゲルのナイフ(または計量へら)を使用してカセットの両面を区切ります。ゲルの方向を示すためにコーナーをカット。
- 慎重に100mLのrenaturingバッファを使用してコンテナにカセットと場所からゲルを取り除く。穏やかに撹拌しながら室温で30分間インキュベートする。
- renaturingバッファを削除し、ゲルにバッファーを開発して100 mLを加え。穏やかに撹拌しながら室温で30分間インキュベートする。
- 開発バッファを削除し、ゲルに開発バッファー100mLの詳細を追加。 37℃(16〜18時間)一晩インキュベート℃に
- 開発バッファを削除し、室温で穏やかに撹拌下に脱イオン水で3回(5分ごとに)すすいでください。
- 彼らはゲルの染色後に小さいか、または表示されていないとなると蛋白質の標準的なバンドの正確な位置を保存するためにゲルをスキャンします。
- ゲルにSimplyBlue Safestain 20mLを追加することでゲルを染色する。穏やかに撹拌しながら室温で1時間インキュベートする。
- SimplyBlue SafeStainと穏やかに撹拌下、室温で1時間を100mL以上の脱イオン水で脱染色ゲルを取り外します。
- より良い結果を得るために、穏やかに撹拌下、室温で別の時間以上に新鮮な脱イオン水とインキュベートして交換してください。
3。データ解析
- 慎重にプラスチックシートプロテクターの水と場所からゲルを取り除く。
- 300dpi以上の解像度でゲルをスキャンします。 TIFF形式(図1A)で画像を保存します。
- ImageJの(または別の同様のソフトウェア)とのバンド強度を測定します。
- ImageJは(図1A)でTIFFファイルを開きます。
- (図1B)"画像>タイプ> 8ビット"を選択することにより、黒と白で視覚化する。
- 少なくとも二回以上、それは(これはソフトウェアの要件です)横幅よりも長方形を描く、最初のバンドの輪郭を長方形選択ツールを使用してください。
- "1"を押すか、"解析>ジェル>を選択最初のレーン"とバンドが概説されます]を選択します。
- 新しい長方形が表示されるので、次のバンドに移動し、">ジェル>を選択、次の車線を分析する"が選択されます。すべてのバンドが選択されるまで繰り返します(図1B)。
- "3"を押すか、各バンド(図1C)のプロファイルプロットを生成するために"解析>ジェル>プロットレーン"を選択します。
- 興味のピークが完全に密閉された場所であることができるように、基本線を描画する直線の選択を(既に自動的に選択する必要があります)を使用してください。
- 杖ツールを選択して、それを選択するために、各ピークの内側をクリックします。
- 選択した各ピークの面積を持つテーブルを取得するために"解析>ジェル>ラベルのピーク"を選択してください。これらのデータは、(Fとしてプロットすることができますigureの1D)または、選択されたバンドの値に正規化することができます。結果の統計的有意性を決定するためにいくつかの複製ゲルから値をプールする場合は、この正規化は特に重要です。
4。代表的な結果
我々は、MMP - 2(図1A)の異なる量を含むさまざまな細胞培養上清を搭載した11ウェルのゲルを示す。このゲルの直接観察は、井戸のいくつかの間にMMP - 2濃度の明らかな違いを示しています。例えば、それは井戸#4と5ははるかにMMP - 2も#11またはさえも#10よりが含まれていることは明らかである。バンドの客観的な定量化のために我々は、MMP - 2も#11と井戸の間の量#4と5との約2倍の差が約4倍の差を確認し、ImageJのソフトウェア(図1B - D)でデンシトメトリーを使用しているよく#10と井戸#4と5の間にMMP - 2の量。

図1ゼラチンザイモグラフィーによるMMP - 2の検出。ゼラチンゲルの、スキャン画像。よく数字は、ゲルの上部に示されています。 B、デンシトメトリー用の黒と白に示すのと同じゲル。各バンドは、ImageJの中の矩形で選択されました。 C、およびB(バンド#4、#11)に示すようにゲルのデンシトメトリーのプロファイルの二つの例。直線は、閉じた領域を作成するために、各ピークの基部に描かれました。 D、バンド#1の密度にAとBの前(左)と後(右)正規に示すようにゲルのピーク面積のプロット。
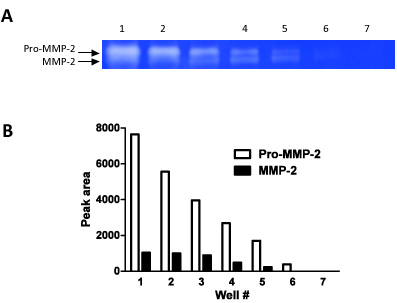
図2この図は、ザイモグラフィーの半定量的なテクニックとして使用することができる方法を示しています。我々は7回連続のウェルに希釈系列を(1:1希釈の手順)にロードされ、プロMMP - 2およびMMP - 2の両方のバンドの密度を測定した。
ディスカッション
我々は、細胞培養上清中のMMP - 2のzymographic分析を実行する方法を示している。
ゲルにロードするサンプル量は、経験的に関心の起源とMMPに応じて決定する必要があります。プロテアーゼは、バンドの領域に消化できるだけなので非常に基板があるので、あまりにも多くのロード中に少し検出を防ぐことがあまりにもロードすると、飽和状態につながる可能性があります。必要に応じて、サンプルをローディングバッファーや開発に時間と混合する前に脱イオン水で希釈することができますデは4時間に一晩に短縮できます。それは、コンセントレータ(例えばミリポアカタログ#UFC803024)を用いて溶液中のタンパク質を濃縮することも可能です。バンドがほとんど見えない状態のままなら、それも、最大48時間まで、時間の長い期間のためのゲルを開発する必要があるかもしれません。組織培養上清からサンプルを調製する際に、それはウシ胎児血清(および他の血清が)結果に影響を与える可能性のMMPを含んでいることに留意すべきである。このような理由から、我々は、無血清培地での培養後に上清のすべてを収集する。
プロトコルのパラグラフ2.9および2.10で説明されている洗浄は消化バンドの染色バックグラウンドを除去する必要があります。長い洗浄時間は、ゲル全体に基板の染色をより多くの背景を削除しますが、また暗くなる。長い洗浄時間が必要な場合、我々は最高のコントラストを使用してスキャンを選択するためにゲルを数時間おきにスキャンすることをお勧めします。
この手法は、他のMMPを検出するために使用することができます。ゼラチンが好ましい基質ではないとして、例えば、MMP - 9はゼラチンゲル上で、そしてまた、より低い程度MMP - 1、MMP - 8、およびMMP - 13に検出することができます。 MMP - 1およびカゼインはMMP - 12、およびMMP - 13、MMP - 7、MMP - 3、MMP - 11のための好ましい基質であるともMMP - 1の検出を可能にする間、MMP - 13は最高のコラーゲンのザイモグラフィーで検出されています9。 MMP - 7(マトリリシン)およびコラゲナーゼ(MMP - 1およびMMP - 13)時カゼインまたはゼラチンゲル中での低レベルで存在を検出することは困難です。ゲルローディング時の試料へのヘパリンの添加はMMP - 7の検出限界を大幅に向上させます。 MMP - 1およびMMP - 13の場合は、ヘパリンは、電気泳動の実行は片道12で既に後にゲルに追加する必要があります。
ザイモグラフィーは、酵素の変性と再生の後に酵素活性を測定するので、試料中に存在するすべてのMMPの活性を測定します。これは、酵素、プロ酵素、及び内因性阻害剤(例えば、TIMP - 2)に結合した酵素が含まれています。それはわずかに高い分子量を持つ活性酵素のとプロ酵素のそのバンドの密度を、比較することにより、サンプル中のMMP活性のレベルを決定することは可能です。
ザイモグラフィーは頻繁にMMPを識別するのに十分ではありません。既知の分子量を基準とMMPの移行レベルの比較では、識別に役立つありませんが、これらの規格の一部が還元剤を含んでおり、その非還元条件下で使用したときには9種類の分子量を示すかもしれないことに注意すべきである。オプションは、テストサンプルと同じゲル上可溶性組換えMMPをロードすることです。 MMPは、しかし、見かけの分子量の変化を誘導し、他のタンパク質に関連付けられる場合があります。選択的MMP阻害剤はinterest.A第二の技術(ウェスタンブロット、免疫細胞化学、またはELISA)のMMPをすることをお勧めしますアイデンティティへの薬理学的ツールとして開発し、バッファ内のインキュベーションの間にゲル(または半分にゲルカットの部分)を追加することができます興味のMMPの同定に役立つ。これはウェスタンブロット法の検出限界は、このテクニックを使用するときに潜在的に偽陰性の結果につながる、しばしばzymographicゲルのものよりもはるかに低いことに留意すべきである。
開示事項
謝辞
我々は、細胞培養上清中のMMPの濃度を増加させるタンパク質集線装置の使用を示唆するため博士S.レスラーを(分子細胞生物学教室、ベイラー医科大学)に感謝いたします。
このプロジェクトは、(AR059838)ミセスクリフォードエルダーホワイトグラハム寄附研究基金とNIH / NIAMSからCBへの補助金によって支えられている。内容はもっぱら著者の責任であり、必ずしもNIHの公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Xcell SureLock Mini-Cell CE mark electrophoresis apparatus | Invitrogen | EI0001 | |
| Power supply (model 302) | VWR international | 93000-744 | |
| Novex 10% gelatin zymogram gels, 1.0 mm, 12 wells | Invitrogen | EC61752BOX | |
| Blue Juice gel loading buffer | Invitrogen | 10816015 | |
| Gel loading tips | VWR international | 53509-015 | |
| Protein molecular weight standard | Invitrogen | LC5800 | |
| Novex Tris-Glycine-SDS running buffer | Invitrogen | LC2675 | |
| Novex zymogram renaturing buffer | Invitrogen | LC2670 | |
| Novex zymogram developing buffer | Invitrogen | LC2671 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | |
| Epson Perfection 4490 Photo Scanner | Amazon | n/a | |
| ImageJ software | http://rsbweb.nih.gov/ij/ | n/a | Authored by W. Rasband, NIH/NIMH |
参考文献
- Luo, J. The role of matrix metalloproteinases in the morphogenesis of the cerebellar cortex. Cerebellum. 4, 239-245 (2005).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors - diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Kessenbrock, K., Plaks, V., Werb, Z. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. 141, 52-67 (2010).
- Lagente, V., Boichot, E. Role of matrix metallopreoteinases in the inflammatory process of respiratory diseases. J. Mol. Cell. Cardiol. 48, 440-444 (2010).
- Rodríguez, D., Morrison, C. J., Overall, C. M. Matrix metallopreoteinases: what do they not do? New substrates and biological roles identified by murine models and proteomics. Biochim. Biophys. Acta. 1803, 39-54 (2010).
- Bourboulia, D., Stetler-Stevenson, W. G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): positive and negative regulators in tumor cell adhesion. Semin. Cancer Biol. , (2010).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochem. , 102-196 (1980).
- Lombard, C., Saulnier, J., Wallach, J. Assays of matrix metalloproteinases (MMPs) activities: a review. Biochimie. 87, 265-272 (2005).
- Snoek-van Beurden, P. A., Von den Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques. 38, 73-83 (2005).
- Kupai, K., Szucs, G., Cseh, S., Hajdu, I., Csonka, C., Csont, T., Ferdinandy, P. Matrix metalloproteinase activity assays: importance of zymography. J. Pharmacol. Toxicol. Methods. 61, 205-209 (2010).
- Kleiner, D. E., Stetler-Stevenson, W. G. Quantitative zymography: detection of pictogram quantities of gelatinases. Anal. Biochem. 218, 325-329 (1994).
- Yu, W. H., Woessner, J. F. Heparin-enhanced zymographic detection of matrilysin and collagenases. Anal. Biochem. 293, 38-42 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved