Method Article
La detección de metaloproteinasas de la matriz funcional por Zymography
En este artículo
Resumen
Este protocolo describe un ensayo basado en actividades para la detección de metaloproteinasas de la matriz en sobrenadantes de cultivo o los fluidos corporales.
Resumen
Metaloproteinasas de matriz (MMP) son endopeptidasas que contienen zinc. Se degradan las proteínas de la escisión de los enlaces peptídicos. Más de una veintena de MMPs han sido identificados y se dividen en seis grupos según su estructura y especificidad de sustrato (colagenasas, gelatinasas, tipo de membrana [MT-MMP], estromelisinas, matrilysins, y otros). MMP juegan un papel crítico en la invasión celular, la degradación del cartílago, la remodelación de tejidos, la cicatrización de heridas, y la embriogénesis. Por lo tanto, participar en los procesos normales y en la patogénesis de muchas enfermedades, como la artritis reumatoide, cáncer o enfermedad pulmonar obstructiva crónica 1-6. Aquí, nos centraremos en la MMP-2 (gelatinasa A, colagenasa tipo IV), una MMP ampliamente expresada. Vamos a demostrar cómo detectar MMP-2 en los sobrenadantes de cultivo celular por zymography, uno de uso común, técnica simple, pero muy sensible describió por primera vez en 1980 por C. Heussen y EB 10.7 Dowdle. Esta técnica es semi-cuantitativo, por lo tanto, se puede utilizar para determinar los niveles de MMP en las muestras cuando las concentraciones conocidas de MMP recombinante se cargan en el mismo gel 11.
Las soluciones que contienen MMPs (por ejemplo, sobrenadantes de cultivo celular, la orina o el suero) se cargan en un gel de poliacrilamida que contiene dodecil sulfato sódico (SDS, para linealizar las proteínas) y gelatina (sustrato de la MMP-2). El tampón de la muestra está diseñada para aumentar la viscosidad de la muestra (para facilitar la carga de gel), proporcionan un medio de seguimiento (azul de bromofenol, para controlar la migración de la muestra), proporcionan moléculas de desnaturalización (para linealizar las proteínas), y controlar el pH de la muestra. Las proteínas se dejan de migrar en una corriente eléctrica en un tampón de diseñado para proporcionar una tasa de migración constante. La distancia de la migración está inversamente correlacionado con el peso molecular de la proteína (proteínas pequeñas se mueven más rápido a través del gel de proteínas de gran tamaño y por lo tanto no migran más por el gel). Después de la migración, el gel se coloca en un buffer de renaturalización de las proteínas permiten a recuperar su estructura terciaria, es necesario para la actividad enzimática. El gel se coloca en un búfer de desarrollo diseñado para permitir la proteasa para digerir su sustrato. El tampón de desarrollo también contiene p-aminophenylmercuric acetato (APMA) para activar el no proteolíticas pro-MMP a MMP activas. El siguiente paso consiste en teñir el sustrato (la gelatina en nuestro ejemplo). Después de lavar el exceso de tinte el gel, las áreas de la digestión de la proteasa aparecen como bandas claras. La más clara de la banda, la mayor concentración de la proteasa que contiene. Intensidad de la banda de tinción puede ser determinada por densitometría, utilizando un software como ImageJ, que permite la comparación de la muestra.
Protocolo
1. Cargar y ejecutar el Gel
- Todas las muestras deben prepararse adecuadamente para mantener la función de las enzimas y se utiliza inmediatamente después de la recolección o congelarse a -80 ° C. Las muestras no deben contener agentes reductores (por ejemplo, una β-mercaptoetanol) o ser hervida antes de cargar el gel.
- Abrir la bolsa que contiene un gel interior de un cassette, el cassette de enjuague con agua destilada.
- Quitar la cinta protectora de la parte inferior de la cinta y el peine de la parte superior del gel.
- Lave los pocillos tres veces con tampón de (diluida a 1X en agua destilada).
- Colocar el gel en la Mini-célula, asegurando que el lado más pequeño de la cinta se enfrenta hacia el interior. Encaje en su sitio con la Cuña tensión Gel. El Mini-celular permite ejecutar uno o dos geles en paralelo.
- Llene la parte superior (interior) de cámara con 1X tampón de pozos por encima del nivel, comprobar que no existen fugas. En caso de fugas, quitar el tampón y la posición del gel.
- Llenar la cámara baja con amortiguador 1X en funcionamiento.
- Carga de 10 l de marcador molecular de la proteína en un pozo.
- Mezcle una cantidad igual de buffer de gel de carga y de la muestra y la carga en los pocillos del gel con carga de gel-tips (cambia entre cada muestra). Estos pozos se puede cargar con hasta 20 l totales.
- Coloque la tapa de la célula de Mini y conectar los cables de los electrodos a la fuente de alimentación. Interruptor de la fuente de alimentación y lo puso a correr a 125 V constantes durante 90 minutos. Compruebe la formación de pequeñas burbujas en el cable de la cámara baja, lo que indica la circulación actual.
- Cuando se ejecuta el primer gel, monitorear el progreso de la migración cada 15 minutos, utilizando el azul de bromofenol incluido en el tampón de carga como un indicador. Deje correr el gel hasta que el colorante indicador alcanza el fondo del gel.
2. Renaturalización y desarrollo del Gel
- Para cada gel, preparar 100 ml de 1X buffer de renaturalización y 200 ml de tampón de desnaturalización, tanto en agua destilada.
- Cuando el colorante azul de bromofenol seguimiento llega a la parte inferior del gel, cambiar la fuente de alimentación, abra la celda Mini-, y quitar el gel. Separar los dos lados de la cinta con el cuchillo en gel (o una espátula de pesaje). Corte una esquina para marcar la dirección del gel.
- Retire con cuidado el gel de la bandeja y coloque en un envase de 100 ml de tampón de renaturalización. Incubar durante 30 minutos a temperatura ambiente con agitación suave.
- Eliminar el buffer de renaturalización y añadir 100 ml de buffer en el desarrollo de gel. Incubar durante 30 minutos a temperatura ambiente con agitación suave.
- Quitar el tampón en desarrollo y añadir 100 ml de solución tampón más desarrollo para el gel. Incubar toda la noche (16-18 horas) a 37 ° C.
- Quitar el tampón en desarrollo y enjuáguese la boca tres veces (5 minutos cada uno) con agua destilada bajo agitación suave a temperatura ambiente.
- Escanear el gel para guardar la posición exacta de las bandas de proteínas estándar, ya que serán menos visibles o no después de la tinción del gel.
- Tinción del gel mediante la adición de 20 ml de SimplyBlue Safestain al gel. Incubar durante 1 hora a temperatura ambiente bajo agitación suave.
- Retire la SafeStain SimplyBlue y de la mancha de gel de 100 ml o más agua desionizada durante una hora a temperatura ambiente bajo agitación suave.
- Para obtener mejores resultados, reemplace con agua fresca desionizada y se incuba durante una hora o más a temperatura ambiente bajo agitación suave.
3. Análisis de Datos
- Retire con cuidado el gel del agua y colóquelo en un protector de plástico.
- Escanear el gel con una resolución de 300 ppp o más. Guardar la imagen en formato TIFF (Figura 1).
- Medir intensidades de las bandas con ImageJ (u otro software similar).
- Abra el archivo TIFF en ImageJ (Figura 1).
- Visualizar en blanco y negro seleccionando la opción "Imagen>> Tipo de 8 bits" (fig. 1B).
- Use la herramienta de selección rectangular para delinear la primera banda, dibujando un rectángulo al menos dos veces más alta que ancha (esto es un requisito de software).
- Presione "1" o seleccione "Analizar> Geles> Elige primero el carril" y la banda se indica.
- Un rectángulo de nuevo aparecen, se mueven a la banda y seleccionar "Análisis> Geles> Seleccione carril que viene". Repita hasta que todas las bandas son seleccionados (fig. 1B).
- Presione "3" o seleccione "Analizar> Geles> carriles Plot" para generar el gráfico de perfil para cada banda (fig. 1C).
- Utilice la selección de línea recta (ya debe estar seleccionado automáticamente) para dibujar las líneas de base, de modo que el pico de interés es un área completamente cerrada.
- Seleccione la herramienta varita mágica y haga clic en el interior de cada pico para seleccionarlo.
- Seleccione "Analizar> Geles> picos Label" para obtener una tabla con el área de cada pico seleccionado. Estos datos se pueden representar como tales (Figura 1D) o puede ser normalizada con el valor de una banda elegida. Esta normalización es especialmente importante cuando se agruparon los valores de varios geles replicar para determinar la significación estadística de los resultados.
4. Resultados representante
Se muestra un gel con 11 pozos cargados con diferentes sobrenadantes de cultivo de células que contienen diferentes cantidades de MMP-2 (Figura 1). La observación directa de este gel muestran diferencias obvias en las concentraciones de MMP-2 entre algunos de los pozos. Por ejemplo, está claro que los pozos 4 y 5 contienen mucho más que la MMP-2 y # 11, o bien hasta 10 #. Para la cuantificación objetiva de las bandas que han utilizado la densitometría con el software ImageJ (Figura 1B-D), lo que confirma una diferencia de aproximadamente 4 veces en la MMP-2 entre las cantidades y # 11 y los pozos 4 y 5 y una diferencia de aproximadamente 2 veces en MMP-2 entre las cantidades y # 10 y # pozos 4 y 5.

Figura 1. Detección de MMP-2 por zymography gelatina. Una imagen, escaneada de un gel de gelatina. Números también se indican en la parte superior del gel. B, gel Igual que en una muestra en blanco y negro de la densitometría. Cada grupo fue seleccionado con un rectángulo en ImageJ. C, dos ejemplos de los perfiles de la densitometría para el gel mostrado en A y B (bandas # 4 y # 11). Una línea recta que se elaboró en la base de cada pico para crear un área cerrada. D, Parcela de las áreas de pico para el gel mostrado en A y B antes (izquierda) y después (derecha) la normalización de la densidad de la banda # 1.
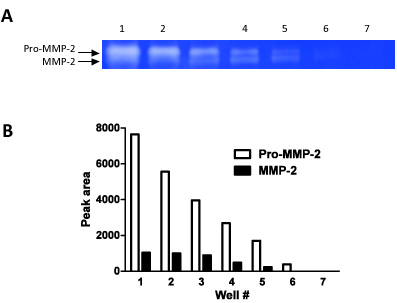
Figura 2. Esta cifra demuestra cómo zymography se puede utilizar como una técnica semi-cuantitativo. Hemos cargado diluciones seriadas (pasos de 1:01 diluciones) en 7 pozos consecutivos y se mide la densidad de banda para los pro-MMP-2 y MMP-2.
Discusión
Hemos demostrado cómo realizar el análisis zimográfico de MMP-2 en el sobrenadante de cultivo celular.
La cantidad de muestra a la carga en un gel debe ser determinada empíricamente en función del origen y MMP de interés. Carga demasiado poco evitar su detección durante la carga en exceso puede conducir a la saturación, ya que es único sustrato tanto una proteasa pueden digerir en el área de la banda. Si es necesario, la muestra se puede diluir en agua desionizada antes de mezclarse con tampón de carga o el tiempo de desarrollo puede reducirse de la noche a 4 horas. También es posible concentrar las proteínas de una solución a base de concentradores (por ejemplo, catálogo Millipore # UFC803024). Si las bandas siguen siendo apenas visible, puede ser necesario el desarrollo de los geles durante un largo periodo de tiempo, incluso hasta 48 horas. En la preparación de las muestras de los sobrenadantes de cultivo de tejidos, cabe señalar que el suero fetal bovino (y otros sueros) contiene MMPs que pueden afectar los resultados. Por esta razón, recogemos todas nuestras sobrenadantes después de la cultura en el medio libre de suero.
Los lavados se describe en los párrafos 2.9 y 2.10 del protocolo es necesario para eliminar el fondo de tinción de las bandas de digerir. Veces más tiempo de lavado se eliminan más de fondo, pero se atenúa también la coloración del sustrato a través del gel. Si ya los tiempos de lavado son necesarias, se recomienda escanear el gel a cada rato para seleccionar el escaneo con el mejor contraste.
Esta técnica puede utilizarse para detectar otras MMP. Por ejemplo, la MMP-9 puede ser detectada en geles de gelatina, y también en menor medida MMP-1, MMP-8 y MMP-13 como la gelatina no es el sustrato preferido. MMP-1 y MMP-13 se detecta más fácilmente en zimografía colágeno, mientras que la caseína es el sustrato preferido para la MMP-11 y también permite la detección de MMP-1, MMP-3, MMP-7, MMP-12, y MMP-13 9. MMP-7 (matrilisina) y colagenasas (MMP-1 y MMP-13) son difíciles de detectar cuando están presentes en bajas concentraciones en caseína o geles de gelatina. Además de la heparina a la muestra en el momento de carga de gel mejora significativamente el límite de detección de MMP-7. De MMP-1 y MMP-13, la heparina se debe agregar el gel después de la electroforesis ya está en marcha 12.
Dado que las medidas de zymography actividad enzimática después de la desnaturalización y renaturalización de las enzimas, se medirá la actividad de todas las MMPs presente en la muestra. Esto incluye las enzimas, las enzimas pro-, y enzimas ligadas a los inhibidores endógenos (por ejemplo, TIMP-2). Sin embargo, es posible determinar el nivel de activación de MMP en la muestra mediante la comparación de la densidad de banda de la enzima activa y de la de la pro-enzima, que tendrá un peso molecular ligeramente superior.
Zymography a menudo no es suficiente para identificar un MMP. Comparación del nivel de migración de un sistema de RPP con estándares de peso molecular conocido le ayuda en la identificación, pero hay que señalar que algunas de estas normas contienen un agente reductor y que cuando se usa bajo condiciones no reductoras pueden indicar diferentes pesos moleculares 9. Una opción es cargar una MMP recombinante soluble en el mismo gel, como las muestras de prueba. MMPs sin embargo puede estar asociada con otras proteínas, induciendo un cambio en el peso molecular aparente. Los inhibidores selectivos de MMP se pueden añadir al gel (o parte de un recorte en gel por la mitad) durante la incubación en buffer de desarrollo como herramientas farmacológicas para la identidad de la MMP de la técnica interest.A segundo (Western Blot, inmunocitoquímica, o ELISA) se recomienda ayudar en la identificación de la MMP de interés. Cabe señalar que los límites de detección por Western Blot son a menudo mucho más bajos que los de los geles de zimográfico, que puede conducir a resultados falsos negativos cuando se utiliza esta técnica.
Divulgaciones
Agradecimientos
Nos gustaría agradecer al Dr. S. Ressler (Departamento de Biología Molecular y Celular, Facultad de Medicina Baylor) por sugerir el uso de concentradores de proteínas para aumentar la concentración de MMP en los sobrenadantes de cultivo celular.
Este proyecto fue apoyado por subvenciones del Fondo de la señora Clifford pastor White Investigación Graham Dotado y el NIH / NIAMS (AR059838) al CB. El contenido es responsabilidad exclusiva de sus autores y no representa necesariamente las opiniones oficiales de los NIH.
Materiales
| Name | Company | Catalog Number | Comments |
| Xcell SureLock Mini-Cell CE mark electrophoresis apparatus | Invitrogen | EI0001 | |
| Power supply (model 302) | VWR international | 93000-744 | |
| Novex 10% gelatin zymogram gels, 1.0 mm, 12 wells | Invitrogen | EC61752BOX | |
| Blue Juice gel loading buffer | Invitrogen | 10816015 | |
| Gel loading tips | VWR international | 53509-015 | |
| Protein molecular weight standard | Invitrogen | LC5800 | |
| Novex Tris-Glycine-SDS running buffer | Invitrogen | LC2675 | |
| Novex zymogram renaturing buffer | Invitrogen | LC2670 | |
| Novex zymogram developing buffer | Invitrogen | LC2671 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | |
| Epson Perfection 4490 Photo Scanner | Amazon | n/a | |
| ImageJ software | http://rsbweb.nih.gov/ij/ | n/a | Authored by W. Rasband, NIH/NIMH |
Referencias
- Luo, J. The role of matrix metalloproteinases in the morphogenesis of the cerebellar cortex. Cerebellum. 4, 239-245 (2005).
- Pasternak, B., Aspenberg, P. Metalloproteinases and their inhibitors - diagnostic and therapeutic opportunities in orthopedics. Acta Orthop. 80, 693-703 (2009).
- Kessenbrock, K., Plaks, V., Werb, Z. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. 141, 52-67 (2010).
- Lagente, V., Boichot, E. Role of matrix metallopreoteinases in the inflammatory process of respiratory diseases. J. Mol. Cell. Cardiol. 48, 440-444 (2010).
- Rodríguez, D., Morrison, C. J., Overall, C. M. Matrix metallopreoteinases: what do they not do? New substrates and biological roles identified by murine models and proteomics. Biochim. Biophys. Acta. 1803, 39-54 (2010).
- Bourboulia, D., Stetler-Stevenson, W. G. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): positive and negative regulators in tumor cell adhesion. Semin. Cancer Biol. , (2010).
- Heussen, C., Dowdle, E. B. Electrophoretic analysis of plasminogen activators in polyacrylamide gels containing sodium dodecyl sulfate and copolymerized substrates. Analytical Biochem. , 102-196 (1980).
- Lombard, C., Saulnier, J., Wallach, J. Assays of matrix metalloproteinases (MMPs) activities: a review. Biochimie. 87, 265-272 (2005).
- Snoek-van Beurden, P. A., Von den Hoff, J. W. Zymographic techniques for the analysis of matrix metalloproteinases and their inhibitors. Biotechniques. 38, 73-83 (2005).
- Kupai, K., Szucs, G., Cseh, S., Hajdu, I., Csonka, C., Csont, T., Ferdinandy, P. Matrix metalloproteinase activity assays: importance of zymography. J. Pharmacol. Toxicol. Methods. 61, 205-209 (2010).
- Kleiner, D. E., Stetler-Stevenson, W. G. Quantitative zymography: detection of pictogram quantities of gelatinases. Anal. Biochem. 218, 325-329 (1994).
- Yu, W. H., Woessner, J. F. Heparin-enhanced zymographic detection of matrilysin and collagenases. Anal. Biochem. 293, 38-42 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados