A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحت الجلد من العدوى المكورات العنقودية المذهبة المقاومة للميثيسيلين (MRSA)
In This Article
Summary
ويستخدم الجلد الناعمة والفئران نموذج عدوى الأنسجة لتقييم وظيفة ضراوة المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA) والاستجابات المناعية المضيف. هنا ، وقدمنا نموذجا العدوى تحت الجلد للجلد والأنسجة اللينة العدوى.
Abstract
MRSA يشكل تهديدا للصحة العامة في جميع أنحاء العالم ، وهذه الجرثومة الجلد والتهابات الأنسجة الرخوة تمثل الآن أكثر من نصف جميع الإصابات الأنسجة الناعمة في الولايات المتحدة. بين عدوى الأنسجة الرخوة ، تم العضل ، التهاب العضل القيحي ، والتهاب اللفافة الناخر ذكرت على نحو متزايد بالتعاون مع هذه الجرثومة التي تنشأ من المجتمع. لفهم التفاعل بين هذه الجرثومة والحصانة مما أدى إلى إصابة تستضيف أكثر شدة ، وتوافر نماذج حيوانية أمر بالغ الأهمية ، والسماح لدراسة المضيفة والعوامل الجرثومية. وقد أدخلت عدة نماذج العدوى المرضية لتقييم س. المكورات خلال العدوى الجلدية السطحية. هنا ، نحن تصف نموذجا العدوى تحت الجلد أن يفحص الجلد وتحت الجلد ، وأمراض العضلات.
Protocol
1. إعداد لهذه الجرثومة العدوى (قبل يومين من العدوى)
- تلقيح a loopful هذه الجرثومة من ثقافة الأسهم إلى آغار الدم (Trypticase آجار الصويا (TSA)) لوحة.
- التحقق من النمط الظاهري انحلال الدم (منطقة واضحة حول كل مستعمرة) على لوحة آغار الدم.
- اختيار مستعمرة الذي يحتوي على النمط الظاهري الانحلالي التي تنسجم مع التجارب الأخرى.
- تلقيح مستعمرة إلى 3 مل مرق تود هيويت (THB) ، مع المضادات الحيوية المعتمد عند الضرورة ، في أنبوب 15 مل توج الإضافية.
- احتضان عند 37 درجة مئوية خلال الليل مع اهتزاز عند 220 دورة في الدقيقة.
2. اعداد الفئران للعدوى (قبل يوم واحد للعدوى)
- اعتمادا على حجم الفئران ، وحلق الفراء قبالة منطقة 4 × 3 سم على ظهر الفئران.
- تطبيق ~ 5 ملم مزيل الشعر كريم 3 (شراؤها من مخازن الأدوية المحلية) لمنطقة الحلق.
- السماح لكريم مزيل الشعر لاحتضان على سطح الجلد لحوالي 1 دقيقة.
- مناشف ورقية مبللة DDH 2 O.
- تمحو كريم مزيل الشعر مع منشفة ورقية مبللة.
3. إعداد لهذه الجرثومة العدوى (يوم العدوى)
- تمييع ثقافة البكتيرية بين عشية وضحاها في 1:500 إلى 1:1000 مع 10 مل من قبل THB تحسنت ، في أنبوب 50 مل توج برغي.
- احتضان عند 37 درجة مئوية لمدة ما يقرب من 2.5 ساعات مع اهتزاز عند 220 دورة في الدقيقة ، حتى يصل إلى 540 ألف 2.5.
- جمع هذه الجرثومة بواسطة الطرد المركزي في 3225 x ج لمدة 10 دقيقة على 4 درجات مئوية.
- تجاهل طاف.
- Resuspend الكرية الجرثومي في الفوسفات في 10 مل Dulbecco مخزنة المالحة (DPBS).
- كرر الخطوات من 3 و 4.
- Resuspend الكرية الجرثومي في DPBS في التركيز المطلوب.
- مخفف تسلسليا تعليق بكتيرية من 10 يناير -- 10 أغسطس.
- تعليق لوحة المخفف البكتيرية على لوحات أجار الدم.
- احتضان لوحات عند 37 درجة مئوية خلال الليل.
- مراقبة وتسجيل النمط الظاهري للقائح الانحلالي.
- عد مستعمرة (CFU) الرقم على لوحة.
- حساب قائح على أساس عدد CFU على طبق من ذهب.
4. تحت الجلد العدوى من هذه الجرثومة (يوم العدوى و 3 أيام بعد العدوى)
- حقن تحت الجلد البكتيرية ميكرولتر 100 تعليق في منطقة الحلق.
- مراقبة الحيوانات لمدة 3 إلى 5 ساعات بعد الحقن للتأكد من الفئران على قيد الحياة.
- مراقبة الآفة على الجزء الخلفي من هذه الحيوانات يوميا وتسجل منطقة الآفة يوميا عند الحاجة إليها. وينبغي أن تشمل مراقبة الآفة تسجيل حجم الآفة والتشكل. وكلا quantitated آفات الجلد والعضلات بضرب طول وعرض الآفة. الآفات بشكل غير منتظم على شكل الحاجة إلى تقسيمها إلى أجزاء أصغر متناظرة ، وقياس كل قطعة من نفس الأسلوب. قد قياسات الآفة أيضا استخدام بمساعدة الحاسوب برنامج التقييم القياس النسيجي (ImageJ ؛ مفتوح المصدر متوفر من المعاهد الوطنية للصحة في http://rsb.info.nih.gov/ij/ ) 2.
- التضحية الحيوانات في اليوم 3 بعد العدوى عن طريق استنشاق isoflurane تليها خلع عنق الرحم.
- مراقبة وتسجيل الآفة على الجلد.
- نك الجلد مع زوج من مقص العقيمة.
- قشر الجلد قبالة بعناية ومراقبة وتسجيل الآفة على العضلات.
- استئصال آفة وحوالي 2 -- 5 ملم من المنطقة المحيطة بها.
- جمع الطحال والكليتين.
- تجانس الأنسجة باستخدام الخالط الأنسجة أو عن طريق التطبيق المتكرر لالمكبس من المحاقن مل 1 إلى أنبوب microfuge تحتوي على أنسجة و 100 ميكرولتر من DPBS.
- إضافة 900 ميكرولتر من DPBS لكل أنبوب.
- دوامة العينات لمدة 5 دقائق.
- تمييع تعليق متسلسل مع DPBS 10 يناير -- 10 يونيو.
- لوحة للتعليق على لوحات THA المخفف.
5. ممثل النتائج :
- مباشرة بعد كل حقنة تحت الجلد ، سوف يلاحظ وجود فقاعة على سطح الجلد عندما يتم العدوى بشكل صحيح (الشكل 1A). إذا لوحظ أي فقاعة على سطح الجلد ، قد يكون الحقن العميق جدا ، وهذا قد يؤثر على نتيجة العدوى (حجم الآفة ، CFU).
- تعليق البكتيرية يحتاج إلى تخفيفه بشكل متسلسل وCFU بحاجة إلى أن تدرس على لوحات أجار الدم لكل تجربة. وهذه الخطوة تعطي معلومات هامة : 1) ما إذا كان قد قائح النمط الظاهري متجانسة ؛ 2) بالضبط العد البكتيري قابلة للعدوى.
- ويمكن تقييم الآفات وبقاء البكتيريا في نقاط زمنية مختلفة بعد العدوى. هنا ، ودرسنا في اليوم 3 العدوى بعد الإصابة. ويتم تحليل أحجام الآفة على سطح الجلد (1B الشكل : 1X 10 9 ؛ 1D الشكل : 1 × 10 7 CFU) ، وعلى سطح العضلة (الشكل 1C : 1X 10 9 ؛ الشكل 1E : 1 × 10 7 CFU). منطقة الآفة يساوي طول (مم) ويمكن قياس × العرض (مم) لتقييم الاضرار التي تلحق بالانسجة (الشكلان 2 ألف وباء). هذه النتيجة قد تساعد على تحديد مدى الضرر الناجم عن الأنسجة عامل الفوعة معين. بالإضافة إلى ذلك ، يتم استئصال الآفات والمتجانس في DPBS ، ومطلي لquantitate عدد CFU (الشكل 2C) ، مما يدل على استمرارية هذه البكتيريا في موقع الإصابة.
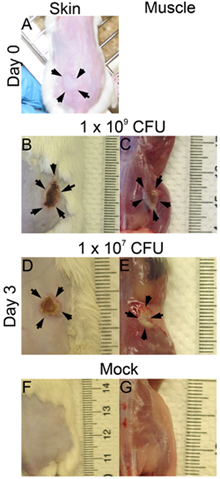
الشكل 1. وقد طعمت وآفات الجلد والعضلات. CD1 الفئران تحت الجلد على الجناح واحدة مع هذه الجرثومة (أمريكا اللاتينية والكاريبي). تم التقاط الصور في الوقت واليوم 0 3 بعد العدوى. (أ) من الزمن 0 بعد العدوى (بي) ، (B) -- (G) يوم 3 بي ، باء ، دال وواو : آفات الجلد ، C ، E ، G و: آفات العضلات ؛ B و C : 1X 10 9 CFU المصابة ؛ D و E : 1X 10 7 CFU المصابة ؛ F و G : وهمية.
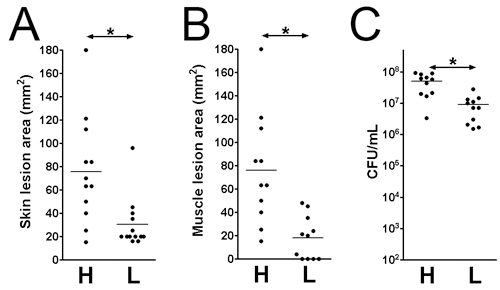
الشكل 2. حجم آفة الجلد والبكتيريا قادرة على البقاء في موقع العد العدوى الجلدية في اليوم 3. بعد العدوى والآفات العضلات على هذه الجرثومة (LAC) المصابة CD1 الفئران. (أ) حجم الآفة الجلدية. (ب) حجم العضلات الآفة. (C) CFU مجموع الأنسجة. H : 1 × 10 قائح CFU 9 ؛ L : 1 × 10 قائح CFU 7. * : P <0.05 ، مان ويتني الاختبار.
Discussion
- البشرة الناعمة والفئران نموذج عدوى الأنسجة هو أداة قوية لتقييم الفوعة في الجسم الحي من الممرض. المرضية التى S. قد عدوى المكورات في أنسجة البشرة ناعمة وتختلف تبعا لعدد من المعلمات. وتشمل هذه حجم قيحة والجرثومية مرحلة النمو ، وعمق من التلقيح ...
Disclosures
Acknowledgements
وأيد هذا العمل من قبل على جائزة شهادة بوروز ويلكوم ، والمعاهد الوطنية للصحة منح AI074832 ليو غراي.
Materials
| Name | Company | Catalog Number | Comments |
| THB | VWR international | 95025-314 | |
| DPBS | Invitrogen | 21-031-CV | |
| 1 ml syringe | BD Biosciences | 309602 | |
| 27G1/2 needle | BD Biosciences | 305109 | |
| Sheep Blood Agar (TSA) | VWR international | 90004-328 |
References
- Ahn, J. Y., Song, J. Y., Yun, Y. S., Jeong, G., Choi, I. S. Protection of Staphylococcus aureus-infected septic mice by suppression of early acute inflammation and enhanced antimicrobial activity by ginsan. FEMS Immunol Med Microbiol. 46, 187-197 (2006).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41, 47-47 (2004).
- Hahn, B. L., Onunkwo, C. C., Watts, C. J., Sohnle, P. G. Systemic dissemination and cutaneous damage in a mouse model of staphylococcal skin infections. Microb Pathog. 47, 16-23 (2009).
- Hruz, P., Zinkernagel, A. S., Jenikova, G., Botwin, G. J., Hugot, J. P., Karin, M., Nizet, V., Eckmann, L. NOD2 contributes to cutaneous defense against Staphylococcus aureus through alpha-toxin-dependent innate immune activation. Proc Natl Acad Sci U S A. 106, 12873-12878 (2009).
- Ji, Y., Zhang, B., Van, S. F., Horn, P. W. a. r. r. e. n., Woodnutt, G., Burnham, M. K., Rosenberg, M. Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science. 293, 2266-2269 (2001).
- Somerville, G. A., Beres, S. B., Fitzgerald, J. R., DeLeo, F. R., Cole, R. L., Hoff, J. S., Musser, J. M. In vitro serial passage of Staphylococcus aureus: changes in physiology, virulence factor production, and agr nucleotide sequence. J Bacteriol. 184, 1430-1437 (2002).
- Tseng, C. W., Kyme, P., Low, J., Rocha, M. A., Alsabeh, R., Miller, L. G., Otto, M., Arditi, M., Diep, B. A., Nizet, V., Doherty, T. M., Beenhouwer, D. O., Liu, G. Y. Staphylococcus aureus Panton-Valentine leukocidin contributes to inflammation and muscle tissue injury. PLoS One. 4, e6387-e6387 (2009).
- von Kockritz-Blickwede, M., Rohde, M., Oehmcke, S., Miller, L. S., Cheung, A. L., Herwald, H., Foster, S., Medina, E. Immunological mechanisms underlying the genetic predisposition to severe Staphylococcus aureus infection in the mouse model. Am J Pathol. 173, 1657-1668 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved