このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
メチシリン耐性黄色ブドウ球菌(MRSA)の皮下感染
要約
マウスの皮膚および軟部組織感染症のモデルは、メチシリン耐性黄色ブドウ球菌(MRSA)およびホストの免疫応答の病原性の機能を評価するために利用されている。ここで、我々は、皮膚および軟部組織感染症のための皮下感染モデルを発表した。
要約
MRSAは、公衆衛生の世界的な脅威であり、MRSAの皮膚および軟部組織感染症は現在、より多くの米国内のすべての軟部組織感染症の半分以上を占めている。間の軟部組織感染症、筋炎、化膿性筋炎、および壊死性筋膜炎は、ますますMRSAが地域社会から生じると関連して報告されている。 MRSAと、より重篤な感染症につながる宿主免疫間の相互作用を理解するために、動物モデルの可用性は、宿主と細菌の要因の調査を可能にする、非常に重要です。いくつかの感染症のモデルがSの病因を評価するために導入されている表在性皮膚感染症の間に黄色ブドウ球菌 。ここで、我々は、皮膚、皮下、および筋肉の病理を調べる皮下感染モデルを説明します。
プロトコル
1。感染のためにMRSAを準備する(感染の2日前)
- 株式の培養液から血液寒天(トリプチケースソイ寒天培地(TSA))プレートへのMRSAの白金耳を接種する。
- 血液寒天プレート上に溶血の表現型を(それぞれのコロニーの周りをクリアゾーン)を確認してください。
- 他の実験との整合性溶血性表現型を持つコロニーを選択してください。
- 15 mLのスナップキャップチューブに、充当抗生物質、必要に応じて、3 mLのトッドヒューイットブイヨン(THB)にコロニーを接種。
- 220rpmで振盪しながら37℃で一晩インキュベートする。
2。感染のためにマウスを準備する(感染前日)
- マウスのサイズに応じて、マウスの裏面に3 × 4 cmのエリアから毛皮を剃る。
- 剃毛エリアに〜5 mm 3の脱毛剤クリームを(ローカルドラッグストアから購入)を適用します。
- 脱毛剤クリームは約1分間皮膚表面にインキュベートすることができます。
- のddH 2 Oのウェットペーパータオル
- ぬれた紙タオルで脱毛剤クリームをふき取ってください。
3。 (感染の日に)感染のためにMRSAの準備
- 50mLのスクリューキャップチューブに、予め温めておいたTHB 10mLで1:500で1:1000に一晩細菌培養液を希釈する。
- ° Cで約2.5時間540が 2.5に達するまで、220rpmで振盪しながら37℃でインキュベートする。
- 4℃で10分間3225 × gで遠心分離によってMRSAを収集℃に
- 上清を捨てる。
- 10mLのダルベッコのリン酸塩バクテリアペレットを再懸濁さ生理食塩水(DPBS)はバッファ。
- 手順3と4を繰り返します。
- 所望の濃度でDPBSでバクテリアペレットを再懸濁します。
- シリアル10 1 10 8に細菌懸濁液を希釈する。
- 血液寒天プレート上にプレート希釈細菌懸濁液を。
- 37℃で一晩培養する。
- 接種材料の溶血性表現型を観察し、記録する。
- プレート上でコロニー形成単位(CFU)の数カウント。
- プレート上のCFUの数に基づいて接種を計算する。
4。 MRSAの皮下感染(感染日と3日後の感染症について)
- 剃毛面積の皮下100μL細菌懸濁液を注入する。
- マウスが生きていることを確認するため、注入後3〜5時間のために動物を観察。
- 毎日の動物の背面にある病変を観察し、それが必要なときに毎日の病変面積を記録。病変の観察は、病変のサイズと形態の記録を含める必要があります。皮膚と筋肉の病変の両方は、病変の長さと幅を乗じて定量される。不規則な形状の病変は、より小さな対称の部分に分割し、各部分が同一の方法で測定する必要があります。 、病変の測定には、コンピュータ支援組織形態評価プログラム(でNIHから入手できるオープンソースのImageJを使用することができますhttp://rsb.info.nih.gov/ij/ 2)。
- 頸椎脱臼が続くイソフルランの吸入により3日目、感染後に動物を生け贄に捧げる。
- 皮膚病変を観察し、記録する。
- 滅菌はさみでニックは皮膚。
- 注意深くオフ皮膚の皮と筋肉で病変を観察し、記録する。
- 消費税病変と約2 - 周辺地域から5 mm。
- 脾臓と腎臓を収集する。
- 組織ホモジナイザーを使用して組織をホモジナイズまたは組織とDPBSの100μLを含むマイクロチューブに1 mLのシリンジからプランジャーを繰り返し適用し。
- 各チューブにDPBS 900μLを加える。
- 5分間ボルテックスのサンプルを。
- シリアル10 6にDPBS 10 1との希薄懸濁液。
- THAプレート上にプレートに希釈懸濁。
5。代表的な結果:
- すぐにそれぞれの皮下注射後、ブレブは感染が(図1A)が正しく行われているときに皮膚表面に見られます。何ブレブが皮膚表面で観測されていない場合は、注射が深すぎるかもしれない、とこれは(病変サイズ、CFU)感染症の転帰に影響を与える可能性があります。
- 細菌懸濁液は希釈する必要があるとCFUは、各実験のための血液寒天平板上で検討する必要があります。接種材料は、均質な表現型を持っているかどうかを1);感染症2)正確な生菌数:このステップでは、重要な情報が得られます。
- 病変と細菌の生存には様々な時点で、感染後に評価することができる。ここで、我々は3日、感染後に感染を調べた。と筋肉の表面(図1C上:1 × 10 9:;:病変サイズは皮膚の表面(図1D 1 × 10 9 1 × 10 7 CFU図1B)で分析されています、図1E:1 × 10 7 CFU)。病変面積は、(mm)×幅(mm)の組織の損傷(図2、図B)を評価するために測定される長さと等しくなります。この結果は、特定の病原性因子による組織の損傷の程度を判断するのに役立ちます。さらに、病変を切除し、DPBS中でホモジナイズし、感染部位での細菌の生存率を示すCFUの数を(図2C)、定量するためにメッキされています。
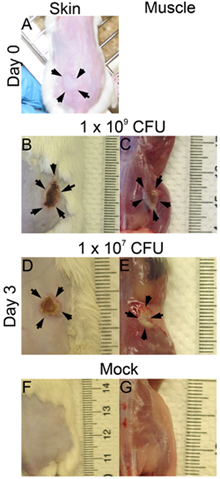
図1。皮膚と筋肉の病変。CD1マウスは、MRSA(LAC)を持つ複数脇腹の皮下に接種した。写真は、時間0と3日目、感染後で撮影したもの。 ()時間0感染後(PI)、(B) - (G)3日目π、B、D.とF:皮膚病変、C、E、およびG:筋肉病変、BとC:1 × 10 9 CFU感染、DとE:1 × 10 7 CFU感染、FとG:モック。
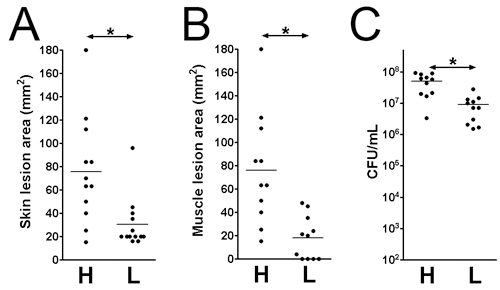
図2。皮膚病変の大きさと生菌は3日、感染後に感染部位の数でカウント。MRSA(LAC)に感染したCD1マウスの皮膚と筋肉の病変。 (A)皮膚病変の大きさ。 (B)筋病変の大きさ。 (C)全組織CFU。 H:1 × 10 9 CFUの接種、L:1 × 10 7 CFUの接種。 *:P <0.05、Mann - Whitney検定。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
- マウスの皮膚および軟部組織感染症モデルでは、病原体の生体毒性評価のための強力なツールです。 S.の病原性皮膚および軟部組織感染症の黄色ブドウ球菌は、パラメータの数によって異なります。これらは、接種量、細菌の増殖期、接種の深さ、マウスの年齢、およびマウスの遺伝的背景7、8が含まれています。このモデルを用いて病原性の機能を調べると?...
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
この作品は、バロウズ、ウェルカムキャリア賞でとGY劉への保健助成金AI074832の国立研究所によってサポートされていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| THB | VWR international | 95025-314 | |
| DPBS | Invitrogen | 21-031-CV | |
| 1 ml syringe | BD Biosciences | 309602 | |
| 27G1/2 needle | BD Biosciences | 305109 | |
| Sheep Blood Agar (TSA) | VWR international | 90004-328 |
参考文献
- Ahn, J. Y., Song, J. Y., Yun, Y. S., Jeong, G., Choi, I. S. Protection of Staphylococcus aureus-infected septic mice by suppression of early acute inflammation and enhanced antimicrobial activity by ginsan. FEMS Immunol Med Microbiol. 46, 187-197 (2006).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41, 47-47 (2004).
- Hahn, B. L., Onunkwo, C. C., Watts, C. J., Sohnle, P. G. Systemic dissemination and cutaneous damage in a mouse model of staphylococcal skin infections. Microb Pathog. 47, 16-23 (2009).
- Hruz, P., Zinkernagel, A. S., Jenikova, G., Botwin, G. J., Hugot, J. P., Karin, M., Nizet, V., Eckmann, L. NOD2 contributes to cutaneous defense against Staphylococcus aureus through alpha-toxin-dependent innate immune activation. Proc Natl Acad Sci U S A. 106, 12873-12878 (2009).
- Ji, Y., Zhang, B., Van, S. F., Horn, P. W. arren, Woodnutt, G., Burnham, M. K., Rosenberg, M. Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science. 293, 2266-2269 (2001).
- Somerville, G. A., Beres, S. B., Fitzgerald, J. R., DeLeo, F. R., Cole, R. L., Hoff, J. S., Musser, J. M. In vitro serial passage of Staphylococcus aureus: changes in physiology, virulence factor production, and agr nucleotide sequence. J Bacteriol. 184, 1430-1437 (2002).
- Tseng, C. W., Kyme, P., Low, J., Rocha, M. A., Alsabeh, R., Miller, L. G., Otto, M., Arditi, M., Diep, B. A., Nizet, V., Doherty, T. M., Beenhouwer, D. O., Liu, G. Y. Staphylococcus aureus Panton-Valentine leukocidin contributes to inflammation and muscle tissue injury. PLoS One. 4, e6387-e6387 (2009).
- von Kockritz-Blickwede, M., Rohde, M., Oehmcke, S., Miller, L. S., Cheung, A. L., Herwald, H., Foster, S., Medina, E. Immunological mechanisms underlying the genetic predisposition to severe Staphylococcus aureus infection in the mouse model. Am J Pathol. 173, 1657-1668 (2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved