Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Infection sous-cutanée du Staphylococcus aureus résistant à la méthicilline (SARM)
Dans cet article
Résumé
La peau douce et murin modèle d'infection des tissus est utilisé pour évaluer la fonction de virulence de Staphylococcus aureus résistant à la méthicilline (SARM) et les réponses immunologiques hôte. Ici, nous avons présenté un modèle d'infection sous-cutanée de la peau et les infections des tissus mous.
Résumé
Le SARM est une menace mondiale pour la santé publique, et la peau SARM et des tissus mous représentent désormais plus de la moitié de toutes les infections des tissus mous dans les États-Unis. Parmi les infections des tissus mous, la myosite, pyomyosite, et la fasciite nécrosante ont été de plus en plus signalés en association avec le SARM provenant de la communauté. Pour comprendre l'interaction entre le SARM et immunité de l'hôte conduisant à l'infection plus sévère, la disponibilité de modèles animaux est critique, permettant l'étude de l'hôte et facteurs bactériens. Plusieurs modèles d'infection ont été introduites afin d'évaluer la pathogenèse de S. aureus lors d'une infection cutanée superficielle. Ici, nous décrivons un modèle d'infection cutanée qui examine la peau, sous-cutanée, et de pathologies musculaires.
Protocole
1. Préparation de la SDRM de l'infection (deux jours avant l'infection)
- Inoculer une anse de SARM à partir d'une culture d'actions à une gélose au sang (gélose trypticase-soja (TSA)) la plaque.
- Vérifiez le phénotype hémolyse (une zone claire autour de chaque colonie) sur la plaque de gélose au sang.
- Choisissez une colonie qui a un phénotype hémolytique qui est compatible avec d'autres expériences.
- Inoculer la colonie dans 3 ml de bouillon Todd Hewitt (THB), avec l'antibiotique approprié, si nécessaire, dans un composant logiciel enfichable 15 ml tube à bouchon.
- Incuber à 37 ° C pendant une nuit sous agitation à 220 rpm.
2. Préparation de la souris de l'infection (un jour avant l'infection)
- Selon la taille de la souris, se raser la fourrure au large une zone de 3 x 4 cm sur le dos de souris.
- Appliquer ~ 5 mm 3 de crème dépilatoire (acheté dans un magasin local de drogue) pour la zone rasée.
- Laissez la crème dépilatoire à incuber sur la surface de la peau pendant environ 1 min.
- Serviettes de papier humide avec ddH 2 O.
- Essuyez la crème dépilatoire avec la serviette en papier humide.
3. Préparation du SARM d'infection (le jour de l'infection)
- Diluer la culture bactérienne à la nuit de 1:500 à 1:1000 avec 10 ml de pré-chauffé THB, dans un 50 ml à bouchon à vis tube.
- Incuber à 37 ° C pendant environ 2,5 heures avec agitation à 220 rpm, jusqu'à 540 A atteint 2,5.
- Recueillir SARM par centrifugation à 3225 xg pendant 10 min à 4 ° C.
- Jeter le surnageant.
- Reprendre le culot bactérien dans 10 ml de phosphate de Dulbecco saline tamponnée (DPBS).
- Répétez les étapes 3 et 4.
- Reprendre le culot bactérien dans du DPBS à une concentration désirée.
- Série diluer la suspension bactérienne à partir 10 janvier à 10 août.
- Assiette de la suspension diluée bactérienne sur gélose au sang.
- Incuber les plaques à 37 ° C pendant la nuit.
- Observer et enregistrer le phénotype hémolytique de l'inoculum.
- Compter les unités formant colonie (UFC) Numéro de la plaque.
- Calculer les inoculums basé sur le nombre UFC sur la plaque.
4. Infection sous-cutanée de SARM (sur le jour de l'infection et 3 jours post-infection)
- Injecter par voie sous cutanée 100 uL de suspension bactérienne dans la zone rasée.
- Observer les animaux de 3 à 5 heures après l'injection pour s'assurer que les souris sont vivantes.
- Observez la lésion sur le dos de l'animal tous les jours et enregistrer la zone de lésion quotidienne quand elle est nécessaire. L'observation des lésions devrait inclure l'enregistrement de la taille de la lésion et la morphologie. Les deux lésions cutanées et musculaires sont quantifiés en multipliant la longueur et la largeur de la lésion. Lésions de forme irrégulière doivent être décomposés en petits morceaux symétriques, et chaque pièce mesurée par la même méthode. Mesures lésion peut également utiliser un programme assisté par ordinateur évaluation histomorphométrique (ImageJ, open-source disponible à partir du NIH à http://rsb.info.nih.gov/ij/ ) 2.
- Sacrifice des animaux au jour 3 après l'infection par inhalation d'isoflurane suivi par dislocation cervicale.
- Observer et enregistrer la lésion sur la peau.
- Nick la peau avec une paire de ciseaux stériles.
- Peler la peau soigneusement et observer et d'enregistrer la lésion sur le muscle.
- Accise de la lésion et d'environ 2 - 5 mm de la zone environnante.
- Recueillir la rate et les reins.
- Homogénéiser les tissus à l'aide d'un homogénéiseur de tissus ou par l'application répétée d'un piston d'une seringue de 1 mL dans un tube à centrifuger contenant le tissu et 100 uL de DPBS.
- Ajouter 900 uL de DPBS à chaque tube.
- Vortex les échantillons pendant 5 min.
- Série diluer la suspension avec du DPBS janvier 10 à juin 10.
- Assiette des suspensions diluées sur des plaques THA.
5. Les résultats représentatifs:
- Immédiatement après chaque injection sous-cutanée, une cloque sera observée sur la surface de la peau lorsque l'infection est fait correctement (figure 1A). Si aucune bulle est observé sur la surface de la peau, l'injection peut être trop profond, et cela peut affecter le résultat de l'infection (taille de la lésion, UFC).
- La suspension bactérienne doit être dilué en série et l'UFC doivent être examinés sur gélose au sang pour chaque expérience. Cette étape donnera des informations importantes: 1) si l'inoculum ont phénotype homogène; 2) l'exacte comptent viables bactérienne de l'infection.
- Les lésions et la survie bactérienne peut être évaluée à différents temps post-infection. Ici, nous avons examiné l'infection sur trois jours post-infection. La taille des lésions sont analysés sur la surface de la peau (Figure 1B: 1x 10 9; Figure 1D: 1 x 10 7 UFC) et sur la surface du muscle (figure 1C: 1x 10 9 ; figure 1E: 1 x 10 7 UFC). La zone de la lésion est égale à la longueur (mm) x largeur (mm) peuvent être mesurés pour évaluer les dommages aux tissus (fig. 2 A et B). Ce résultat peut aider à déterminer l'étendue des dommages aux tissus causés par un facteur de virulence donné. De plus, les lésions sont excisées et homogénéisé dans DPBS, et plaqué pour quantifier le nombre UFC (figure 2C), qui indique la viabilité des bactéries sur le site de l'infection.
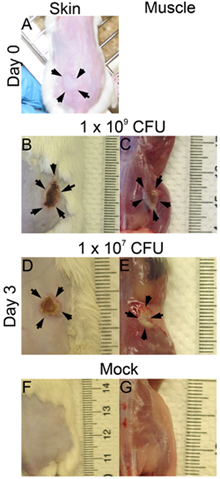
Figure 1. La peau et les lésions musculaires. CD1 souris ont été inoculées sous-cutanée sur un flanc par le SARM (BAC). Les photos ont été prises à 0 heure et le jour 3 après l'infection. (A) 0 Temps de post-infection (pi), (B) - (G) Jour 3 pi; B, D. et F: lésions cutanées, C, E et G: lésions musculaires; B et C: 1x 10 9 UFC infectés; D et E: 1x 10 7 UFC infectés; F et G: maquette.
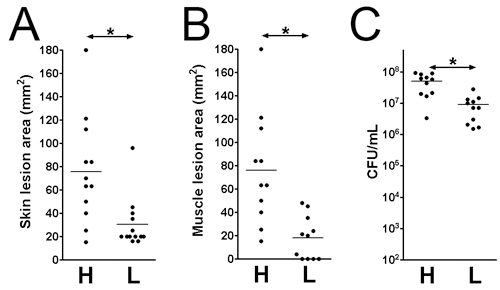
Figure 2. Taille de la lésion de la peau et les bactéries viables comptent sur le site de l'infection sur trois jours post-infection. Lésions cutanées et musculaires sur le SARM (BAC) infectés souris CD1. (A) la taille des lésions cutanées. (B) la taille des lésions musculaires. (C) Total des tissus UFC. H: 1 x 10 9 UFC inoculums; L: 1 x 10 7 UFC inoculums. *: P <0,05, test de Mann-Whitney.
Discussion
- La peau douce et murin modèle d'infection des tissus est un outil puissant pour l'évaluation in vivo de virulence d'un pathogène. La pathogénicité de S. aureus dans les infections cutanées et des tissus mous peuvent varier en fonction d'un certain nombre de paramètres. Il s'agit notamment de taille de l'inoculum, la phase de croissance bactérienne, la profondeur de l'inoculation, l'âge des souris, et le fond génétique de la souris 7, 8. Lorsque l'on examine la ...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par une bourse de carrière Burroughs-Wellcome et par les Instituts nationaux de la santé accorde AI074832 au GY Liu.
matériels
| Name | Company | Catalog Number | Comments |
| THB | VWR international | 95025-314 | |
| DPBS | Invitrogen | 21-031-CV | |
| 1 ml syringe | BD Biosciences | 309602 | |
| 27G1/2 needle | BD Biosciences | 305109 | |
| Sheep Blood Agar (TSA) | VWR international | 90004-328 |
Références
- Ahn, J. Y., Song, J. Y., Yun, Y. S., Jeong, G., Choi, I. S. Protection of Staphylococcus aureus-infected septic mice by suppression of early acute inflammation and enhanced antimicrobial activity by ginsan. FEMS Immunol Med Microbiol. 46, 187-197 (2006).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41, 47-47 (2004).
- Hahn, B. L., Onunkwo, C. C., Watts, C. J., Sohnle, P. G. Systemic dissemination and cutaneous damage in a mouse model of staphylococcal skin infections. Microb Pathog. 47, 16-23 (2009).
- Hruz, P., Zinkernagel, A. S., Jenikova, G., Botwin, G. J., Hugot, J. P., Karin, M., Nizet, V., Eckmann, L. NOD2 contributes to cutaneous defense against Staphylococcus aureus through alpha-toxin-dependent innate immune activation. Proc Natl Acad Sci U S A. 106, 12873-12878 (2009).
- Ji, Y., Zhang, B., Van, S. F., Horn, P. W. a. r. r. e. n., Woodnutt, G., Burnham, M. K., Rosenberg, M. Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science. 293, 2266-2269 (2001).
- Somerville, G. A., Beres, S. B., Fitzgerald, J. R., DeLeo, F. R., Cole, R. L., Hoff, J. S., Musser, J. M. In vitro serial passage of Staphylococcus aureus: changes in physiology, virulence factor production, and agr nucleotide sequence. J Bacteriol. 184, 1430-1437 (2002).
- Tseng, C. W., Kyme, P., Low, J., Rocha, M. A., Alsabeh, R., Miller, L. G., Otto, M., Arditi, M., Diep, B. A., Nizet, V., Doherty, T. M., Beenhouwer, D. O., Liu, G. Y. Staphylococcus aureus Panton-Valentine leukocidin contributes to inflammation and muscle tissue injury. PLoS One. 4, e6387-e6387 (2009).
- von Kockritz-Blickwede, M., Rohde, M., Oehmcke, S., Miller, L. S., Cheung, A. L., Herwald, H., Foster, S., Medina, E. Immunological mechanisms underlying the genetic predisposition to severe Staphylococcus aureus infection in the mouse model. Am J Pathol. 173, 1657-1668 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon