Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подкожный Заражение метициллину Staphylococcus Aureus устойчивы (MRSA)
В этой статье
Резюме
Мышиной кожи и мягких тканей инфекции модель используется для оценки вирулентности функции метициллин устойчивый золотистый стафилококк (MRSA) и иммунологические ответы хоста. Здесь мы представили модель подкожные инфекции кожи и мягких тканей инфекции.
Аннотация
MRSA является глобальной угрозой для общественного здравоохранения, и MRSA кожи и мягких тканей, инфекции в настоящее время приходится более половины всех мягких тканей инфекции в Соединенных Штатах. Среди мягких тканей, инфекции, миозит, пиомиозит и некротизирующий фасциит все чаще сообщили в ассоциации с MRSA, вытекающие из сообщества. Чтобы понять взаимосвязь между MRSA и принимающих иммунитет приводит к более тяжелой инфекции, наличие животных моделях имеет решающее значение, позволяя изучать принимающих и бактериальных факторов. Несколько моделей инфекции были введены для оценки патогенеза С. золотистого при поверхностном инфекции кожи. Здесь мы описываем модель подкожной инфекции, которая рассматривает кожа, подкожная и мышечная патология.
протокол
1. Подготовка для MRSA инфекции (за два дня до инфекции)
- Привить loopful из MRSA из фондовых культуры кровяной агар (Trypticase Соевый Агар (TSA)) пластины.
- Проверьте гемолиз фенотип (ясно зоны вокруг каждой колонии) на пластине кровяной агар.
- Выберите колонии, которая гемолитическая фенотип, что согласуется с другими экспериментами.
- Привить колонии на 3 мл Тодд Хьюитт Отвар (THB), с присвоил антибиотиков при необходимости, в 15 мл оснастки ограничен трубки.
- Инкубировать при 37 ° С в течение ночи при встряхивании при 220 оборотах в минуту.
2. Подготовка Мыши для инфекции (за день до инфекции)
- В зависимости от размера мышей, бритье мех 3 х 4 см, площадь на задней части мыши.
- Применить ~ 5 мм 3 для удаления волос крем (приобретены у местной аптеке), чтобы бритая области.
- Разрешить крем для удаления волос для инкубации на поверхности кожи в течение примерно 1 мин.
- Влажные салфетки с DDH 2 O.
- Вытрите крем для удаления волос с мокрым бумажным полотенцем.
3. Подготовка для MRSA инфекции (в День инфекции)
- Развести ночь бактериальной культуры на 1:500 до 1:1000 с 10 мл подогретого THB, в 50 мл винтовой крышки трубки.
- Инкубировать при 37 ° С в течение примерно 2,5 часов при встряхивании при 220 оборотах в минуту, до 540 достигает 2,5.
- Сбор MRSA путем центрифугирования при 3225 мкг в течение 10 мин при 4 ° C.
- Удалите супернатант.
- Ресуспендируют бактериальных гранул в 10 мл фосфатного Дульбеко буферного раствора (DPBS).
- Повторите шаги 3 и 4.
- Ресуспендируют бактериальный осадок в DPBS в нужной концентрации.
- Серийно разбавить бактериальной суспензии из 10 1 до 10 8.
- Пластина разбавленный бактериальной суспензии на тарелки кровяной агар.
- Инкубируйте пластин при 37 ° С в течение ночи.
- Наблюдать и записывать гемолитическая фенотип инокулята.
- Граф колонии единиц (КОЕ) номер на пластинке.
- Рассчитать инокулята в зависимости от количества КОЕ на пластину.
4. Подкожный Инфекция MRSA (в День инфекции и 3 дня после инфекции)
- Inject подкожно 100 мкл бактериальной суспензии в бритой области.
- Соблюдайте животных от 3 до 5 часов после инъекции, чтобы убедиться, мышей живы.
- Соблюдайте поражения на задней животных ежедневно и записывать поражение области ежедневно, когда это необходимо. Поражение наблюдения должна включать в себя записи поражения размера и морфологии. Оба кожи и мышц поражения количественно путем умножения длины и ширины поражения. Неправильной формы поражения должны быть разбиты на более мелкие симметричные части, и каждый кусок измеряется одним и тем же методом. Поражение измерения могут также использовать компьютерное гистоморфометрического программы оценки (ImageJ; с открытым исходным кодом доступны из NIH на http://rsb.info.nih.gov/ij/ ) 2.
- Жертвы животных на 3-й день после заражения при вдыхании изофлуран следуют шейный дислокации.
- Наблюдать и записывать поражения на коже.
- Ник кожи с парой стерильных ножниц.
- Пил шкуру и тщательно наблюдать и записывать на поражение мышц.
- Акцизный поражения и около 2 - 5 мм на окрестности.
- Сбор селезенку и почки.
- Однородный тканей с использованием ткани гомогенизатора или повторным применением плунжерного от 1 мл шприца микроцентрифужную трубки, содержащей ткани и 100 мкл DPBS.
- Добавить 900 мкл DPBS в каждую пробирку.
- Vortex образцы в течение 5 мин.
- Серийно разбавить подвеска с DPBS 10 1 до 10 6.
- Пластина разбавленной суспензии на ТА пластин.
5. Представитель Результаты:
- Сразу же после каждой инъекции подкожные, пузырь будет наблюдаться на поверхности кожи, если инфекция все сделано правильно (рис. 1А). Если ни один пузырь наблюдается на поверхности кожи, инъекция может быть слишком глубоким, и это может повлиять на исход инфекции (размер повреждения, КОЕ).
- Бактериальной суспензии необходимо последовательно разбавлены и КОЕ должны быть рассмотрены на пластинах кровяной агар для каждого эксперимента. Этот шаг даст важную информацию: 1) является ли инокулята имеют однородную фенотип, 2) точное жизнеспособных бактерий для заражения.
- Повреждений и бактериальных выживания может быть определен в различные моменты времени после заражения. Здесь мы рассмотрели инфекции на 3-й день после заражения. Поражение размеров анализируются на поверхности кожи (рис. 1В: 1x 10 9; Рис. 1D: 1 х 10 7 КОЕ) и на поверхности мышц (рис. 1С: 1x 10 9 ; рис 1E: 1 х 10 7 КОЕ). Поражение площадь равна длина (мм) х ширина (мм) могут быть измерены для оценки повреждения ткани (рис. 2, Б). Этот результат может помочь определить степень повреждения тканей, вызванные данной вирулентности фактор. Кроме того, повреждения вырезали и гомогенизировали в DPBS и покрытием для количественного определения числа КОЕ (рис. 2С), что свидетельствует о жизнеспособности бактерий при инфекции сайта.
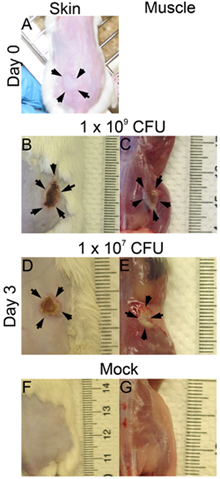
Рисунок 1. Кожи и мышечных повреждений. CD1 мышей заражали подкожной на одном фланге с MRSA (ЛАК). Фотографии были сделаны при 0 время и 3-й день после заражения. () 0 Время после заражения (р), (В) - (G) День 3 пи; В, Д. и F: повреждения кожи, С, Е и G: мышцы поражений; В и С: 1x 10 9 КОЕ инфицированных, D и Е: 1x 10 7 КОЕ инфицированных, F и G: макет.
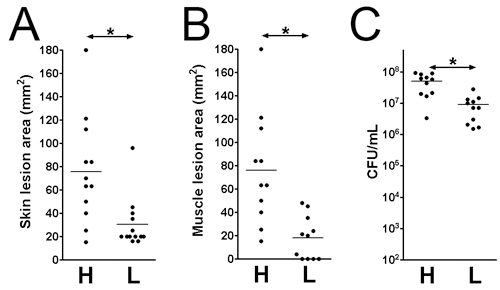
Рисунок 2. Кожа размер повреждения и жизнеспособных бактерий на инфекцию сайт на 3-й день после заражения. Кожи и мышечных повреждений на MRSA (ЛАК) CD1 инфицированных мышах. (А) Размер повреждения кожи. (B) мышц размер повреждения. (C) Всего КОЕ ткани. H: 1 х 10 9 КОЕ инокулята; L: 1 х 10 7 КОЕ инокулята. * Р <0,05, Манна-Уитни.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
- Мышиной кожи и мягких тканей инфекции модель представляет собой мощный инструмент для прижизненного оценки вирулентности возбудителя. Патогенность С. золотистого при инфекции кожи и мягких тканей может варьироваться в зависимости от ряда параметров. К ним относятся размер посевной...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Эта работа была поддержана Burroughs-Wellcome Карьера премии и Национального института здоровья грант AI074832 к GY Лю.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| THB | VWR international | 95025-314 | |
| DPBS | Invitrogen | 21-031-CV | |
| 1 ml syringe | BD Biosciences | 309602 | |
| 27G1/2 needle | BD Biosciences | 305109 | |
| Sheep Blood Agar (TSA) | VWR international | 90004-328 |
Ссылки
- Ahn, J. Y., Song, J. Y., Yun, Y. S., Jeong, G., Choi, I. S. Protection of Staphylococcus aureus-infected septic mice by suppression of early acute inflammation and enhanced antimicrobial activity by ginsan. FEMS Immunol Med Microbiol. 46, 187-197 (2006).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41, 47-47 (2004).
- Hahn, B. L., Onunkwo, C. C., Watts, C. J., Sohnle, P. G. Systemic dissemination and cutaneous damage in a mouse model of staphylococcal skin infections. Microb Pathog. 47, 16-23 (2009).
- Hruz, P., Zinkernagel, A. S., Jenikova, G., Botwin, G. J., Hugot, J. P., Karin, M., Nizet, V., Eckmann, L. NOD2 contributes to cutaneous defense against Staphylococcus aureus through alpha-toxin-dependent innate immune activation. Proc Natl Acad Sci U S A. 106, 12873-12878 (2009).
- Ji, Y., Zhang, B., Van, S. F., Horn, P. W. arren, Woodnutt, G., Burnham, M. K., Rosenberg, M. Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science. 293, 2266-2269 (2001).
- Somerville, G. A., Beres, S. B., Fitzgerald, J. R., DeLeo, F. R., Cole, R. L., Hoff, J. S., Musser, J. M. In vitro serial passage of Staphylococcus aureus: changes in physiology, virulence factor production, and agr nucleotide sequence. J Bacteriol. 184, 1430-1437 (2002).
- Tseng, C. W., Kyme, P., Low, J., Rocha, M. A., Alsabeh, R., Miller, L. G., Otto, M., Arditi, M., Diep, B. A., Nizet, V., Doherty, T. M., Beenhouwer, D. O., Liu, G. Y. Staphylococcus aureus Panton-Valentine leukocidin contributes to inflammation and muscle tissue injury. PLoS One. 4, e6387-e6387 (2009).
- von Kockritz-Blickwede, M., Rohde, M., Oehmcke, S., Miller, L. S., Cheung, A. L., Herwald, H., Foster, S., Medina, E. Immunological mechanisms underlying the genetic predisposition to severe Staphylococcus aureus infection in the mouse model. Am J Pathol. 173, 1657-1668 (2008).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены