Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Subkutane Infektion von Methicillin-resistenten Staphylococcus Aureus (MRSA)
In diesem Artikel
Zusammenfassung
Murine Haut-und Weichteilinfektionen Infektionen Modell ist für die Beurteilung der Virulenz Funktion von Methicillin-resistenten Staphylococcus aureus (MRSA) und dem Host-Immunreaktionen eingesetzt. Hier präsentierten wir eine subkutane Infektion Modell für Haut-und Weichteilinfektionen.
Zusammenfassung
MRSA ist eine weltweite Bedrohung für die öffentliche Gesundheit und MRSA Haut-und Weichteil-Infektionen mittlerweile mehr als die Hälfte aller Weichteil-Infektionen in den Vereinigten Staaten. Unter Weichteilinfektionen, haben Myositis, pyomyositis und nekrotisierende Fasziitis zunehmend in Verbindung mit MRSA aus der Gemeinde berichtet. Um zu verstehen, das Wechselspiel zwischen MRSA-und Host-Immunität führt zu schweren Infektion ist die Verfügbarkeit von Tiermodellen kritisch, erlaubt die Untersuchung von Host-und bakterielle Faktoren. Mehrere Infektion Modelle wurden eingeführt, um die Pathogenese von S. bewerten aureus während oberflächliche Infektion der Haut. Hier beschreiben wir eine subkutane Infektion Modell, das die Haut, Unterhaut und Muskulatur Pathologien untersucht.
Protokoll
1. Vorbereiten des MRSA für Infektionsforschung (zwei Tage vor der Infektion)
- Impfen einer Öse MRSA aus einer Stammkultur eine Blut-Agar (Trypticase Soy Agar (TSA)) Platte.
- Überprüfen Sie die Hämolyse Phänotyp (eine klare Zone um jede Kolonie) auf das Blut-Agar-Platte.
- Wählen Sie eine Kolonie, die eine hämolytische Phänotyp, die im Einklang mit anderen Experimenten wurde.
- Impfen der Kolonie in 3 ml Todd Hewitt Broth (THB), mit dem angeeigneten Antibiotikum, wenn nötig, in einer 15 ml-Snap-Röhrchen.
- Bei 37 ° C über Nacht unter Schütteln bei 220 Umdrehungen pro Minute.
2. Vorbereitung der Mäuse für Infektionsforschung (einen Tag vor der Infektion)
- Je nach Größe der Mäuse, rasieren das Fell ab einer 3 x 4 cm-Bereich auf der Rückseite von Mäusen.
- Bewerben ~ 5 mm 3 Haarentferner Creme (gekauft von einer örtlichen Drogerie) auf die rasierte Fläche.
- Lassen Sie die Haarentfernung Creme auf der Haut für ca. 1 min inkubieren.
- Wet Papierhandtücher mit ddH 2 O.
- Wischen Sie die Haarentfernung Creme mit dem nassen Papiertuch.
3. Vorbereiten des MRSA für Infektionsforschung (am Tag der Infektion)
- Verdünnen Sie die Nacht Bakterienkultur bei 1:500 bis 1:1000 mit 10 ml vorgewärmten THB, in einem 50 mL Röhrchen mit Schraubverschluss.
- Bei 37 ° C für ca. 2,5 Stunden unter Schütteln bei 220 rpm, bis A 540 erreicht 2,5.
- Sammeln MRSA durch Zentrifugation bei 3.225 xg für 10 min bei 4 ° C.
- Überstand verwerfen.
- Resuspendieren Sie das Bakterienpellet in 10 ml Dulbecco phosphatgepufferte Kochsalzlösung (DPBS).
- Wiederholen Sie die Schritte 3 und 4.
- Resuspendieren Sie das Bakterienpellet in DPBS auf eine gewünschte Konzentration.
- Serienmäßig verdünnen Bakteriensuspension von Januar 10 - August 10.
- Platte der verdünnten Bakteriensuspension auf Blut-Agar-Platten.
- Die Inkubation bei 37 ° C über Nacht.
- Beobachtung und Aufzeichnung der hämolytischen Phänotyp der Inokula.
- Zählen Sie die Kolonie bildenden Einheiten (KBE) Nummer auf der Platte.
- Berechnen Sie die Inokula auf die CFU-Nummer auf der Platte basiert.
4. Subkutane Infektion von MRSA (am Tag der Infektion und 3 Tage nach der Infektion)
- Inject subkutan 100 ul Bakteriensuspension in die rasierte Fläche.
- Beobachten Sie die Tiere für 3 bis 5 Stunden nach der Injektion sicherstellen, dass die Mäuse am Leben sind.
- Beachten Sie die Läsion auf dem Rücken der Tiere täglich und notieren Sie die Läsion Bereich täglich, wenn es gebraucht wird. Läsion Beobachtung sollte die Aufnahme der Läsion Größe und Morphologie. Beide Haut und Muskel Läsionen sind durch Multiplikation der Länge und Breite der Läsion quantifiziert. Unregelmäßig geformte Läsionen müssen in kleinere symmetrische Stücke zerbrochen werden, und jedes Stück mit dem gleichen Verfahren gemessen. Läsion Messungen können auch eine EDV-gestützte histomorphometrische Assessment Program (ImageJ, Open-Source zur Verfügung von der NIH in http://rsb.info.nih.gov/ij/ ) 2.
- Sacrifice die Tiere am Tag 3 nach der Infektion durch Inhalation von Isofluran durch Genickbruch folgte.
- Beobachtung und Aufzeichnung der Läsion auf der Haut.
- Nick die Haut mit einem Paar sterile Schere.
- Ziehen Sie die Haut vorsichtig ab und beobachten und aufzeichnen der Läsion auf den Muskel.
- Excise der Läsion und ca. 2 bis 5 mm von der Umgebung.
- Sammeln Milz und Nieren.
- Homogenisieren des Gewebes mit einem Gewebe-Homogenisator oder durch wiederholte Anwendung eines Kolbens aus einer 1 ml-Spritze ein Mikrozentrifugenröhrchen mit dem Gewebe und 100 ul DPBS.
- Add 900 ul DPBS in jedes Röhrchen.
- Vortex die Proben für 5 min.
- Serienmäßig verdünnt die Suspension mit DPBS 1 Oktober - 6. Oktober.
- Platte der verdünnten Suspensionen auf THA-Platten.
5. Repräsentative Ergebnisse:
- Unmittelbar nach jeder subkutane Injektion wird eine Blase an der Hautoberfläche beobachtet werden, wenn die Infektion richtig eingestellt ist (Abbildung 1A) durchgeführt. Wenn keine Bläschen auf der Haut beobachtet wird, kann die Injektion zu tief sein, und dies kann das Ergebnis der Infektion (Größe der Läsion, CFU) zu beeinflussen.
- Die Bakteriensuspension muss seriell verdünnt und die CFU müssen auf Blutagarplatten für jedes Experiment untersucht werden. Dieser Schritt wird liefern wichtige Informationen: 1) ob die Inokula homogenen Phänotyp haben, 2) die exakte praktikable Keimzahl für die Infektion.
- Die Läsionen und bakteriellen Überleben kann zu verschiedenen Zeitpunkten nach der Infektion beurteilt werden. Hier haben wir die Infektion an Tag 3 nach der Infektion. Die Läsion Größen sind auf der Hautoberfläche (: 1x 10 9; Abbildung 1D: 1B 1 x 10 7 CFU) analysiert und auf den Muskel (Abbildung 1C: 1x 10 9 ; Abbildung 1E: 1 x 10 7 CFU). Die Läsion Bereich gleicher Länge (mm) x Breite (mm) kann für die Beurteilung der Gewebeschädigung (Abb. 2 A und B) gemessen werden. Dieses Ergebnis könnte helfen, bestimmen das Ausmaß der Gewebeschädigung durch einen bestimmten Virulenzfaktor verursacht. Darüber hinaus sind die Läsionen exzidiert und homogenisiert in DPBS und beschichtet, um die CFU-Nummer (Abbildung 2C), welche die Lebensfähigkeit der Bakterien am Ort der Infektion zeigt quantifizieren.
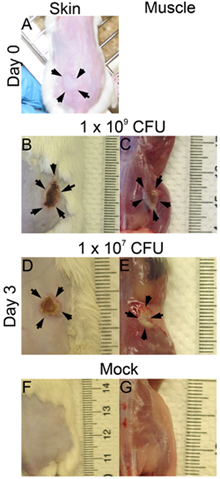
Abbildung 1. Die Haut und Muskel Läsionen. CD1 Mäusen wurden subkutan an einer Flanke mit MRSA (LAC) geimpft. Die Bilder wurden zum Zeitpunkt 0 und Tag 3 nach der Infektion aufgenommen. (A) Zeit 0 nach der Infektion (pi), (B) - (G) Tag 3 pi; B, D. und F: Hautläsionen; C, E und G: Muskel-Läsionen; B und C: 1x 10 9 CFU infiziert, D und E: 1x 10 7 CFU infiziert, F und G: Mock.
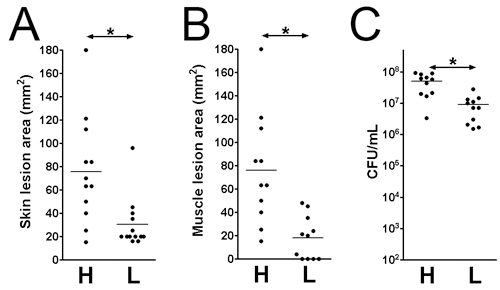
Abbildung 2. Hautläsion Größe und lebensfähigen Bakterien am Ort der Infektion zählen am Tag 3 nach der Infektion. Haut-und Muskel-Verletzungen auf MRSA (LAC) infiziert CD1-Mäusen. (A) Hautläsion Größe. (B) Muscle Läsionsgröße. (C) Total Gewebe CFU. H: 1 x 10 9 KBE Inokula; L: 1 x 10 7 CFU Inokula. *: P <0,05, Mann-Whitney-Test.
Access restricted. Please log in or start a trial to view this content.
Diskussion
- Die murine Haut-und Weichteilinfektionen Infektionen Modell ist ein leistungsfähiges Werkzeug für die in vivo Virulenz Beurteilung eines Erregers. Die Pathogenität von S. aureus in Haut-und Weichteilinfektionen kann je nach einer Reihe von Parametern. Dazu gehören Inokulum Größe, das Wachstum von Bakterien Phase, Tiefe der Impfung, Alter der Mäuse, und die Maus genetischen Hintergrund 7, 8. Bei der Prüfung der Virulenz-Funktion mit diesem Modell ist es wichtig, für diese Parameter werden, um sicher...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Diese Arbeit wurde durch ein Burroughs-Wellcome Career Award und von den National Institutes of Health gewähren AI074832 zu GY Liu unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| THB | VWR international | 95025-314 | |
| DPBS | Invitrogen | 21-031-CV | |
| 1 ml syringe | BD Biosciences | 309602 | |
| 27G1/2 needle | BD Biosciences | 305109 | |
| Sheep Blood Agar (TSA) | VWR international | 90004-328 |
Referenzen
- Ahn, J. Y., Song, J. Y., Yun, Y. S., Jeong, G., Choi, I. S. Protection of Staphylococcus aureus-infected septic mice by suppression of early acute inflammation and enhanced antimicrobial activity by ginsan. FEMS Immunol Med Microbiol. 46, 187-197 (2006).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41, 47-47 (2004).
- Hahn, B. L., Onunkwo, C. C., Watts, C. J., Sohnle, P. G. Systemic dissemination and cutaneous damage in a mouse model of staphylococcal skin infections. Microb Pathog. 47, 16-23 (2009).
- Hruz, P., Zinkernagel, A. S., Jenikova, G., Botwin, G. J., Hugot, J. P., Karin, M., Nizet, V., Eckmann, L. NOD2 contributes to cutaneous defense against Staphylococcus aureus through alpha-toxin-dependent innate immune activation. Proc Natl Acad Sci U S A. 106, 12873-12878 (2009).
- Ji, Y., Zhang, B., Van, S. F., Horn, P. W. arren, Woodnutt, G., Burnham, M. K., Rosenberg, M. Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science. 293, 2266-2269 (2001).
- Somerville, G. A., Beres, S. B., Fitzgerald, J. R., DeLeo, F. R., Cole, R. L., Hoff, J. S., Musser, J. M. In vitro serial passage of Staphylococcus aureus: changes in physiology, virulence factor production, and agr nucleotide sequence. J Bacteriol. 184, 1430-1437 (2002).
- Tseng, C. W., Kyme, P., Low, J., Rocha, M. A., Alsabeh, R., Miller, L. G., Otto, M., Arditi, M., Diep, B. A., Nizet, V., Doherty, T. M., Beenhouwer, D. O., Liu, G. Y. Staphylococcus aureus Panton-Valentine leukocidin contributes to inflammation and muscle tissue injury. PLoS One. 4, e6387-e6387 (2009).
- von Kockritz-Blickwede, M., Rohde, M., Oehmcke, S., Miller, L. S., Cheung, A. L., Herwald, H., Foster, S., Medina, E. Immunological mechanisms underlying the genetic predisposition to severe Staphylococcus aureus infection in the mouse model. Am J Pathol. 173, 1657-1668 (2008).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten