Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Subkutan Enfeksiyon Metisiline Dirençli Stafilokok Aureus (MRSA)
Bu Makalede
Özet
Murin deri ve yumuşak doku enfeksiyonu modeli metisiline dirençli Staphylococcus aureus (MRSA) ve ev sahibi immünolojik yanıtlar virülans fonksiyonu değerlendirmek için kullanılmaktadır. Burada, biz, deri ve yumuşak doku enfeksiyonu için bir deri altı enfeksiyon modeli sundu.
Özet
MRSA, halk sağlığı için dünya çapında bir bir tehdit ve MRSA deri ve yumuşak doku enfeksiyonları, şimdi Amerika Birleşik Devletleri'nde tüm yumuşak doku enfeksiyonları yarısından fazlasının hesabı. Yumuşak doku enfeksiyonları arasında, miyozit, pyomyositis ve nekrotizan fasiit giderek MRSA toplum kaynaklanan ilişkili olarak rapor edilmiştir. MRSA ve daha şiddetli enfeksiyonlara yol açan ev sahibi bağışıklık arasındaki etkileşimi anlamak için, host ve bakteriyel faktörler çalışma izin, hayvan modellerinde durumu kritik öneme sahiptir. S. patogenezinde değerlendirmek için birçok enfeksiyon modelleri tanıtıldı yüzeyel cilt enfeksiyonu sırasında aureus. Burada, deri, derialtı ve kas patolojileri inceleyen bir subkutan enfeksiyon modeli açıklanmaktadır.
Protokol
1. Enfeksiyon MRSA (Enfeksiyon önce iki Gün) Hazırlama
- Bir hisse senedi kültürünün bir kan agar (Triptikaz Soya Agar (TSA)) plaka MRSA loopful İnokülasyon.
- Kanlı agar plaka üzerinde hemoliz fenotip (her koloni etrafında açık bir bölge) kontrol edin.
- Diğer deneylerin tutarlı bir hemolitik fenotip bir koloni seçin.
- 15 ml snap-kapaklı tüp, tahsis antibiyotik gerektiğinde, 3 ml Todd Hewitt Broth (THB) koloni İnokülasyon.
- 37 ° ° C'de 220 rpm'de sallayarak ile geceleme.
2. Enfeksiyon Fare hazırlanması (Hastalığın bir Gün önce)
- Farelerin büyüklüğüne bağlı olarak, 3 x 4 cm alan farelerin arka kapalı kürk tıraş.
- ~ 5 mm 3 tüy dökücü krem (yerel bir uyuşturucu deposu satın) traş bölgeye uygulayın.
- Tüy dökücü krem, cilt yüzeyinde yaklaşık 1 dakika inkübe izin verin.
- GKD 2 O ıslak kağıt havlu
- Tüy dökücü krem, ıslak kağıt havlu ile silin.
3. (Day Enfeksiyon) Enfeksiyon MRSA hazırlanması
- 50 ml vidalı kapaklı tüp içinde, önceden ısıtılmış THB 10 ml 1:500 1:1000 için gecelik bakteri kültürü sulandırınız.
- 37 ° C yaklaşık 2,5 saat için bir 540 2.5 ulaşıncaya kadar, 220 rpm'de titreme ile inkübe.
- 4, 10 dakika süreyle 3225 xg'de santrifüj yoluyla MRSA toplayın ° C
- Süpernatantı atın.
- Bakteriyel pelletini tekrar 10 ml Dulbecco'nun fosfat tamponlu salin (DPBS).
- 3. ve 4. adımları tekrarlayın.
- DPBS içinde istenilen konsantrasyonda bakteri pelletini tekrar.
- 8 Ekim - 1 Ekim seri bakteriyel süspansiyon sulandırmak.
- Plaka kanlı agar plakaları üzerine seyreltilmiş bakteriyel süspansiyon.
- ° C gecede 37 plakalar inkübe edin.
- Gözlemleyin ve inocula hemolitik fenotip kayıt.
- Plaka üzerinde Birimleri oluşturulması Colony (CFU) sayısını saymak.
- Inocula plaka CFU sayısına göre hesaplayın.
4. Subkutan Enfeksiyon MRSA (Day Enfeksiyon ve enfeksiyon sonrası 3 Gün)
- Traş alanda subkutan 100 mcL bakteriyel süspansiyon enjekte edilir.
- Farelerin hayatta emin olmak için enjeksiyon sonrası 3 ila 5 saat hayvanları gözlemleyin.
- Günlük hayvanların geri lezyon gözlemleyin ve gerektiğinde günlük lezyon alanı kaydı. Lezyon gözlem, lezyon büyüklüğü ve morfolojisi kayıt içermelidir. Her iki kas ve deri lezyonlarının lezyonun uzunluğu ve genişliği çarpılarak quantitated. Düzensiz şekilli lezyonlar, daha küçük simetrik parçalar halinde parçalanır ve her bir parçanın aynı yöntemi ile ölçülür olması gerekir. Lezyon ölçümler bilgisayar destekli histomorfometrik değerlendirme programı (NIH kullanılabilir açık kaynak ImageJ kullanabilirsiniz http://rsb.info.nih.gov/ij/ 2).
- Servikal dislokasyon izofluran inhalasyonu gün 3 sonrası enfeksiyon hayvanların Kurban.
- Gözlemleyin ve cilt üzerinde lezyon kayıt.
- Steril makas bir çift Nick cilt.
- Cildin soyulmasına dikkatli ve gözlemlemek ve kas lezyon kaydetmek.
- Vergi lezyon ve yaklaşık 2 - 5 mm çevresi.
- Dalak ve böbrekler toplayın.
- Bir doku Homojenizatör kullanarak dokular homojenize veya doku ve DPBS 100 mcL içeren bir mikrofuge'de tüpüne 1 ml şırınga pistonu tekrarlanan uygulama tarafından.
- Her bir tüp DPBS 900 mcL ekleyin.
- 5 dakika boyunca vorteksleyin örnekleri.
- Seri DPBS 10 1 10 6 süspansiyon sulandırmak.
- Plaka TKP plakalar üzerinde seyreltilmiş süspansiyonlar.
5. Temsilcisi Sonuçlar:
- Hemen her subkutan enjeksiyondan sonra, bir bleb enfeksiyonu (Şekil 1A) doğru bir şekilde yapılırsa, deri yüzeyinde görülen olacaktır. Bleb deri yüzeyinde görülürse, enjeksiyon çok derin olabilir ve bu enfeksiyon (lezyon boyutu, CFU) sonucu etkileyebilir.
- Bakteriyel süspansiyon seri seyreltilerek gereken ve CFU her bir deney için kan agar plaklarına incelenmesi gerekir. 1) inocula homojen fenotip olup olmadığını; 2) enfeksiyon için tam bir canlı bakteri sayısı: Bu adım önemli bilgiler verecektir.
- Lezyonlar ve bakteriyel hayatta kalma, çeşitli zaman noktalarında sonrası enfeksiyon değerlendirilebilir. Burada, 3. gün sonrası enfeksiyon, enfeksiyon inceledi. Lezyon boyutları cilt yüzeyi (: 1x 10 9 Şekil 1D: Şekil 1B 1 x 10 7 CFU) analiz edilir ve kas yüzeyi (Şekil 1C: 1x 10 9 Şekil 1E: 1 x 10 7 CFU). Lezyon alanı (mm) x genişliği (mm) (Şekil 2 A ve B) doku hasarı değerlendirmek için ölçülen olabilir süresini eşittir. Bu sonuç, belirli bir virülans faktörü doku hasarı ölçüde belirlemenize yardımcı olabilir. Ayrıca, lezyonlar eksize ve DPBS homojenize ve enfeksiyon yerinde bakterilerin canlılığını gösterir CFU numarası (Şekil 2C), ölçmek için kaplama.
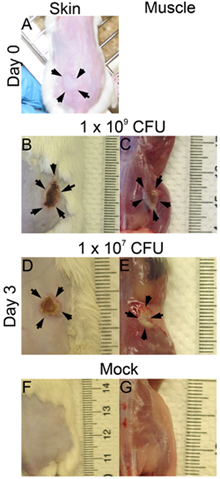
Şekil 1. Cilt ve kas lezyonları CD1 fareler MRSA (LAC) ile bir kanadında subkutan ekildi. Resimleri zaman 0 ve 3. gün sonrası enfeksiyon alınmıştır. (A) Zaman 0 sonrası enfeksiyon (pi), (B) - (G) 3. Gün pi; B, D ve F: deri lezyonları, C, E ve G: kas lezyonları, B ve C: 1x 10 9 CFU bulaşmış, D ve E: 1x 10 7 CFU enfekte; F ve G: alay.
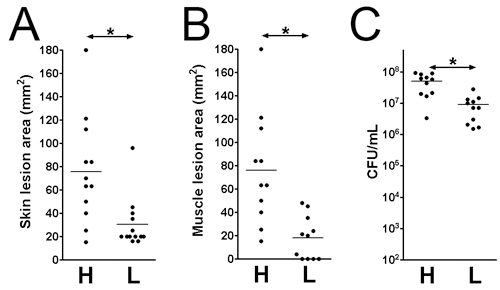
Şekil 2. Cilt lezyon büyüklüğü ve canlı bakteri CD1 fareleri enfekte MRSA (LAC) 3. gün sonrası enfeksiyon Deri ve kas lezyonları enfeksiyon yerinde saymak. (A) Cilt lezyon büyüklüğü. (B) Kas lezyon boyutu. (C) Toplam doku CFU. H: 1 x 10 9 CFU inocula L: 1 x 10 7 CFU inocula. *: P <0.05, Mann-Whitney testi.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
- Fare deri ve yumuşak doku enfeksiyonu modeli bir patojenin in vivo virülans değerlendirmesi için güçlü bir araçtır. S. patojenite aureus, deri ve yumuşak doku enfeksiyonu, bir takım parametreler bağlı olarak değişebilir . Bunlar inokulum büyüklüğü, bakteriyel büyüme aşamasında, aşılama derinliği, fareler yaş, ve farenin genetik arka plan 7, 8. Bu model kullanılarak virülans işlevini incelerken, sonuçları tutarlı olacağını sağlamak için bu parametreler...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Teşekkürler
Bu çalışma, Burroughs-Wellcome Kariyer Ödülü ve GY Liu Sağlık hibe AI074832 Ulusal Sağlık Enstitüleri tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| THB | VWR international | 95025-314 | |
| DPBS | Invitrogen | 21-031-CV | |
| 1 ml syringe | BD Biosciences | 309602 | |
| 27G1/2 needle | BD Biosciences | 305109 | |
| Sheep Blood Agar (TSA) | VWR international | 90004-328 |
Referanslar
- Ahn, J. Y., Song, J. Y., Yun, Y. S., Jeong, G., Choi, I. S. Protection of Staphylococcus aureus-infected septic mice by suppression of early acute inflammation and enhanced antimicrobial activity by ginsan. FEMS Immunol Med Microbiol. 46, 187-197 (2006).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41, 47-47 (2004).
- Hahn, B. L., Onunkwo, C. C., Watts, C. J., Sohnle, P. G. Systemic dissemination and cutaneous damage in a mouse model of staphylococcal skin infections. Microb Pathog. 47, 16-23 (2009).
- Hruz, P., Zinkernagel, A. S., Jenikova, G., Botwin, G. J., Hugot, J. P., Karin, M., Nizet, V., Eckmann, L. NOD2 contributes to cutaneous defense against Staphylococcus aureus through alpha-toxin-dependent innate immune activation. Proc Natl Acad Sci U S A. 106, 12873-12878 (2009).
- Ji, Y., Zhang, B., Van, S. F., Horn, P. W. arren, Woodnutt, G., Burnham, M. K., Rosenberg, M. Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science. 293, 2266-2269 (2001).
- Somerville, G. A., Beres, S. B., Fitzgerald, J. R., DeLeo, F. R., Cole, R. L., Hoff, J. S., Musser, J. M. In vitro serial passage of Staphylococcus aureus: changes in physiology, virulence factor production, and agr nucleotide sequence. J Bacteriol. 184, 1430-1437 (2002).
- Tseng, C. W., Kyme, P., Low, J., Rocha, M. A., Alsabeh, R., Miller, L. G., Otto, M., Arditi, M., Diep, B. A., Nizet, V., Doherty, T. M., Beenhouwer, D. O., Liu, G. Y. Staphylococcus aureus Panton-Valentine leukocidin contributes to inflammation and muscle tissue injury. PLoS One. 4, e6387-e6387 (2009).
- von Kockritz-Blickwede, M., Rohde, M., Oehmcke, S., Miller, L. S., Cheung, A. L., Herwald, H., Foster, S., Medina, E. Immunological mechanisms underlying the genetic predisposition to severe Staphylococcus aureus infection in the mouse model. Am J Pathol. 173, 1657-1668 (2008).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır