A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Bromodeoxyuridine (BrdU) التوسيم والفرز وبعد الإسفار خلية المنشط للتحديد ، ثقافة مستقلة عن العضوية الذائبة الكربون المهينة العوالق البكتيرية
* These authors contributed equally
In This Article
Summary
يتم تحضين العوالق البكتيرية البيئية مع نموذج حل الكربون العضوي (DOC) المركب ووضع العلامات كاشف الحمض النووي ، bromodeoxyuridine (BrdU). بعد ذلك ، يتم فصل الخلايا DOC - المهينة الجزء الأكبر من المجتمع على أساس إدماجها BrdU مرتفعة باستخدام الفرز مضان تنشيط الخلايا (FACS). ثم يتم تحديد هذه الخلايا الجزيئية تحليلات لاحقة.
Abstract
الميكروبات وكلاء كبرى تتوسط في تدهور العديد من الكربون العضوي المذاب (DOC) ركائز في البيئات المائية. ومع ذلك ، وتحديد الأنواع البكتيرية التي تحول تجمعات محددة من DOC في الطبيعة يشكل تحديا تقنيا.
نحن هنا وصف نهج الأزواج bromodeoxyuridine (BrdU) التأسيس ومضان تنشيط الخلايا الفرز (FACS) ، و16S الرنا الريباسي الجينات الجزيئية التحليل القائم على الثقافة التي تسمح بتحديد مستقلة قادرة على العوالق البكتيرية المهينة مجمع DOC محددة في البيئات المائية. يتم تعيين عوالم مصغرة العوالق البكتيرية ثلاث نسخ لتلقي كل من BrdU ومجمع DOC طراز (DOC التعديلات) ، أو BrdU فقط (عدم التحكم بالإضافة إلى ذلك). بدائل يمكن BrdU مواقف ثيميدين في الحمض النووي البكتيري توليفها BrdU حديثا والتي تحمل علامات الحمض النووي يمكن 1،2 immunodetected بسهولة. العوالق البكتيرية من خلال 24 ساعة ، حضانة التي تكون قادرة على استخدام ويتوقع المجمع DOC أضاف تفعيلها بشكل انتقائي ، وبالتالي ارتفاع مستويات التأسيس BrdU (خلايا مرحبا) من غير استجابة الخلايا في التعديلات DOC والخلايا في عدم بالإضافة إلى ذلك الضوابط (انخفاض خلايا BrdU التأسيس ، وخلايا LI). بعد مضان مناعي ، وتتميز الخلايا مرحبا وفصلها ماديا من الخلايا التي LI مضان تنشيط الخلايا الفرز (FACS) 3. يتم استخراج فرز DOC التي تستجيب الخلايا (خلايا مرحبا) لتحديد الحمض النووي وتصنيفيا عن طريق الجينات 16S الرنا الريباسي اللاحقة المستندة إلى تحليلات بما PCR ، استنساخ بناء مكتبة والتسلسل.
Protocol
1. عينة المياه المعالجة
- تصفية المياه البيئية من خلال 10L المرشحات الغشائية 1 ميكرون ، مسام الحجم لإزالة الجزيئات الكبيرة وbacteriovores. جمع الماء الراشح في الدامجانة زجاجة كبيرة.
- نقل 36 مل كل رشاحة إلى 3 أنابيب إيبندورف العقيمة (50 مل) 4 مل تحتوي على حل أعدت حديثا بارافورمالدهيد (منهاج العمل ، و 10 ٪). احتضان لمدة 2 ساعة في درجة حرارة الغرفة للحفاظ على الخلايا. جمع الخلايا على 0.22 ميكرون - - مسام الحجم المرشحات الغشائية الأبيض عن طريق الترشيح فراغ. غسل تصفية بتمرير 10 مل الفوسفات مخزنة المالحة (PBS) من خلال تصفية عن طريق الترشيح فراغ. تسمية المرشحات والضوابط السلبية وتخزينها في -20 درجة مئوية.
الخطوات هي 1،3-1،4 اختياري لإقامة DOC محدودة شروطه.
- إضافة مزيج من النيتروجين والفوسفور غير العضوي (5 ميكرومتر NH 4 CL ، 5 ميكرومتر NANO 3 ، وناه 1μM 2 ص 4 التركيز النهائي) في الدامجانة زجاجة كبيرة.
- احتضان في الظلام في درجات الحرارة في الموقع لمدة 48 ساعة مع الثورات في بعض الأحيان.
2. إنشاء مصغرة والحضانة
- ملء كل ستة قوارير الزجاج 1 - L مع 800 مل من عينة المياه الدامجانة زجاجة كبيرة من الخطوة 1.4 لإنشاء عوالم مصغرة. إضافة BrdU (10 ميكرومتر ، وتركيز النهائي) إلى كل صورة مصغرة. مزيج جيد.
- إضافة 1 مل مجمع DOC الحل النموذجي في ثلاثة من عوالم مصغرة ، فإن هذه التعديلات بمثابة DOC. إضافة 1 مل العقيمة PBS في عوالم مصغرة الثلاث المتبقية ، وهذه بمثابة عدم إضافة عناصر التحكم.
- احتضان جميع عوالم مصغرة في الحاضنة واحتضان شاكر في الظلام في درجات الحرارة في الموقع بينما تهتز عند 100 دورة في الدقيقة.
- جمع 36 مل من عينة المياه من كل مصغرا ونقل إلى 50 مل إيبندورف أنابيب معقمة في نقاط وقت 0 ، 8 ، 16 ، و 24 ساعة. إضافة على الفور 4 مل من PFA الطازجة (10 ٪) لأنابيب جمع واحتضان لمدة 2 ساعة في درجة حرارة الغرفة للحفاظ على الخلايا.
- تصفية الخلايا من خلال الحفاظ على 0.22 ميكرون - - مسام الحجم المرشحات الغشائية البولي. غسيل المرشحات مع 10 مل من برنامج تلفزيوني. الشروع فورا في الخطوة التالية أو تخزنه في مرشحات -20 درجة مئوية.
3. مناعي في الوضع الطبيعي لتأسيس BrdU
- ذوبان الفلاتر (عينات DOC المعدلة ، بالإضافة إلى عدم التحكم والرقابة السلبية) في درجة حرارة الغرفة.
- تطبيق 1 مل من محلول الليزوزيم [10 ملغ / مل الليزوزيم البيض في تريس 100 ملم ، و 50 نانومتر EDTA (الرقم الهيدروجيني = 8)] (4) لتغطية الخلايا البكتيرية على التصفية. يحضن في درجة حرارة الغرفة لمدة 30 دقيقة. غسل تصفية بتمرير 10 مل من خلال برنامج تلفزيوني تحت الشفط.
- إضافة 1 مل من محلول K بروتين [2 ملغ / مل بروتين كاف في تريس 100 ملم ، و 50 نانومتر EDTA (الرقم الهيدروجيني = 8)] (4) لتغطية الخلايا البكتيرية على التصفية. يحضن في درجة حرارة الغرفة لمدة 30 دقيقة. غسل تصفية بتمرير 10 مل من خلال برنامج تلفزيوني تحت الشفط.
- إضافة 1 مل من محلول نوكلياز خارجية [III نوكلياز خارجية (50 يو / مل) في 5 ملم MgCl 2 و 50 ملي تريس ، حمض الهيدروكلوريك] (5) لتغطية الخلايا البكتيرية على التصفية. احتضان في 37 لمدة 30 دقائق درجة مئوية. غسل تصفية بتمرير 10 مل من خلال برنامج تلفزيوني تحت الشفط.
- تجميع غرف حضانة الإطار الختم (بيو راد) وفقا لتعليمات الشركة الصانعة.
- شريحة فلتر في أثمان باستخدام شفرة معقمة على سطح الكحول تنظيف الجاف.
- باستخدام ملقط ، ضع مقطع الثامنة ومرشح تجميعها في واحدة غرفة الحضانة الإطار الختم (والى ثماني الإطار ختم الغرف لكل عينة التصفية). وينبغي على جانب الباب التصفية التي تحتوي على خلايا الوجه لأعلى. والرطوبة في الجزء الخلفي من تصفية تصفية تسمح العصا إلى الشريحة. إذا تصفية يصبح جافا ، وتطبيق قطرة صغيرة (2 ميكرولتر) من DIH 2 O في وسط الغرفة قبل وضع المقطع تصفية على الشريحة.
خطوات 3،8-3،20 استخدام الكواشف من اروش في الموقع خلية كيت انتشار الأسلحة النووية ، وفقا للإجراءات FLUOS معدلة من إرشادات الشركة المصنعة. باستثناء برنامج تلفزيوني ، وتزويد جميع الكواشف داخل المجموعة.
- ينطبق ما يكفي العازلة الحضانة (0.5 ٪ الأبقار مصل الزلال ، 0.1 ٪ Tween20 في برنامج تلفزيوني ،) لتغطية كامل بالتساوي المقطع تصفية في غرفة الحضانة دون أن تسبب فيضان مرة يتم تطبيق الختم.
- وضع غطاء الإطار البوليستر على حضانة إطار الغرفة. اضغط لأسفل لاغلاق محكم للغرفة الحضانة. تجنب فقاعات الهواء فوق تصفية. احتضان غرف مغلقة لمدة 10 دقيقة في درجة حرارة الغرفة في الظلام.
- إزالة الختم البوليستر وفتح غرف الحضانة. (ملاحظة : فتح غرف ستسحب أحيانا ختم الإطار من الانزلاق في هذه الحالة ، وإعداد غرفة جديدة للخطوات التالية.)
- الماصة العازلة خارج الحضانة من إحدى زوايا الغرفة. تجنب الاتصال مع مرشح.
- غسل تصفية حسب pipetting بلطف 100 ميكرولتر في برنامج تلفزيوني والخروج من الغرفة 3 مرات.
- تعد مكافحة BrdU - FLUOS الحل العمل باتباع الخطوات الموصى بها من قبل الشركة المصنعة مباشرة قبل الاستعمال.
- الماصة 120 ميكرولتر مكافحة BrdU - FLUOS العمل على حل المرشح ، مع الحرص على تغطية كامل السطح بشكل متساو.
- ختم الغرفة مع غطاء البوليستر جديدة. تجنب فقاعات الهواء على رأس المرشح. احتضان الغرفة في الظلام في 37 لمدة 3 ساعات درجة مئوية. وهذه الخطوة التسمية BrdU دمج الحمض النووي في الموقع مع ثيوسيانات فلوريسئين (FITC).
- إزالة الغطاء البوليستر وفتح غرفة الحضانة. الماصة من الحل لمكافحة BrdU - FLUOS العمل. غسل تصفية 3 مرات مع برنامج تلفزيوني.
- نقل تصفية من غرفة الحضانة إلى سطح العقيمة. شريحة المقطع إلى قطع صغيرة تصفية باستخدام شفرة معقمة.
- نقل القطع إلى تصفية 2 أنابيب microcentrifuge مل ، 1 مل يحتوي كل منها على برنامج تلفزيوني. غطاء الأنبوب بإحكام وختمها مع parafilm. احتضان عند 37 درجة مئوية و 200 دورة في الدقيقة لمدة 10 دقيقة.
- تأمين أنابيب الصعود إلى دوامة vortexer وبالسرعة القصوى لمدة 5 دقائق. الماصة وطاف في أنبوب إيبندورف العقيمة 15 مل. كرر الخطوات الحضانة ودوامة لمدة 5 مرات أكثر. الجمع بين طاف في نفس الانبوب إيبندورف 15 مل لكل عينة. عادة ، يمكن استرداد 80 ٪ من الخلايا في التعليق.
- تخزين طاف مع الخلايا معلق في 4 درجات مئوية. فرز داخل 2 يوما.
4. تحليل FACS
تم وصف الإجراء لتدفق عداد الكريات FACSAria دينار بحريني والبرمجيات المناظرة هنا.
- تحسين وضع الخطوات التالية تدفق عداد الكريات موصى بها من قبل الشركة المصنعة. وهذا يستتبع : ضبط السيطرة التضخيم لتعيين المعلمات breakoff المطلوبة والبقعة الحلوة ؛ تحقيق الاستفادة المثلى من تأخير الليزر وعوامل القياس منطقة للتجربة الضغط غمد وتحسين ضبط الفولتية FSC والتعاون بين بلدان الجنوب ، عتبة FSC ، FSC مضان التحجيم ، مضان الفولتية PMT ، الخ.
- تشغيل مراقبة عينات سلبية على تدفق عداد الكريات (FCM) على أساس كثافة مضان من التشرذم والجانب FITC (SSC). زيادة عتبة FITC حتى لا يتحكم في الخلايا يمكن تصور سلبي عن طريق عرض شراء FITC - SSC.
- تشغيل عينات مراقبة عدم الجمع ودراسة نمط توزيع 10000 الخلايا استنادا FITC واقتناء SSC. تعريف البوابة لإحاطة جميع الخلايا واعتبار هذه المناطق "الخلايا منخفض الكثافة" (LIS).
- تشغيل DOC المعدل العينات ودراسة نمط توزيع 10000 الخلايا استنادا FITC والتعاون بين بلدان الجنوب. سوف تظهر بعض الخلايا في البوابة لي مسبقا. تعريف آخر للبوابة إحاطة الخلايا التي تحتوي على أعلى كثافة مضان (HIS) من الخصومة. الحصول على احصاءات لعرض الوفرة النسبية من الخلايا المغلقة.
- مرحبا فرز الخلايا في أنابيب جمع تحتوي على 500 برنامج تلفزيوني ميكرولتر في "تنقية 1 قطرة" واسطة. إنهاء الفرز عندما يصل عدد من صاحب 500000 التهم.
5. تصفية PCR التضخيم من الجينات 16S الرنا الريباسي
يتم تعديل إجراءات تصفية PCR من Kirchman وآخرون. 6
- تصفية الخلايا على فرز بيضاء ، 0.22 ميكرون ، مسام الحجم ، و 25 ملم القطر ، والغشاء البولي التصفية. تقليم قبالة حافة التصفية التي لا تحتوي على الخلايا البكتيرية باستخدام شفرة معقمة. شريحة التصفية إلى قطع متساوية الحجم 8.
- مكان قطعة واحدة في أنبوب تصفية تفاعل PCR ، مع الخلايا التي تواجه الداخل من الأنبوب. إضافة 45 درجة PCR ميكرولتر الماء في أنبوب تفاعل PCR. التصفية تماما في الماء يغرق.
- إضافة 2 اروش illustra PuReTaq قراءة الذهاب إلى الخرز PCR في أنبوب تفاعل PCR ، الدوامة لفترة وجيزة. إضافة 2 ميكرولتر كل من الأمام وعكس 16S جين الرنا الريباسي الاشعال (0.4 ميكرومتر تركيز النهائي لكل التمهيدي) ، مثل 27F و1492R 7 ، في كل من أنابيب تفاعل PCR.
- (اختياري) إضافة المصل البقري 1μl حل الزلال (جيش صرب البوسنة ، وتركيز النهائي 30μg/100 ميكرولتر) إلى خليط تفاعل PCR لمساعدة مثبطات كثف التضخيم. إذا كان واحد يختار عدم إضافة جيش صرب البوسنة ، إضافة 1μl من الماء بدلا من ذلك.
- أداء PCR التضخيم على cycler الحرارية. ينصح تهبط برنامج PCR ، الذي خفض درجة الحرارة الصلب بالتسلسل 62-52 درجة مئوية بحلول 1 درجة مئوية في كل دورة لمدة 11 دورات ، تليها 15 دورات الصلب مع ارتفاع درجة الحرارة من 52 درجة مئوية. جميع الدورات تشمل تغيير طبيعة (عند درجة 95) ، الصلب (في 62-52 درجة مئوية) ، والإرشاد (عند 72 درجة مئوية) لمدة الخطوات 50S. كما يتم تضمين أولية 3 دقيقة تمسخ والنهائية خطوة التمديد 10 دقيقة في البرنامج PCR.
- تأكيد PCR التضخيم من قبل الكهربائي على إيثيديوم بروميد الملطخة agarose هلام 1 ٪. استئصال amplicons PCR من الجل ونظيفة مع عدة QIAquick QIAGEN استخراج الهلام.
- أداء two التكبير PCR إضافية لكل عينة ، في كل مرة تستخدم قسما جديدا التصفية. بعد purificati هلام PCRعلى ، بركة amplicons لنفس العينة معا. تنقية 16S rDNA amplicons جاهزة الآن لعدد من التحليلات الجزيئية التي تتيح تحديد التصنيف ، مثل بناء مكتبة استنساخ وتسلسلها.
6. ممثل النتائج :
توصف به ممثل نتائج دراسة بوتريسين - المهينة البكتيريا كمثال على ذلك. وقد تم جمع عينات من المياه من موقع الساحلية جورجيا ومعالجتها وفقا للإجراءات المذكورة أعلاه. وكشف التحليل أن نظام مراقبة الأصول الميدانية بالإضافة بوتريسين يسببها تطوير مجموعة من البكتيريا مع كثافة عالية مضان FITC ، مشيرا الى ارتفاع معدل إدماج BrdU (الشكل 1). وقد تم تعيين هذه الخلايا كما عالية BrdU التأسيس الخلايا (HIS) وكان من المتوقع أن تحتوي في الغالب بوتريسين - المهينة البكتيريا. وكان صاحب المفقودين في الضوابط عدم بالإضافة إلى ذلك ، الذي لا يتضمن سوى الخلايا مع انخفاض مستويات التأسيس BrdU (LIS). وكان من المتوقع أساسا لاحتواء LIS العوالق البكتيرية التي لم تتمكن من استخدام بوتريسين المضافة. كانت له مرتبة في أنابيب فصل ثم جمعها على مرشحات الغشاء. تم الحصول على 16S الرنا الريباسي amplicons الجين للخلايا مرحبا عالية باستخدام فلتر PCR.
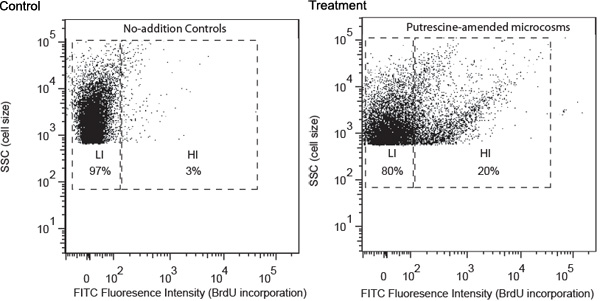
الشكل 1. تحليل تدفق cytometric لا بالإضافة إلى ذلك لمراقبة وطراز المركبة المعدل (بوتريسين كمثال هنا) العينات التي تم جمعها بعد 24 ساعة من الحضانة. واستند تحليل التوزيع على الخلية (1) كثافة مضان لوضع العلامات FITC (محور س) ، الذي يرتبط بشكل إيجابي على مستوى التأسيس BrdU ، و (2) الجانب مبعثر (SSC ، المحور الصادي) ، الذي يرتبط بشكل إيجابي إلى الخلية الحجم. ويستند بوابة التدوين على مستوى التأسيس BrdU ، (مرحبا ، عالية BrdU التأسيس ؛ LI منخفضة BrdU التأسيس). وترد النسبي للخلايا ومرحبا LI في البوابات المقابلة.
Discussion
نهجنا إدماج BrdU الأزواج ، وFACS 16S rDNA تحليل للسماح الأنواع على مستوى تحديد الهوية من العوالق البكتيرية التي استقلاب العناصر الفردية DOC في البيئات المائية. في مقايسة التأسيس BrdU التسميات الخلايا البكتيرية على أساس الأنشطة الأيضية ، والذي يسمح فقط على تحليل البكتيريا النش...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
تم توفير التمويل لهذا المشروع الوطني للعلوم OCE1029607 منح مؤسسة (لXM) وMCB0702125 (لمام) وغوردون وبيتي مور مؤسسة (لمام).
Materials
| Name | Company | Catalog Number | Comments | |
| اسم | نوع | شركة | فهرس العدد | تعليقات |
| BrdU | الكاشف | سيغما | B5002 - 5G | |
| الليزوزيم | الكاشف | سيغما | L6876 - 5G | |
| بروتين K | الكاشف | سيغما | P2308 - 25MG | |
| في الموقع كيت خلية الانتشار ، FLUOS | عدة | روش | 11810740001 | تستهلك أكثر من مكافحة BrdU - FLUOS العازلة والحضانة في رد فعل من المقترح من قبل المصنع. |
| غرف الحضانة الإطار الختم | مادة | الحيوي راد | SLF - 1201 | |
| البولي المرشحات الغشائية (142 ملم قطرها 1.0 ميكرومتر ، حجم المسام) | مادة | ميليبور | FALP14250 | |
| المرشحات الغشائية البولي (25 ملم القطر ، و 0.2 ميكرومتر ، حجم المسام) | مادة | ميليبور | FGLP02500 | |
| illustra PuReTaq جاهز للذهاب PCR الخرز | عدة | جنرال إلكتريك للرعاية الصحية | 27-9559-01 | |
| QIAquick هلام استخراج طقم | عدة | QIAGEN | 28704 | |
| المأمونة الجانب PCR النظام | عدة | EPICENTRE | FS99060 |
References
- Pernthaler, A., Pernthaler, J., Schattenhofer, M., Amann, R. Identification of DNA-synthesizing bacterial cells in coastal North Sea plankton. Appl. Environ. Microbiol. 68, 5728-5728 (2002).
- Urbach, E., Vergin, K. L., Giovannoni, S. J. Immunochemical detection and isolation of DNA from metabolically active bacteria. Appl. Environ. Microbiol. 65, 1207-12 (1999).
- Mou, X. Z., Hodson, R. E., Moran, M. A. Bacterioplankton assemblages transforming dissolved organic compounds in coastal seawater. Environ. Microbiol. 9, 2025-2025 (2007).
- Hodson, R. E., Dustman, W. A., Garg, R. P., Moran, M. A. In situ PCR for visualization of microscale distribution of specific genes and gene products in prokaryotic communities. Appl. Environ. Microbiol. 61, 4074-4074 (1995).
- Dinjens, W. N. Bromodeoxyuridine (BrdU) immunocytochemistry by exonuclease III (Exo III) digestion. Histochemistry. 98, 199-199 (1992).
- Kirchman, D. L., Yu, L. Y., Fuchs, B. M., Amann, R. Structure of bacterial communities in aquatic systems as revealed by filter PCR. Aquat. Microb. Ecol. 26, 13-13 (2001).
- Delong, E. F., Wickham, G. S., Pace, N. R. Phylogenetic stains: ribosomal RNA-based probes for the identification of single cells. Science. 243, 1360-1360 (1989).
- Artursson, V., Jansson, J. K. Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae. Appl. Environ. Microbiol. 69, 6208-6208 (2003).
- Mou, X. Z. Bacterial carbon processing by generalist species in the coastal ocean. Nature. 451, 708-708 (2008).
- Mou, X. Flow-cytometric cell sorting and subsequent molecular analyses for culture-independent identification of bacterioplankton involved in dimethylsulfoniopropionate transformations. Appl. Environ. Microbiol. 71, 1405-1405 (2005).
- Dean, F. B. Comprehensive human genome amplification using multiple displacement amplification. Proc. Natl. Acad. Sci. U.S.A. 99, 5261-5261 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved