Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bromodeoxyuridine (BrdU) Etiketleme ve Çözünmüş Organik Kültür bağımsız Kimlik sonraki Floresan Aktive Hücre Sıralama Karbon-aşağılayıcı Bacterioplankton
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Çevre bacterioplankton bir model ile çözünmüş organik karbon (DOC) bileşik ve bir DNA etiketleme reaktif bromodeoxyuridine (BrdU) inkübe edilir. Daha sonra floresan aktif hücre sıralama (FACS) kullanarak kendi yükseltilmiş BrdU dahil dayalı toplu topluluk, DOC-aşağılayıcı hücreleri ayrılır. Bu hücreler daha sonra sonraki moleküler analizleri ile tespit edilir.
Özet
Mikroplar sucul ortamlarda pek çok çözünmüş organik karbon (DOC) yüzeylerde bozulması aracılık önemli ajanlardır. Ancak, doğada DOC özel havuzları dönüştürmek bakteri taksonların belirlenmesi teknik bir sorun teşkil etmektedir.
Burada bir yaklaşım tarif çiftler bromodeoxyuridine (BrdU) dahil, floresan aktif hücre sıralama (FACS) ve 16S rRNA gen tabanlı sucul ortamlarda aşağılayıcı belirli bir DOC bileşik yetenekli bacterioplankton kültür-bağımsız bir kimlik sağlar moleküler analizler. Üç kat bacterioplankton microcosms BrdU ve bir model DOC bileşik (DOC değişiklikler), ya da sadece BrdU (no ek kontrol) almak için ayarlanır. Yeni sentezlenmiş bakteriyel DNA ve BrdU-işaretli DNA timidin BrdU yerine pozisyonları kolayca immunodetected 1,2 olabilir. Katma DOC bileşik seçici aktive olması beklenen ve bu nedenle hiçbir BrdU esas DOC değişiklikler ve hücre dışı duyarlı hücreler daha yüksek seviyelerde (HI hücreleri) vardır kullanabilmek 24 saat inkübasyon, bacterioplankton sayesinde Ayrıca kontroller (düşük BrdU dahil hücreleri LI hücreleri). Floresan İmmuno sonra, HI hücreleri ayırt edilirler ve fiziksel floresan aktive hücre sıralama (FACS) 3 LI hücreleri ayrılır. Sıralama DOC-duyarlı hücreleri (HI hücreleri) DNA ayıklanır ve taksonomik rRNA gen-temelli analiz PCR, klon kütüphane yapım ve sıralama da dahil olmak üzere sonraki 16S ile tanımlanır.
Protokol
1. Su örneği işleme
- Filtre 1 mikron gözenek boyutlu membran filtreler aracılığıyla 10L çevre su büyük parçacıklar ve bacteriovores kaldırın. Bir damacana su süzüntü toplayın.
- Transferi 3 4 ml taze hazırlanmış paraformaldehid çözüm (% 10 PFA) içeren steril Eppendorf tüpleri (50 ml) içine 36 ml süzüntü her. Hücreleri korumak için 2 saat oda sıcaklığında inkübe edin. Vakum filtrasyon ile 0.22 mikron-gözenek boyutlu beyaz membran filtreler üzerine hücreleri toplayın. Vakum filtrasyonu filtre üzerinden geçen 10 ml salin (PBS) ve fosfat tamponlu filtre yıkayın. Negatif kontrol olarak filtreleri Etiket ve -20 ° C'de saklayın
Adımlar 1,3-1,4 DOC sınırlı koşullar oluşturulması için isteğe bağlıdır.
- (5 mcM NH 4 Cl, 5 mcM NaNO 3, ve 1 mikrona NaH 2 PO 4 final konsantrasyon) damacana inorganik azot ve fosfor karışımı ekleyin.
- Zaman zaman ajitasyon ile 48 saat boyunca yerinde sıcaklığında karanlıkta inkübe edin.
2. Microcosm kurulması ve inkübasyon
- Her altı 1-L cam şişe, microcosms kurmak için adım 1.4 damacana 800 ml su numunesi ile doldurun. Her mikrokozmosu BrdU (10 mcM, nihai konsantrasyonu) ekleyin. İyice karıştırın.
- Microcosms üç gruba 1 ml modeli DOC bileşik çözüm, bu DOC değişiklikler olarak görev yapacak. Kalan üç microcosms içine 1 ml steril PBS, bu ek kontrol olarak hizmet verecek.
- Bir kuluçka çalkalayıcı microcosms inkübe ve 100 rpm'de sallayarak sırasında in situ sıcaklığında karanlıkta inkübe edin .
- Her mikrokozmosu ve transfer süresi 0 puan, 8, 16, ve 24 saat için 50 ml steril Eppendorf tüpleri içine 36 ml su numunesi toplayın. Hemen taze PFA toplama tüpleri 4 ml (% 10) ve hücreleri korumak için 2 saat oda sıcaklığında inkübe edin.
- 0.22-mikron gözenek boyut polikarbonat membran filtreler aracılığıyla Filtre hücreleri korunmuş. Filtreleri 10 ml PBS ile yıkayın. Hemen bir sonraki adıma geçin veya -20 ° C'de filtreleri saklamak
3 BrdU Ortaklığı yerinde İmmuno
- Oda sıcaklığında filtreler (DOC değiştirilmiştir numuneleri, herhangi bir ek kontrol ve negatif kontrol) Çözülme.
- 1 ml lizozim çözümü uygulayın [10 mg / ml lizozim yumurta beyazı 100 mM Tris, 50 nM EDTA (pH = 8)] filtre bakteri hücreleri kapsayacak şekilde 4. 30 dakika oda sıcaklığında inkübe edin. Emme altında 10 ml PBS üzerinden geçerek filtre yıkayın.
- 1 ml proteinaz K çözüm [2 mg / ml proteinaz K 100 mM Tris, 50 nM EDTA (pH = 8)] filtre bakteri hücreleri kapsayacak şekilde 4. 30 dakika oda sıcaklığında inkübe edin. Emme altında 10 ml PBS üzerinden geçerek filtre yıkayın.
- 1 ml eksonükleaz çözüm [eksonükleaz III (50 U / ml) 5 mM MgCl 2 ve 50 mM Tris-HCl] 5 filtre bakteri hücreleri kapsayacak şekilde ekleyin. 37 ° C'de 30 dakika. Emme altında 10 ml PBS üzerinden geçerek filtre yıkayın.
- Üreticinin talimatlarına göre çerçeve mühür inkübasyon odaları (Bio-Rad) birleştirin.
- Alkol-kuru temizleme yüzey steril bir bıçak kullanarak sekizde içine filtre dilimleyin.
- Forseps kullanarak, bir monte çerçeve mühür inkübasyon odası (sekiz çerçeve mühür odaları, her filtre örnek için gerekli olan) bir filtre sekizinci bölümüne yerleştirin. Hücreleri içeren filtre bölümü tarafında yukarıya doğru bakmalıdır. Filtrenin arka kısmında nem filtresi sopa slayt sağlayacaktır. Filtre kuru olursa, slayttaki filtre bölümüne yerleştirmeden önce, odanın merkezinde dih 2 O küçük bir damla (2 ul) geçerlidir .
Adımlar 3,8-3,20 üreticinin talimatlarına modifiye prosedürler izlenerek, Situ Hücre Çoğalması Kit ROCHE reaktifler FLUOS kullanabilirsiniz. PBS için hariç, tüm reaktifler kit içinde sağlanır.
- Mühür uygulandıktan sonra taşma neden olmaksızın eşit kuluçka odasının tüm filtre bölümünde karşılamak için yeterli inkübasyon tampon (% 0.5 sığır serum albümin, PBS içinde% 0.1 Tween20,) uygulayın.
- Kuluçka odasının çerçeve üzerinde polyester çerçeve kapak yerleştirin. Kuluçka odasının mühür için sıkıca bastırın. Filtre üzerindeki hava kabarcıkları kaçının. Kapalı odaları karanlıkta, oda sıcaklığında 10 dakika inkübe edin.
- Polyester mühür çıkarın ve inkübasyon odaları açmak. (Not: odaları açılması bazen slayt çerçeve mühür yukarı çekin Bu durumda, aşağıdaki adımları için yeni bir oda hazırlamak.)
- Odanın bir köşesinde, kuluçka tampon dışarı pipetleyin. Filtresi ile temasından kaçının.
- Hafifçe 100 ul PBS pipetleme filtreyi yıkayın ve3 kez odasından dışarı.
- Kullanımdan hemen önce, üretici tarafından önerilen adımları izleyerek anti-BrdU-FLUOS çalışma çözeltisi hazırlayın.
- Pipetleyin 120 ul anti-BrdU-FLUOS, filtre üzerine çözüm eşit olarak tüm yüzeyini kaplayan özen gösterin.
- Odasına yeni bir polyester kapağını kapatın. Filtrenin üstünde hava kabarcıkları kaçının. 37 karanlık oda ° C'de 3 saat. Bu adım, floresein izotiyosiyanat (FITC) ile in situ BrdU dahil DNA etiket.
- Polyester kapağını çıkarın ve kuluçka odasının açık. Anti-BrdU-FLUOS çözüm pipetleyin. PBS ile filtre 3 kere yıkayın.
- Kuluçka odasının steril bir yüzey için filtre aktarın. Steril bir bıçak kullanarak filtre bölümüne küçük parçalar halinde dilimleyin.
- 2 ml mikrosantrifüj tüpler, 1 ml PBS içeren her filtre parçaları aktarın. Sıkıca parafilm ve mühür ile tüp kap. 37 ° ° C'de ve 10 dakika için 200 rpm.
- 5 dakika maksimum hızda vortexer ve girdap üzerine tüpleri sabitleyin. 15 ml steril Eppendorf tüp içine pipetleyin süpernatantı. 5 kez daha inkübasyon ve vorteks adımları tekrarlayın. Her numune için aynı 15 ml Eppendorf tüp süpernatant birleştirin. Tipik olarak,% 80 hücre süspansiyonu telafi edilebilir.
- Süpernatant Mağaza yeniden süspanse hücreleri ile 4 ° C 2 gün içinde sıralayın.
4. FACS analizi
BD FACSAria akış sitometresinin ve ilgili yazılım için bir prosedür burada tanımlanmıştır.
- Üretici tarafından önerilen akış sitometresi aşağıdaki adımları ayarı optimize edin. Bu ısrar ediyor: gerekli kopmasına parametreleri ve tatlı nokta ayarlamak için amplifikasyon kontrolü ayarlayarak; deneme kılıf basınç için lazer gecikme ve alan ölçekleme faktörleri optimize edilmesi ve FSC ve SSC gerilimler, FSC eşik, FSC floresan ölçekleme, floresan kompansasyonunu ayarlarını optimize , vb.
- FITC ve yan dağılım (SSC) floresan yoğunluğuna göre akış sitometresi (FCM) negatif kontrol örnekleri çalıştırın. FITC eşik negatif kontroller hiçbir hücre FITC SSC satın ekran görüntülenebilmekte kadar artırın.
- Herhangi bir ek kontrol numunelerinin çalışılabilmesi ve FITC ve SSC satın alma dayalı 10.000 hücrelerinin dağılımı desen inceleyin. Tüm hücrelerin içine ve "düşük yoğunluklu hücreleri" (Lis) olarak belirlemek için bir kapı tanımlayın.
- DOC-tadil örnekleri çalıştırın ve FITC ve SSC dayalı 10.000 hücrelerinin dağılım paterni incelemek. Bazı hücreler, önceden belirlenmiş LI kapısında belirir. Lis daha yüksek floresan (HIS) hücrelerin içine başka bir kapı tanımlayın. Kapılı hücrelerin göreceli bolluk görüntülemek istatistiklerini edinin.
- "Arındırır 1 damla" modunda 500 ul PBS içeren toplama tüpleri içine sırala HI hücreleri. Onun sayısı 500.000 sayar ulaştığında sıralama sonlandırın.
5. Filtre PCR 16S rRNA genleri
Filtre PCR işlemleri Kirchman ark değiştirilmiş 6
- Filtre beyaz üzerine sıralanmış hücreleri, 0.22 mikron gözenek boyutu, 25 mm çap, polikarbonat membran filtreden. Steril bir bıçak kullanarak herhangi bir bakteri hücreleri içeren filtre kenarından kesin. Filtre 8 eşit büyüklükte parçalar halinde dilimleyin.
- Hücreleri tüp içe bakan, bir PCR reaksiyonu tüp içine tek bir filtre parçası yerleştirin. PCR reaksiyonu tüpe 45 ul PCR sınıf su ekleyin. Tamamen su filtre Submerge.
- 2 ROCHE versiyonu gösterime PuReTaq okuyun-To-Go, PCR reaksiyonu tüpe PCR Boncuk kısaca vorteks ekleyin. PCR reaksiyon tüpleri her birine 2 ul 27F ve 1492R 7 olarak ileri ve geri 16S rRNA gen primerleri (0.4 mcM her astar için son konsantrasyon), her ekleyin.
- (Isteğe bağlı) adsorbe amplifikasyon inhibitörlerinin yardımcı olmak için PCR reaksiyon karışımının 1μl sığır serum albumin solüsyonu (BSA, nihai konsantrasyonu 30μg/100 ul) ekleyin. BSA eklemek seçerse, bunun yerine su 1μl eklemek.
- Termal cycler PCR gerçekleştirin. PCR programı aşağı bir dokunuş tavsiye edilir, hangi sırayla 62 ve 52 azalan tavlama sıcaklığına sahiptir ° C 1 ° C 11 52 tavlama sıcaklığı 15 döngüleri takip döngüleri, ° C için çevrim başına Tüm döngüleri, denatüre (95 ° C), (62 52 ° C) tavlama ve uzatma (72 ° C'de) 50'li süresi adımlarla içerir. Bir ilk 3 dakika denatürasyon ve son 10 dakikalık uzatma adım PCR programı da dahil.
- Etidyum bromür lekeli% 1 agaroz jel elektroforezi ile PCR onaylayın. Vergi PCR jel amplikonlarının ve QIAGEN QIAquick jel ekstraksiyon kiti temiz.
- Her numune için iki ek PCR gerçekleştirin, her zaman yeni bir filtre bölümünü kullanabilirsiniz. PCR jel purificati sonraüzerinde, birlikte aynı örnek amplikonlarının havuzu. Saf 16S rDNA amplikonlarının klon kütüphane yapım ve sıralama olarak taksonomik tanımlama, izin veren bir dizi moleküler analizler için hazır.
6. Temsilcisi sonuçları:
Temsilcisi sonuçlar bir örnek olarak putrescine aşağılayıcı bakteri bir çalışma ile açıklanmıştır. Gürcistan sahil kesiminde yer alan su örnekleri alınan ve yukarıda açıklanan prosedürleri takip işlendi. FACS analizi putrescine Ayrıca yüksek BrdU birleşme oranı (Şekil 1) gösteren, yüksek FITC floresan bir grup bakteri gelişimi neden olduğu saptandı. Bu hücreler yüksek BrdU dahil hücreleri (HIS) olarak belirlenmiş ve çoğunlukla putrescine-aşağılayıcı bakteri içermesi bekleniyor. Onun sadece düşük düzeyde BrdU dahil (LIS) ile hücreler içeren herhangi ek kontroller, eksikti. Lis esas eklendi putrescine kullanmak için koyamadık bacterioplankton içeren bekleniyor. Onun ayrı tüpler içine sıralanır ve sonra membran filtreleri üzerine toplandı. 16S rRNA gen amplikonlarının filtre PCR kullanarak yüksek HI hücreler için elde edilmiştir.
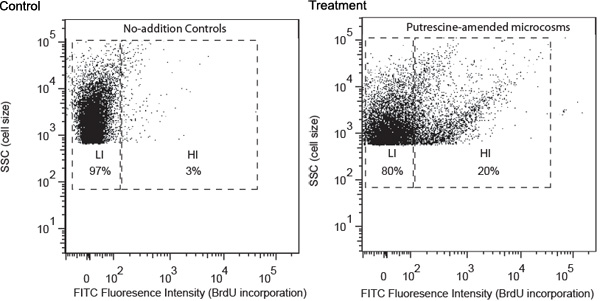
Şekil 1. ek kontrolü ve inkübasyon 24 saat sonra toplanan, (Burada bir örnek olarak putrescine) model bileşik-tadil örnek Akış sitometrik analizi . Hücre dağılımı analizi (1) olumlu BrdU dahil düzeyi ile ilgili FITC etiketleme (x-ekseni), floresan dayalı, ve (2) yan dağılım (SSC, y-ekseni), olumlu bir hücre ile ilgili olduğu boyutu. Kapısı gösterimde BrdU dahil, (LI, düşük BrdU-birleşme HI yüksek BrdU dahil) düzeyi dayanmaktadır. HI ve LI hücrelerin göreli yüzdesi ilgili kapıları gösterilmiştir.
Tartışmalar
Bizim yaklaşımımız çiftler BrdU bir FACS ve 16S rDNA analiz sucul ortamlarda bireysel DOC bileşenleri metabolize bacterioplankton tür düzeyinde kimlik izin vermek. BrdU dahil tahlil bakteri hücrelerinin metabolik faaliyetleri, sadece aktif bakteri analizi sağlar ve böylece uyuyan hücreleri içermez dayalı etiketler. Bizim yaklaşımımız, BrdU dahil, sonradan görselleştirildiği BrdU esas farklı düzeylerde immunodetected yerinde ve bakteri FACS kullanarak gruplandırılmış ve sıralanmış. ...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu projenin finansmanı Ulusal Bilim Vakfı hibe OCE1029607 (XM) ve MCB0702125 (MAM) ve Gordon ve Betty Moore Vakfı (MAM) tarafından sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| Isim | Tip | Şirket | Katalog numarası | Yorumlar |
| BrdU | Reaktif | Sigma | B5002-5G | |
| Lizozim | Reaktif | Sigma | L6876-5G | |
| Proteinaz K | Reaktif | Sigma | P2308-25mg | |
| Situ Hücre Çoğalması Takımı, FLUOS | Seti | Roche | 11810740001 | Anti-BrdU-FLUOS ve üretici tarafından önerilen daha reaksiyon başına Kuluçka tampon daha fazla tüketin. |
| Çerçeve-Seal Kuluçka Odaları | Malzeme | Bio-Rad | SLF-1201 | |
| Polikarbonat Membran Filtreler (142 mm çap, 1,0 mikron gözenek boyutu) | Malzeme | Millipore | FALP14250 | |
| Polikarbonat Membran Filtreler (25 mm çap, 0,2 mikron gözenek boyutu) | Malzeme | Millipore | FGLP02500 | |
| versiyonu gösterime PuReTaq Ready-To-Go PCR boncuklar | Seti | GE Healthcare | 27-9559-01 | |
| QIAquick jel ekstraksiyon kiti | Seti | QIAGEN | 28704 | |
| FailSafe PCR Sistemi | Seti | Epicentre | FS99060 |
Referanslar
- Pernthaler, A., Pernthaler, J., Schattenhofer, M., Amann, R. Identification of DNA-synthesizing bacterial cells in coastal North Sea plankton. Appl. Environ. Microbiol. 68, 5728-5728 (2002).
- Urbach, E., Vergin, K. L., Giovannoni, S. J. Immunochemical detection and isolation of DNA from metabolically active bacteria. Appl. Environ. Microbiol. 65, 1207-12 (1999).
- Mou, X. Z., Hodson, R. E., Moran, M. A. Bacterioplankton assemblages transforming dissolved organic compounds in coastal seawater. Environ. Microbiol. 9, 2025-2025 (2007).
- Hodson, R. E., Dustman, W. A., Garg, R. P., Moran, M. A. In situ PCR for visualization of microscale distribution of specific genes and gene products in prokaryotic communities. Appl. Environ. Microbiol. 61, 4074-4074 (1995).
- Dinjens, W. N. Bromodeoxyuridine (BrdU) immunocytochemistry by exonuclease III (Exo III) digestion. Histochemistry. 98, 199-199 (1992).
- Kirchman, D. L., Yu, L. Y., Fuchs, B. M., Amann, R. Structure of bacterial communities in aquatic systems as revealed by filter PCR. Aquat. Microb. Ecol. 26, 13-13 (2001).
- Delong, E. F., Wickham, G. S., Pace, N. R. Phylogenetic stains: ribosomal RNA-based probes for the identification of single cells. Science. 243, 1360-1360 (1989).
- Artursson, V., Jansson, J. K. Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae. Appl. Environ. Microbiol. 69, 6208-6208 (2003).
- Mou, X. Z. Bacterial carbon processing by generalist species in the coastal ocean. Nature. 451, 708-708 (2008).
- Mou, X. Flow-cytometric cell sorting and subsequent molecular analyses for culture-independent identification of bacterioplankton involved in dimethylsulfoniopropionate transformations. Appl. Environ. Microbiol. 71, 1405-1405 (2005).
- Dean, F. B. Comprehensive human genome amplification using multiple displacement amplification. Proc. Natl. Acad. Sci. U.S.A. 99, 5261-5261 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır