JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Bromodeoxyuridine (BrdU) 레이블과 녹아 유기 문화 독립적인 확인을위한 후속 형광 활성 세포 정렬 탄소 굴욕 Bacterioplankton
요약
환경 bacterioplankton는 유기 탄소 (DOC) 화합물과 DNA 라벨 시약, bromodeoxyuridine (BrdU)를 해산 모델 incubated 있습니다. 그 후, DOC - 굴욕적인 세포는 형광 활성 세포 분류 (외과)를 사용하여 고가 BrdU의 설립에 따라 대량 지역 사회에서 분리됩니다. 이러한 전지는 다음 이후의 분자 분석에 의해 식별됩니다.
초록
미생물이 수중 환경에서 다수의 용해 유기 탄소 (DOC) 기판의 저하를 중재 주요 수단이된다. 그러나, 자연 DOC의 특정 풀을 변형 박테리아 taxa의 식별은 기술적인 도전을 포즈.
여기서 우리는 접근 방식을 설명하는 것을 커플 bromodeoxyuridine (BrdU) 정관, 형광 활성 세포 분류 (외과), 그리고 16 수생 환경에서 굴욕 특정 DOC 화합물 가능한 bacterioplankton 문화 독립적인 식별이 가능 rRNA 유전자 기반의 분자 분석. 세중의의 bacterioplankton의 microcosms은 BrdU와 모델 DOC 화합물 (DOC 개정) 또는 전용 BrdU (노 또한 컨트롤)를 모두 받도록 설정되었습니다. 새로 합성된 박테리아 DNA와 BrdU - 라벨 DNA의 thymidine의 BrdU의 대용품이 순위는 쉽게 immunodetected 1,2 수 있습니다. 추가 DOC 화합물을 선택적으로 활성화 될 것으로 예상하고, 따라서에서 노 DOC의 개정과 세포에 비 응답 전지보다 BrdU의 설립 높은 수준의 (HI 세포)를 가지고 있습니다 사용할 수 있습니다 24 시간 보육, bacterioplankton 통해 또한 컨트롤 (낮은 BrdU의 설립 세포, LI 전지). 형광 면역 후, HI 전지는 구별하고 육체적으로 형광 활성 세포 분류 (외과) 3 LI 세포 분리. 정렬 DOC - 반응 전지 (HI 세포)의 DNA가 추출 taxonomically PCR, 클론 라이브러리 구축 및 시퀀싱을 포함하여 rRNA 유전자 기반의 분석 이후 16를 통해 식별됩니다.
프로토콜
1. 워터 샘플 처리
- 1 μm의 - 기공 크기의 멤브레인 필터를 통해 필터 10L 환경 물은 큰 입자와 bacteriovores을 제거합니다. 상자 속에 든 대형 유리병에 물을 여과물를 수집합니다.
- 4 ML 신선한 paraformaldehyde 용액 (; 10% PFA)를 포함하는 3 멸균 Eppendorf 튜브 (50 ML)로 전송 36 ML 각 여과물. 세포를 보존하기 위해 상온에서 2 시간을위한 부화. 진공 여과에 의해 0.22 - μm의 - 기공 크기의 흰색 멤브레인 필터에 세포를 수집합니다. 진공 여과에 의한 필터를 통해 호수 (PBS)를 인산 버퍼 10 ML를 전달하여 필터를 씻으십시오. 부정적인 컨트롤로 필터를 라벨 및 -20 ° C.에 그들을 저장
단계 1.3-1.4 DOC - 제한 조건을 설정을위한 옵션입니다.
- (5 μm의 NH 4 Club 호텔, 5 μm의 나노 3, 1μM 아니 2 PO 4 최종 농도) 상자 속에 든 대형 유리병에 무기 질소와 인의 혼합물을 추가합니다.
- 가끔 agitations 48 시간 동안 현장의 온도에서 어둠 속에 품어.
2. 소우주 설립과 부화
- microcosms을 설정하는 단계 1.4의 상자 속에 든 대형 유리병에서 800 ML 물 샘플 여섯 1 - L 유리 flasks 각각 입력합니다. 각각의 소우주로 BrdU (10 μm의 최종 농도)을 추가합니다. 잘 섞는다.
- microcosms 세에 한 ML 모델 DOC 화합물 솔루션을 추가, 이들은 DOC의 개정안이 될 것입니다. 세 남아 microcosms로 한 ML 멸균 PBS를 추가, 이들은 노 또한 컨트롤 역할을합니다.
- 보육 흔드는 모든 microcosms을 품어 100 rpm으로 흔들어하면서 현장의 온도에서 어둠 속에 품어.
- 시간 0 점, 8, 16, 24 시간 50 ML 살균 Eppendorf 튜브에 각각의 축소판 및 전송에서 물 샘플 36 ML를 수집합니다. 즉시 수집 튜브에 신선한 PFA 4 ML (10 %)를 추가하고 세포를 보존하기 위해 상온에서 2 시간에 대해 숙고하다.
- 필터는 0.22 - μm의 - 기공 크기의 폴리 카보 네이트 막 필터를 통해 세포를 보존. 10 ML PBS로 필터를 씻으십시오. 다음 단계로 바로 진행 또는 -20 ° C.에 필터를 저장
3. BrdU의 설립에 대한해라 면역에
- 상온에서 필터 (DOC 개정 샘플, 노 또한 컨트롤과 부정적인 컨트롤) 해동.
- 라이 소 자임 솔루션 1 ML을 적용합니다 [10 100 MM 트리스, 50 NM EDTA (에틸렌 다이아 민 테트라 초산)에서 MG / ML 라이 소 자임 흰자위 (산도 = 8)] 필터에 박테리아 세포를 충당하기 위해 4. 30 분 실온에서 알을 품다. 흡입에 따라 그것을 통해 10 ML PBS를 전달하여 필터를 씻으십시오.
- proteinase K 용액 1 ML 추가 [2 100 MM 트리스, 50 NM EDTA (에틸렌 다이아 민 테트라 초산)에서 MG / ML proteinase K (산도 = 8)] 필터에 박테리아 세포를 충당하기 위해 4. 30 분 실온에서 알을 품다. 흡입에 따라 그것을 통해 10 ML PBS를 전달하여 필터를 씻으십시오.
- 1 ML의 exonuclease 솔루션 [exonuclease III (50 U / ML) 5 MM의 MgCl 2, 50 MM 트리스 - HCL] 5 필터에 박테리아 세포를 표지에 추가합니다. 37 품어 ° C를 30 분. 흡입에 따라 그것을 통해 10 ML PBS를 전달하여 필터를 씻으십시오.
- 제조 업체의 지시에 따라 프레임 씰 배양 챔버 (생물 래드)를 조립.
- 알코올 세척 건조 표면에 살균 블레이드를 사용하여 eighths에 필터를 슬라이스.
- 포셉를 사용하여 하나의 조립 프레임 씰 배양 챔버 (8 프레임 인감 챔버 스가 각 필터 샘플이 필요합니다)에 필터의 여덟째 섹션을 놓으십시오. 세포를 포함하는 필터 부분의 측면 위쪽 얼굴 것입니다. 필터의 뒷면에있는 수분은 슬라이드 필터 막대기를하실 수 있습니다. 필터가 건조되면, 슬라이드에있는 필터 섹션을 배치하기 전에 챔버의 중앙에 diH 2 O의 작은 방울 (2 μl)를 적용할 수 있습니다.
단계 3.8-3.20는 제조 업체의 지침에서 변경 절차에 따라 현장 세포 증식 키트에서 호슈에서 시약을 FLUOS 사용합니다. PBS를 제외하고, 모든 시약은 키트 안에 제공됩니다.
- 균일하게 도장이 적용되면 오버플로가 발생하지 않고 배양 챔버의 전체 필터 부분을 커버하기에 충분한 배양 버퍼 (0.5 % 소 혈청 횐자위, PBS에 0.1 % Tween20) 적용됩니다.
- 배양 챔버 프레임을 통해 폴리 에스테르 프레임 커버를 놓습니다. 단단히 배양 챔버를 밀봉 아래로 누르십시오. 필터 위에 기포를 사용하지 마십시오. 어둠 속에서 실온에서 10 분에 대한 봉쇄 실 품어.
- 폴리 에스테르 도장을 제거하고 배양 챔버 스를 엽니다. (참고 : 챔버를 열고 때로는 슬라이드에서 프레임 인감 끌어 올려서 그 경우에는 다음 단계에 대한 새로운 챔버를 준비..)
- 챔버 한 구석에서 부화 버퍼 아웃 Pipet. 필터와 접촉을 피하십시오.
- 부드럽게 100 μl PBS를 pipetting하여 필터를 세척하고챔버에서 밖으로 3 회.
- 바로 사용하기 전에 제조 업체에서 권장하는 단계를 다음과 같은 안티 - BrdU - FLUOS 작업 솔루션을 준비합니다.
- Pipet 120 μl 방지 BrdU - FLUOS, 필터에 솔루션을 작업을 균일하게하여 전체 표면을 커버주의한다.
- 새로운 폴리 에스테르 커버와 챔버를 봉인. 필터 위에 공기 방울을 피하십시오. 37 어둠의 챔버를 품어 ° C를 3 시간 동안. 이 단계는 플루오레신 isothiocyanate (FITC)와 현장에서 BrdU 통합의 DNA 라벨을 것입니다.
- 폴리 에스테르 커버를 제거하고 배양 챔버를 엽니다. 안티 BrdU - FLUOS 작업 솔루션을 밖으로 Pipet. PBS와 필터 3 번 씻으십시오.
- 배양 챔버에서 멸균 표면에 필터를 전송합니다. 멸균 블레이드를 사용하여 작은 조각으로 필터 섹션을 얇게.
- 2 ML microcentrifuge 튜브, 1 ML PBS를 포함하는 각에 필터 조각을 전송합니다. 단단히 parafilm으로 튜브와 인감을 모자. 37 품어 ° C와 10 분, 200 RPM.
- 5 분 최대 속도 vortexer과 소용돌이로 튜브를 고정합니다. 멸균 15 ML Eppendorf 튜브에 Pipet 뜨는합니다. 5 번 이상을위한 인큐베이션 및 와동의 단계를 반복합니다. 각 샘플에 대해 동일한 15 ML Eppendorf 튜브에 뜨는을 결합합니다. 일반적으로 80 % 세포 현탁액에서 복구할 수 있습니다.
- 4 resuspended 세포와 표면에 뜨는를 저장 ° C. 2 일 이내에 정렬합니다.
4. 외과 분석
BD FACSAria 흐름 cytometer와 해당 소프트웨어에 대한 절차는 여기에 설명되어 있습니다.
- 제조 업체에서 권장하는 흐름 cytometer의 다음 단계의 설정을 최적화합니다. 이 알아볼 필요 breakoff 매개 변수와 달콤한 자리를 설정하는 증폭 제어를 조정하고, 실험 쉬스 압력 레이저 지연과 영역 확장 요소를 최적화하고 FSC와 SSC 전압, FSC 임계값, FSC 형광 스케일링, 형광 PMT 전압 설정을 최적화 등
- FITC 측면 분산형 (SSC)의 형광 강도에 따라 흐름 cytometer (FCM)에 부정적인 컨트롤 샘플을 실행합니다. 부정적인 컨트롤에 세포가 FITC - SSC 수집 디스플레이에 의해 시각을 사용할 수 없습니다 때까지 FITC 임계값을 높이십시오.
- 노 또한 제어 샘플을 실행하고 FITC와 SSC 인수에 따라 만 세포의 분포 패턴을 확인합니다. 모든 세포를 싸주십시오 그리고 "낮은 강도 전지"(LIS)로 지정하기위한 게이트를 정의합니다.
- DOC - 개정 샘플을 실행하고 FITC와 SSC에 따라 만 세포의 분포 패턴을 확인합니다. 일부 세포는 미리 LI 게이트에 나타납니다. LIS보다 높은 형광 강도를 (그의)가 세포를 묶으 다른 게이트를 정의합니다. 문이 세포의 상대적인 풍부를 볼 수 통계를 수집.
- "정화 한 방울"모드에서 500 μl PBS를 포함하는 컬렉션을 튜브로 정렬 HI 세포. 그의 수가 500,000 카운트에 도달할 때 정렬을 종료할 수 있습니다.
5. 16의 필터 PCR 증폭은 rRNA 유전자를
필터 PCR 절차 Kirchman 외에서 수정 6.
- 흰색에 필터 정렬 세포, 0.22 μm의 - 기공 크기, 25mm 지름, 폴리 카보 네이트 멤브레인 필터. 멸균 블레이드를 사용하여 어떤 박테리아 세포를 포함하지 필터의 가장자리를 낸다. 8 동등한 크기의 조각으로 필터를 슬라이스.
- 세포가 튜브의 안쪽을 향하고과 PCR 반응 관에 하나의 필터 부분을 넣으십시오. PCR 반응 관에 45 μl PCR 등급 물을 추가합니다. 물 속에 완전히 필터 잠수함.
- 이 호슈 illustra PuReTaq 읽기 - 투 - 고, PCR 반응 관에 PCR 비즈를 간단히 와동을 추가합니다. PCR 반응 튜브의 각으로, 2 μl 같은 27F 및 1492R 7로 순방향 및 역방향 16 rRNA 유전자 primers (0.4 μm의 각 프라이머에 대한 최종 농도)를 각각 추가합니다.
- (선택 사항) adsorb 증폭 억제제를 돕기 위해 PCR 반응 혼합물에 1μl 소 혈청 알부민 솔루션 (BSA, 최종 농도가 30μg/100 μl)을 추가합니다. 한 BSA를 추가하지 선택한 경우, 대신에 물을 1μl 추가할 수 있습니다.
- 열 자전거 타는 사람에 PCR 증폭을 수행합니다. PCR 프로그램 다운 터치 권장합니다, 이것은 순차적으로 62에서 52로 감소 어닐링 온도를 가지고 ° C 1 ° C 52 어닐링 온도와 15주기에 의해 다음 11주기, ° C.에 대한 사이클당 모든주기는 (95 ° C에서) denaturing (62에서 52 ° C) 어닐링, 및 확장 (72 ° C에서) 50 기간의 단계를 포함합니다. 초기 3 분 변성 및 최종 10 분 확장 단계는 PCR 프로그램에 포함되어 있습니다.
- ethidium 브로마이드 묻은 1퍼센트 아가로 오스 겔 전기 영동에 의한 PCR의 증폭을 확인합니다. 엑사이스 PCR의 겔에서 amplicons 및 QIAGEN QIAquick 겔 추출 키트와 함께 청소하십시오.
- 각 샘플에 대한 두 개의 추가 PCR amplifications을 수행, 각 시간이 새 필터 섹션을 사용합니다. PCR 젤 purificati 후에 함께 동일한 샘플의 amplicons을 수영장. 정화 16 rDNA의 amplicons 지금 같은 클론 라이브러리 구축 및 시퀀싱과 같은 taxonomic 식별을 허용 분자 분석의 여러 준비가되어 있습니다.
6. 대표 결과 :
대표 결과는 예를 들어 putrescine - 굴욕적인 박테리아의 연구를 사용하여 설명되어 있습니다. 물 샘플은 조지아 해안 사이트에서 수집하여 위에서 설명한 절차에 따라 처리되었습니다. 외과 분석 putrescine 또한 높은 BrdU의 설립 속도 (그림 1)을 나타내는 높은 FITC 형광 강도와 박테리아의 그룹의 발전을 유도하는 것으로 나타났습니다. 이 전지는 높은 BrdU - 정관 전지 (그의)으로 지정되었으며 대부분 putrescine - 굴욕적인 박테리아를 포함하는 것으로 예상했다. HIS는 BrdU의 설립 (LIS)의 낮은 수준의 세포가 포함된 노 또한 컨트롤에서 누락되었습니다. LIS는 주로 추가 putrescine를 사용할 수 없습니다 bacterioplankton를 포함할 것으로 예상했다. 그의 분리 튜브에 정렬하고 멤브레인 필터로 수집했다. 16 rRNA 유전자 amplicons는 필터 PCR을 사용하여 높은 HI 세포에 대한 취득했다.
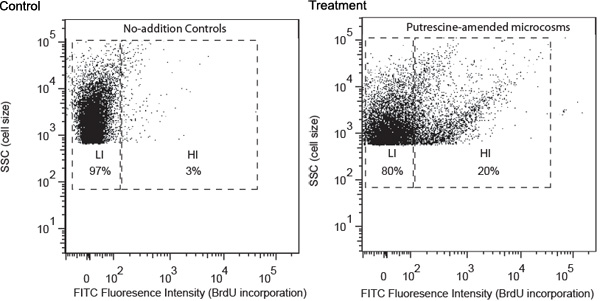
그림 1. 노 또한 제어 및 부화 후 24 H 수집 (여기서 예로 putrescine) 모델 화합물 - 개정 표본의 흐름 cytometric 분석. 세포 분포 분석은 긍정적으로 BrdU의 정관의 수준과 관련이 FITC 라벨 (X 축) (1) 형광 강도에 따라 있었고, (2) 사이드 분산형 (SSC, Y 축)은, 긍정적으로 세포에 관련된 어떤 크기. 게이트 표기법은 BrdU의 설립, (; LI, 낮은 BrdU - 정관 HI, 높은 BrdU - 정관)의 수준에 따라 달라집니다. HI 및 LI 세포의 상대적 비율은 해당 게이트에 표시됩니다.
토론
우리의 접근 커플 BrdU의 설립, 외과 및 16 rDNA 분석 수생 환경에서 개별 DOC 구성 요소를 대사 bacterioplankton의 종 수준의 식별을 허용합니다. BrdU의 설립 분석은 활성 세균에 대한 분석이 가능하기 때문에 휴면 세포를 포함하지 않습니다 신진 대사 활동을 기반으로 박테리아 세포를 표시합니다. 우리의 접근에서 BrdU의 설립은 이후 시각 아르 BrdU의 설립의 다른 수준을 가지고 immunodetected 현장과 박?...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 프로젝트의 자금은 국립 과학 재단 (National Science Foundation)을 부여 OCE1029607 (XM)을하고 MCB0702125 (MAM)을하고 고든과 베티 무어 재단 (MAM)을 제공한했습니다.
자료
| Name | Company | Catalog Number | Comments | |
| 이름 | 유형 | 회사 | 카탈로그 번호 | 댓글 |
| BrdU | 시약 | 시그마 | B5002 - 5G | |
| 라이 소 자임 | 시약 | 시그마 | L6876 - 5G | |
| Proteinase K | 시약 | 시그마 | P2308 - 25MG | |
| 현장 세포 확산 키트, FLUOS에서 | 키트 | 로체 | 11810740001 | 안티 BrdU - FLUOS와 제조 업체가 제안보다 반응마다 부화 버퍼 더 소비합니다. |
| 프레임 시일 배양 챔버 | 자료 | 바이오 래드 | SLF - 1201 | |
| 폴리 카보 네이트 멤브레인 필터 (142 - mm - 직경 1.0 μm의 - 구멍 크기) | 자료 | Millipore | FALP14250 | |
| 폴리 카보 네이트 막 필터 (25 - mm - 직경 0.2 μm의 - 구멍 크기) | 자료 | Millipore | FGLP02500 | |
| illustra PuReTaq 즉시 이동 PCR 비즈 | 키트 | GE 헬스케어 | 27-9559-01 | |
| QIAquick 겔 추출 키트 | 키트 | QIAGEN | 28,704 | |
| 안전 장치 PCR 시스템 | 키트 | EPICENTRE | FS99060 |
참고문헌
- Pernthaler, A., Pernthaler, J., Schattenhofer, M., Amann, R. Identification of DNA-synthesizing bacterial cells in coastal North Sea plankton. Appl. Environ. Microbiol. 68, 5728-5728 (2002).
- Urbach, E., Vergin, K. L., Giovannoni, S. J. Immunochemical detection and isolation of DNA from metabolically active bacteria. Appl. Environ. Microbiol. 65, 1207-12 (1999).
- Mou, X. Z., Hodson, R. E., Moran, M. A. Bacterioplankton assemblages transforming dissolved organic compounds in coastal seawater. Environ. Microbiol. 9, 2025-2025 (2007).
- Hodson, R. E., Dustman, W. A., Garg, R. P., Moran, M. A. In situ PCR for visualization of microscale distribution of specific genes and gene products in prokaryotic communities. Appl. Environ. Microbiol. 61, 4074-4074 (1995).
- Dinjens, W. N. Bromodeoxyuridine (BrdU) immunocytochemistry by exonuclease III (Exo III) digestion. Histochemistry. 98, 199-199 (1992).
- Kirchman, D. L., Yu, L. Y., Fuchs, B. M., Amann, R. Structure of bacterial communities in aquatic systems as revealed by filter PCR. Aquat. Microb. Ecol. 26, 13-13 (2001).
- Delong, E. F., Wickham, G. S., Pace, N. R. Phylogenetic stains: ribosomal RNA-based probes for the identification of single cells. Science. 243, 1360-1360 (1989).
- Artursson, V., Jansson, J. K. Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular mycorrhizal hyphae. Appl. Environ. Microbiol. 69, 6208-6208 (2003).
- Mou, X. Z. Bacterial carbon processing by generalist species in the coastal ocean. Nature. 451, 708-708 (2008).
- Mou, X. Flow-cytometric cell sorting and subsequent molecular analyses for culture-independent identification of bacterioplankton involved in dimethylsulfoniopropionate transformations. Appl. Environ. Microbiol. 71, 1405-1405 (2005).
- Dean, F. B. Comprehensive human genome amplification using multiple displacement amplification. Proc. Natl. Acad. Sci. U.S.A. 99, 5261-5261 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유