Method Article
عن طريق الفم من تحليل بيوفيلم المتوسعون حلقي بواسطة التهجين في الموضع الإسفار ومتحد البؤر المسح الضوئي ليزر مجهرية
In This Article
Summary
نقدم بروتوكولا للتحليل الهيكلية والتركيبية للبيوفيلم الفم الطبيعية من الأجهزة التقويمية مع في الموقع التهجين (FISH) ومتحد البؤر المجهري مسح الليزر (CLSM). تم جمع عينات من الفم بيوفيلم المتوسع حنكي وتجريف الاكريليك الراتنج ، رقائق قبالة سطحها وإحالتهم للتجهيز الجزيئية.
Abstract
اليوم سهلت مبائر المجهري المسح بواسطة أشعة الليزر (CLSM) من غير المتجانسة بيوفيلم الطبيعية مجموعة شاملة من تقنيات التلوين ، واحد منهم يجري في مضان التهجين الموضع (FISH). 1،2 نحن إجراء الدراسة التجريبية التي جمعت عينات من الفم بيوفيلم الثابتة وكانت ملطخة الأجهزة التقويمية (حنكي المتوسع) من الأسماك ، والهدف من ذلك لتقييم منظمة ثلاثية الأبعاد من بيوفيلم الطبيعية وتراكم الترسبات. 3،4 FISH يخلق فرصة لصبغ الخلايا في بيئتها الأصلية بيوفيلم عن طريق استخدام 16S fluorescently المسمى الرنا الريباسي استهداف تحقيقات. 4-7،19 بالمقارنة مع التقنيات البديلة مثل وضع العلامات مناعي ، وهذا هو غير مكلفة ، تقنية وضع العلامات دقيقة ومباشرة التحقيق في مجموعات بكتيرية مختلفة في اتحادات بيوفيلم مختلطة. 18،20 التحقيقات العامة التي كانت تستخدم لربط Eubacteria ( + + EUB338 EUB338II EUB338III ؛ الآخرة EUBmix) ، 8-10 Firmicutes (LGC354 AC ؛ استخدمت LGCmix الآخرة) ، وBacteroidetes 9،10 (Bac303) 11 بالإضافة إلى ذلك ، تحقيقات محددة وملزمة لالعقدية الطافرة (MUT590) 12،13 وPorphyromonas اللثوية (POGI) 13،14. . صلابة المتطرفة من المواد السطحية المعنية (الفولاذ المقاوم للصدأ وراتنج الأكريليك) أجبرتنا على إيجاد طرق جديدة لإعداد بيوفيلم. كما لا يمكن أن تكون هذه المواد السطحية قطع بسهولة مع مبضع بردي ، واستكشاف أساليب مختلفة للحصول على عينات بيوفيلم الشفوي سليمة. وقدم معظم عملي من هذين النهجين في هذا البلاغ. وكشط رقائق صغيرة من راتنج الأكريليك بيوفيلم الحاملة قبالة مع مشرط معقم ، مع الحرص على عدم الاضرار هيكل بيوفيلم. تم استخدام ملقط لجمع بيوفيلم من الأسطح الفولاذية. جمعها مرة واحدة ، كانت ثابتة العينات ووضعها مباشرة على الشرائح polysine الزجاج المطلي. وقد أجريت هذه الأسماك مباشرة على الشرائح مع تحقيقات مentioned أعلاه. تم الجمع بين مختلف بروتوكولات السمكية وتعديلها لإنشاء البروتوكول الجديد الذي كان من السهل التعامل معها. 5،10،14،15 وبعد ذلك تم تحليل العينات بواسطة الليزر المجهري متحد البؤر المسح الضوئي. ويمكن معروفة تكوينات 3،4،16،17 يمكن تصور ، بما فطر على غرار تشكيلات ومجموعات من البكتيريا المكورة التي عمت القنوات. بالإضافة إلى ذلك ، تم تحليل تركيبة هذه الهياكل البكتيرية بيوفيلم وخلق الصور النمطية 2D و 3D.
Protocol
1. جمع العينات
- إزالة ثابت حنكي المتوسع بعد 4 أشهر من الخدمة داخل الفم. استخدام نظام NOLA حقل جاف لعزل الأجهزة قبل إزالتها (الشكلان 1 و 2).
- استخدام كماشة تعقيمها ، والقفازات والصواني لإزالة التلوث المتوسع دون إضافة (الشكلان 3 و 4).
- الكائنات مخزن في قارورة 120 مل في Sarstedt -20 درجة مئوية. اتخاذها لمختبر على الجليد والعملية في غضون 24 ساعة.
2. بيوفيلم التثبيت
- كشط بيوفيلم رقائق مع مشرط معقم ، أو جمع القطع مع ملقط معقم.
- إضافة الثلج الباردة حل PFA 4 ٪ حتى يتم تغطية العينة جيدا.
- الخليط في احتضان +4 درجة مئوية (لا تجميد) لمدة 3 إلى 12 ساعة. قد أوقات أطول التثبيت أو التثبيت ارتفاع درجات الحرارة تجعل المغلفات خلية من خلايا سالبة الجرام أقل نفاذا إلى تحقيقات قليل النوكليوتيد.
- إزالة PFA حل ويغسل مع PBS 1X الجليد الباردة. كرر هذه الخطوة لص 2-3 مراتemove PFA المتبقية.
- Resuspend العينة في المجلد 1. الجليد الباردة 1X PBS وإضافة المجلد 1. الجليد الباردة 96 ٪ (V / V) الايثانول.
- تخزين العينة عند -20 درجة مئوية. ويمكن تخزين عينات ثابتة وفقا لهذا البروتوكول لعدة شهور وسنوات.
3. جفاف عينات ثابتة
- 5-30 من تنطبق ميكرولتر - PFA الثابتة المادية عينة لشريحة المجهر.
- جفاف في 46 درجة مئوية لمدة 15 دقيقة أو في درجة حرارة الغرفة لفترة أطول. ذوبان الجليد في الليزوزيم وformamide و.
- إضافة 250 ميكرولتر من الليزوزيم (1mg/ml) في درجة حرارة الغرفة لمدة 10 دقيقة ، مما يسهل اختراق للتحقيقات في الخلايا عن طريق تدمير جزئي لجدران الخلايا.
- تراجع الانزلاق الى 50 ٪ ، 80 ٪ و 96 ٪ (V / V) لمدة 3 دقائق الايثانول لكل منهما. سيكون تأثير التجفيف للتركيز الايثانول سلسلة تفكيك أغشية الخلايا.
- الجافة الشرائح في 46 درجة مئوية لمدة 10 دقيقة.
4. التهجين في الموقع
- 1 مل من إعدادالطازجة العازلة التهجين (انظر الجدول رقم 1 لتركيزات). Formamide التركيزات المستخدمة في هذه الدراسة : 10 ٪ (EUBmix) ، 20 ٪ (Bac303 ، POGI ، MUT590) أو 45 ٪ (LGCmix).
- ذوبان الجليد الحلول قليل النوكليوتيد التحقيق. يجب أن تبقى على إذابة الجليد تحقيقات ومحمية من الضوء.
- إضافة 2 ميكرولتر من كل المسبار إلى 200 ميكرولتر من التهجين العازلة ، تخلط جيدا وتطبيق المزيج على عينة المجففة على شريحة المجهر.
- وضع قطعة من المناديل الورقية في طبق بيتري مربع ، وتصب العازلة التهجين المتبقية على الورق الأنسجة.
- المكان فورا الشريحة أفقيا في صحن وأغلق الطبق. احتضان في فرن تبلغ 46 درجة مئوية لمدة 1-5 ساعات (90 دقيقة لن يكون كافيا في معظم الحالات). وظائف طبق كغرفة منع تبخر الرطوبة حل التهجين من الشريحة. على وجه الخصوص ، يمكن أن تسبب تبخر formamide غير محددة ملزمة لتحقيق هدف غير الخلايا.
- تحضير 50 مل من غسل العازلة (انظر الجدول رقم 2 للبغية دراسته واقرارهntrations). إعداد العازلة الغسيل في أنبوب 50 مل وسخن إلى 48 درجة مئوية في حمام مائي. يتم تنفيذ الخطوة الغسيل في 48 درجة مئوية.
- إزالة الطبق مع شريحة من الفرن التهجين. تغسل فورا قبالة العازلة التهجين مع صغر حجم العازلة الغسيل قبل تحسنت ، ونقل الشريحة في المخزن المؤقت الغسيل المتبقية.
- مكان الأنبوب الذي يحتوي على الشريحة العازلة الغسيل وظهر في حمام مائي واحتضان عند درجة 48 لمدة 10-15 دقيقة.
- إزالة شريحة من الأنبوب وتراجع في الجليد الباردة O 2 DDH لمدة 2-3 ثانية للقضاء على بقايا العازلة الغسيل.
- الهواء الجاف الشريحة بأسرع وقت ممكن (من المستحسن استخدام الهواء المضغوط). وسوف تجف بسرعة التحقيق لحد التفكك.
- ويمكن تخزين الشرائح المجففة في الظلام على -20 درجة مئوية لعدة أسابيع دون خسارة كبيرة في التحقيق ، إشارة الممنوحة مضان.
5. المجهري
- بعد السمكية ، والغسيل ، وAPPLذ قطرتين من إغلاق antifadent إلى أقاصي اليسار واليمين من شريحة (يجب أن تكون درجة حرارة شرائح مجمدة إلى درجة حرارة الغرفة قبل هذه الخطوة).
- وضع غطاء على رأس المجهر زلة وانتظر حتى antifadent انتشرت فوق الشريحة بأكملها. علما بأن كمية زائدة من antifadent يمكن طمس صورة المجهر.
- مراقبة العينات تحت المجهر ليزر متحد البؤر المسح مجهزة مرشحات مناسبة أو الليزر. استخدمنا TCS لايكا وحدة (HCX PL APO/63x ؛ NA 1.2). ويمكن تحليل البيانات مع برامج مثل IMARIS أو أميرة.
- ويمكن تخزين الشرائح المضمنة في antifadent في +4 درجة مئوية (لا تجميد) لمدة تصل إلى 7 أيام قبل لجنة التحقيق ، تمنح مضان يبدأ في الانخفاض. بدلا من ذلك ، يمكن إزالة antifadent مع DDH 2 O ، ويمكن تخزين الشرائح المجففة في -20 درجة مئوية لفترة ممتدة من الزمن.
6. ممثل النتائج :
كشط قبالة بيوفيلم الأجهزة التقويمية الثابتة (الشكل 5) غلة رقائق مناسب (الشكل 6) التي يمكن المهجنة مباشرة على شرائح الزجاج المطلي لالمجهري. بهذه الطريقة ، يمكن تحديد مجموعات مختلفة من البكتيريا orobiome في بيئتها الطبيعية الثلاثية الأبعاد التي الرنا الريباسي علامات الجرثومي مع تحقيقات محددة مختلفة المسمى (الشكلان 7 و 8). في الشكل 7 ، والملون مع بيوفيلم EUBmix (أخضر ، كل البكتيريا) وLGCmix (أصفر ، Firmicutes). Firmicutes تظهر باللون الأخضر ، كما أنها كانت ملطخة باللون الأصفر والأزرق. في الشكل 8 ، والملون مع بيوفيلم EUBmix (أحمر ، كل البكتيريا) ، Bac303 (أزرق ، Bacteroidetes) وPOGI (أصفر ، Porphyromonas اللثوية). يظهر Porphyromonas اللثوية باللون الأبيض المصفر ، وجميع التحقيقات three ربط الحمض النووي وتداخل نتائج من الألوان في إشارة بيضاء. ويمكن أيضا الاختلافات الشكلية بين مجموعات من البكتيريا اسمه (الشكلان 9 و 10). وتظهر كتل كبيرة من البكتيريا المكورة في الشكل 9 ، حيث تم تنفيذ تلطيخ مع EUBmix (الأخضر ، وكلها على درجة البكالوريوسcteria). وأشكال مختلفة من البكتيريا عن طريق الفم في تصور الشكل 10 ، حيث يمكن تمييز البكتيريا المكورة والخيطية التي تلطيخ مع EUBmix (الحمراء). أيضا ، يمكن معالجة نموذجية فطر يشبه هيكل بيوفيلم عبر النمذجة 3D البيانات CLSM (الأرقام 11 و 12) اضغط هنا لمشاهدة فيلم من النمذجة 3D.
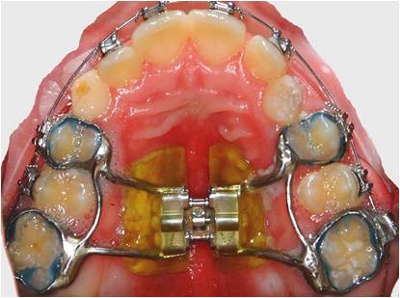
الشكل 1. الثابتة حنكي المتوسع في الموقع.
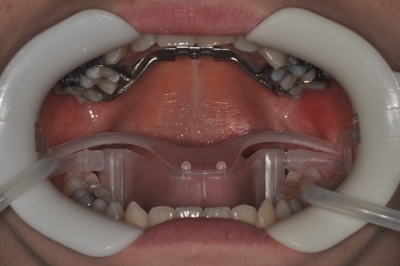
الشكل 2. نولا نظام حقل جاف.

الشكل 3. المعقم كماشة ، والقفازات والدرج.
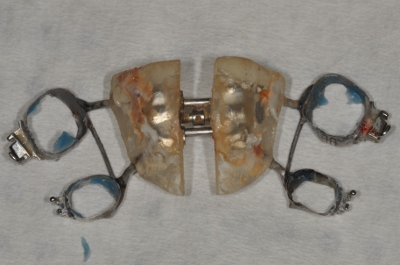
الشكل 4. إزالتها المتوسع.

الشكل 5. القشط قبالة بيوفيلم مع مشرط معقم.

رقائق الراتنج الرقم 6. المهجنة مباشرة على شرائح الزجاج المطلي.

صورة الشكل 7 CLSM : التفريق بين مجموعة محددة البكتيرية. 2D تراكب من بيانات 3D CLSM المكدس. ملون مع بيوفيلم EUBmix (أخضر ، كل البكتيريا) وLGCmix (أصفر ، Firmicutes).

الشكل 8 صورة CLSM : التفريق بين مجموعة محددة البكتيرية. 2D تراكب من بيانات 3D CLSM المكدس. ملون مع بيوفيلم EUBmix (أحمر ، كل البكتيريا) ، Bac303 (أزرق ، Bacteroidetes) وPOGI (أصفر ، Porphyromonas اللثوية).
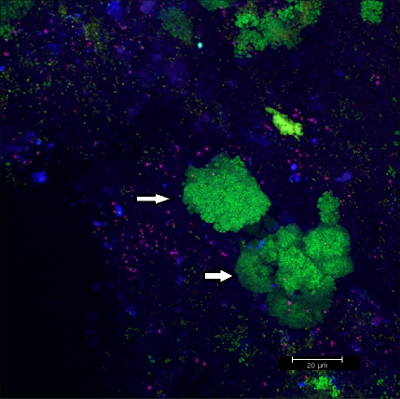
الرقم 9 صورة CLSM : تمايز morphologies محددة. 2D تراكب من بيانات 3D CLSM المكدس. ملون مع بيوفيلم EUBmix (أخضر ، كل البكتيريا). مجموعات كبيرة من البكتيريا المكورة (الأسهم).
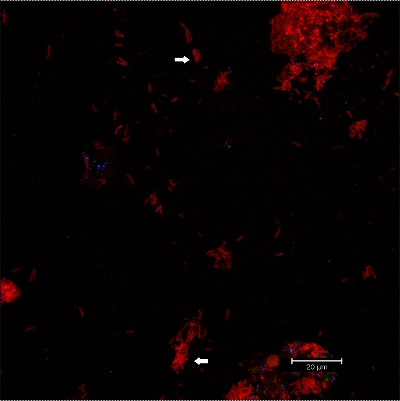
صور CLSM الرقم 10 : تمايز morphologies محددة. 2D تراكب من بيانات 3D CLSM المكدس. ملون مع بيوفيلم EUBmix (أحمر ، كل البكتيريا). ويمكن تمييز مكوراتي (السهم أدناه) ، والبكتيريا الخيطية (السهم أعلاه).
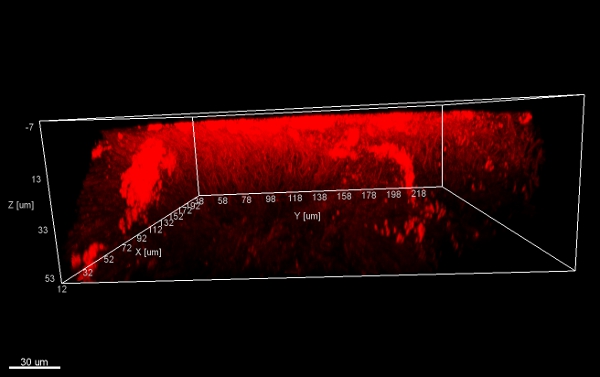
الرقم 11. هيكل الفطر ، وجهات النظر 3D من أسفل. أكوام من رقائق بيوفيلم (كشط قبالة السطح من الأجهزة التقويمية) ، ملطخة EUBmix واإلجراءاتssed مع IMARIS (CLSM الصورة).

الرقم 12. هيكل الفطر ، 3D جانبيا. أكوام من رقائق بيوفيلم (كشط قبالة السطح من الأجهزة التقويمية) المجهزة مع IMARIS (CLSM الصورة).
| العازلة التهجين (200 ميكرولتر) | |||
| Formamide تركيز | 10 ٪ | 20 ٪ | 45 ٪ |
| 5 M كلوريد الصوديوم | 36 | 36 | 36 |
| M - 1 تريس حمض الهيدروكلوريك | 4 | 4 | 4 |
| 2 ٪ SDS | 1 | 1 | 1 |
| FA | 20 | 40 | 90 |
| DDH 2 O | 138 | 118 | 68 |
| أي نوع من الأسماك التحقيق | 2 | 2 | 2 |
الجدول 1. مقومات العازلة التهجين (التركيزات في ميكرولتر).
| غسل العازلة (50 مل) | |||
| Formamide تركيز | 10 ٪ | 20 ٪ | 45 ٪ |
| 5 M كلوريد الصوديوم | 4500 | 2150 | 300 |
| M - 1 تريس حمض الهيدروكلوريك | 1000 | 1000 | 1000 |
| 0.5 M EDTA | 0 | 500 | 500 |
| DDH 2 O | 44 500 | 46 350 | 48 200 |
الجدول 2. مقومات العازلة الغسيل (التركيزات في ميكرولتر).
فيلم 1. اضغط هنا لمشاهدة الفيلم.
Discussion
وهنا وصف البروتوكول هو نهج عملي للغاية لتلطيخ الأغشية الحيوية التي تم جمعها من المواد الصلبة. أخذ العينات والتهجين هي الخطوات الأكثر أهمية. خلال المعاينة ، يجب الحرص على جمع شرائح من سمك كافية لضمان أن الهيكل بيوفيلم لا تزال سليمة. خلال التهجين ، فمن الضروري لتجنب التقلبات المفرطة في درجة الحرارة ، وبالتالي تجنب غير محددة وملزمة ، أو فقدان ملزمة ، من تحقيقات fluorescently المسمى. FISH هذا البروتوكول هو أسلوب أنيق وصمة عار على بيوفيلم متجانسة طبيعية مباشرة على الشرائح الزجاجية دون تعطيل تكوينها. ويمكن على الفور الشرائح تستعمل لالمجهري دون الحاجة لنقل العينة مرة أخرى. بهذه الطريقة ، يتم تحقيق تحسن على تلطيخ في أنابيب بالقوة أقل القص يجري تطبيقها على بيوفيلم. يمكن تحضير شرائح> 50 ميكرون سميكة والتحقيق في هذا الشكل.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل فون النظافة من جامعة غراتس الطبية. وقدم جميع الموضوعات علم موافقتهم. تم الحصول على الموافقة المؤسسية لبروتوكول الدراسة من جامعة غراتس الطبية.
Materials
| Name | Company | Catalog Number | Comments |
| Oligonucleotides | Target organism | Fluorochrome | |
|---|---|---|---|
| EUB338 - 338III | Eubacteria | Cy3 | |
| LGC354 A-C | Firmicutes | FITC | |
| Bac303 | Bacteroidetes | Cy5 | |
| Mut590 | Streptococcus mutans | FITC | |
| POGI | Porphyromonas gingivalis | FITC |
Table 3. Oligonucleotides (refer to probeBase13 for details).
| Component | Company | Comments |
|---|---|---|
| 4% paraformaldehyde | 4% solution in PBS | |
| 1 x PBS | 3 x solution prepared | |
| ddH2O | Millipore | |
| Ethanol (100%) | Merck | |
| Lysozyme | Roth | 100 mg/ml stock solution |
| Formamide | Roth | 99.5% solution |
| 5 M NaCl | Roth | |
| 1 M Tris-HCl | Roth | |
| 2% SDS | Roth | |
| FISH probes (oligonucleotides) | Invitrogen, Sigma | |
| ProLong Gold antifadent | Invitrogen | |
| Nail polish | ||
| Equipment | ||
| Incubator | Thermo Scientific | |
| Water bath | IKA Tez | |
| 50 ml tubes | Sarstedt | |
| Polysine-coated slides | Thermo Scientific |
Table 4. Materials and equipment.
References
- Sunde, P. T. Fluorescence in situ hybridization (FISH) for direct visualization of bacteria in periapical lesions of asymptomatic root-filled teeth. Microbiology. 149, 1095-1102 (2003).
- Sussman, M., Loya, Y., Fine, M., Rosenberg, E. The marine fireworm Hermodice carunculata is a winter reservoir and spring-summer vector for the coral-bleaching pathogen Vibrio shiloi. Environ. Microbiol. 5, 250-255 (2003).
- Kolenbrander, P. E. Communication among oral bacteria. Microbiol. Mol. Biol. Rev. 66, 486-505 (2002).
- Zijnge, V. Oral biofilm architecture on natural teeth. PLoS One. 5, e9321-e9321 (2010).
- Thurnheer, T., Gmur, R., Giertsen, E., Guggenheim, B. Automated fluorescent in situ hybridization for the specific detection and quantification of oral streptococci in dental plaque. J. Microbiol. Methods. 44, 39-47 (2001).
- Hojo, K., Nagaoka, S., Ohshima, T., Maeda, N. Bacterial interactions in dental biofilm development. J. Dent. Res. 88, 982-990 (2009).
- Jung, D. J. Visualization of initial bacterial colonization on dentine and enamel in situ. J. Microbiol. Methods. 81, 166-174 (2010).
- Al-Ahmad, A. Bacterial colonization of enamel in situ investigated using fluorescence in situ hybridization. J. Med. Microbiol. 58, 1359-1366 (2009).
- Bryers, J. D. Medical biofilms. Biotechnol. Bioeng. 100, 1-18 (2008).
- Cardinale, M., Vieira de Castro, J., Muller, H., Berg, G., Grube, M. In situ analysis of the bacterial community associated with the reindeer lichen Cladonia arbuscula reveals predominance of Alphaproteobacteria. FEMS Microbiol. Ecol. 66, 63-71 (2008).
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Chin, M. Y., Busscher, H. J., Evans, R., Noar, J., Pratten, J. Early biofilm formation and the effects of antimicrobial agents on orthodontic bonding materials in a parallel plate flow chamber. Eur. J. Orthod. 28, 1-7 (2006).
- Loy, A., Maixner, F., Wagner, M., Horn, M. probeBase--an online resource for rRNA-targeted oligonucleotide probes: new features 2007. Nucleic. Acids. Res. 35, (2007).
- Diaz, P. I. Molecular characterization of subject-specific oral microflora during initial colonization of enamel. Appl. Environ. Microbiol. 72, 2837-2848 (2006).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J. Oral Sci. 115, 459-467 (2007).
- Kolenbrander, P. E. Bacterial interactions and successions during plaque development. Periodontology. 42, 47-79 (2000).
- Kolenbrander, P. E., Palmer, R. J., Periasamy, S., Jakubovics, N. S. Oral multispecies biofilm development and the key role of cell-cell distance. Nat. Rev. Microbiol. 8, 471-480 (2010).
- Chalmers, N. I. Use of quantum dot luminescent probes to achieve single-cell resolution of human oral bacteria in biofilms. Appl. Environ. Microbiol. 73, 630-636 (2007).
- Wecke, J. A novel technique for monitoring the development of bacterial biofilms in human periodontal pockets. FEMS Microbiol. Lett. 191, 95-101 (2000).
- Moter, A., Gobel, U. B. Fluorescence in situ hybridization (FISH) for direct visualization of microorganisms. J. Microbiol. Methods. 41, 85-112 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved