Method Article
Analyse orale de biofilm palatine Expandeurs par fluorescence hybridation in situ et la microscopie confocale à balayage laser
Dans cet article
Résumé
Nous présentons un protocole pour l'analyse structurelle et compositionnelle du biofilm naturel d'administration orale à partir d'appareils orthodontiques In situ (FISH) et microscopie confocale à balayage laser (CLSM). Échantillons de biofilms oraux ont été recueillies auprès de expandeurs palatine, le grattage de résine acrylique s'écaille leur surface et leur référence pour le traitement moléculaire.
Résumé
Microscopie confocale à balayage laser (CLSM) du biofilm hétérogènes naturel est aujourd'hui facilitée par une gamme complète de techniques de coloration, l'un d'eux étant l'hybridation fluorescente in situ (FISH) 1,2. Nous avons réalisé une étude pilote dans lequel des échantillons de biofilms oraux recueillis auprès fixes appareils orthodontiques (palatine expandeurs) ont été colorées par FISH, l'objectif étant d'évaluer l'organisation tridimensionnelle des biofilms naturels et l'accumulation de plaque. 3,4 POISSONS crée une opportunité pour colorer des cellules dans leur environnement natif du biofilm par l'utilisation de 16S marqués par fluorescence ARNr de ciblage des sondes. 4-7,19 Comparé à d'autres techniques comme l'étiquetage d'immunofluorescence, c'est un peu coûteuse, la technique de l'étiquetage précis et simple d'enquêter sur différents groupes bactériens dans des consortiums mixtes biofilm. 18,20 sondes ont été utilisées général qui se lient aux eubactéries ( EUB338 + + EUB338II EUB338III, ci-après EUBmix), 8-10 Firmicutes (LGC354 AC;. LGCmix ci), 9,10 et Bacteroidetes (Bac303) 11 De plus, les sondes de liaison spécifique à Streptococcus mutans (MUT590), 12,13 et Porphyromonas gingivalis (POGI) 13,14 ont été utilisés . L'extrême dureté des matériaux de surface impliquées (en acier inoxydable et résine acrylique) nous a obligés à trouver de nouvelles façons de préparer le biofilm. Comme ces matériaux de surface ne pouvait pas être facilement coupé avec un cryotome, diverses méthodes d'échantillonnage ont été explorées afin d'obtenir intacte biofilm orale. Le plus pratique de ces approches est présenté dans cette communication. De petits éclats de la résine acrylique biofilm porteurs ont été grattées avec un scalpel stérile, en prenant soin de ne pas endommager la structure du biofilm. Pince ont été utilisés pour recueillir des biofilms sur les surfaces en acier. Une fois collectés, les échantillons ont été fixés et placés directement sur polysine lames de verre recouvertes. FISH a été effectuée directement sur ces diapositives avec les sondes mentionnées ci-dessus. Protocoles divers poissons ont été combinés et modifiés pour créer un nouveau protocole qui a été facile à manipuler. 5,10,14,15 Par la suite, les échantillons ont été analysés par microscopie confocale à balayage laser. Bien connu des configurations 3,4,16,17 pourrait être visualisées, y compris les champignons de style formations et des grappes de bactéries coccoïdes envahi par des canaux. En outre, la composition bactérienne de ces structures typiques du biofilm ont été analysés et des images 2D et 3D créés.
Protocole
1. Prélèvement
- Retirer fixes palatine expandeurs après 4 mois de service intra-buccale. Utilisation du système NOLA terrain sec pour isoler les appareils avant leur suppression (figures 1 et 2).
- Utilisez des pinces stérilisées, des gants et des plateaux pour enlever expandeurs sans ajouter la contamination (figures 3 et 4).
- Objets magasin dans des flacons de 120 ml Sarstedt à -20 ° C. Prenez au laboratoire sur de la glace et le processus dans les 24 heures.
2. Fixation du biofilm
- Grattez flocons biofilm avec un scalpel stérile, ou de recueillir des pièces avec des pinces stériles.
- Ajouter une solution glacée de 4% jusqu'en PFA échantillon est bien couvert.
- Incuber le mélange à 4 ° C (ne pas congeler) pour 3 à 12 heures. Temps de fixation plus longues ou à des températures supérieures de fixation peut rendre les enveloppes cellulaires des bactéries gram-négatives cellules moins perméable aux sondes oligonucléotidiques.
- Retirer solution de PFA et laver avec glacée PBS 1X. Répétez cette étape 2-3 fois à reMove résiduelle PFA.
- Resuspendre l'échantillon en 1 vol. glacée PBS 1X et ajouter 1 vol. glacée 96% (v / v) d'éthanol.
- Conserver l'échantillon à -20 ° C. Les échantillons fixés en fonction de ce protocole peuvent être stockés pendant plusieurs mois à plusieurs années.
3. La déshydratation des échantillons fixés
- Appliquer ul 50-30 du PFA matériel fixé l'échantillon sur une lame de microscope.
- Sec à 46 ° C pendant environ 15 min ou à température ambiante pendant plus longtemps. Décongeler le lysozyme et la formamide.
- Ajouter 250 pi de lysozyme (1mg/ml) à température ambiante pendant 10 min, facilitant ainsi la pénétration des sondes dans les cellules par une destruction partielle des parois cellulaires.
- Trempez glisser dans 50%, 80% et 96% (v / v) d'éthanol pendant 3 min chacune. L'effet diurétique de la série concentration d'éthanol va se désintégrer les membranes cellulaires.
- Sécher les lames à 46 ° C pendant 10 min.
4. Hybridation in situ
- Préparer 1 ml detampon d'hybridation douce (voir le tableau 1 pour les concentrations). Le formamide concentrations utilisées dans cette étude: 10% (EUBmix), 20% (Bac303, POGI, MUT590) ou 45% (LGCmix).
- Décongeler les solutions de sondes oligonucléotidiques. Sondes décongelés doivent être conservés sur la glace et protégé de la lumière.
- Ajouter 2 ul de chaque sonde à 200 pi de tampon d'hybridation, bien mélanger et appliquer le mélange à l'échantillon déshydraté sur une lame de microscope.
- Placez un morceau de papier de soie dans un plat carré de Pétri et versez le tampon d'hybridation reste sur le papier de soie.
- Immédiatement placer la lame à l'horizontale dans le plat et fermer le plat. Incuber dans un four à 46 ° C pendant 1-5 heures (90 min suffiront dans la plupart des cas). Les fonctions plat comme une chambre de l'humidité empêchant l'évaporation de la solution d'hybridation de la diapositive. En particulier, l'évaporation de formamide peut provoquer non spécifiques se liant à la sonde cellules non cibles.
- Préparer 50 ml de tampon de lavage (voir Tableau 2 pour concentrations). Préparer le tampon de lavage dans un tube de 50 ml et préchauffer à 48 ° C dans un bain d'eau. L'étape de lavage est effectué à 48 ° C.
- Retirer le plat avec la lame du four d'hybridation. Laver immédiatement le tampon d'hybridation avec un petit volume de tampon de lavage pré-chauffé, et le transfert de la glisser dans le tampon de lavage restant.
- Placer le tube contenant le tampon de lavage et de la glisser dans le bain d'eau et incuber à 48 ° C pendant 10-15 min.
- Retirer glisser dans le tube et plonger dans la glace froide O ddH 2 pour 2-3 secondes pour éliminer les résidus de tampon de lavage.
- Sécher à l'air de la diapositive aussi rapidement que possible (l'utilisation d'air comprimé est recommandé). Séchage rapide permettra de réduire la sonde de dissociation.
- Diapositives séchées peuvent être stockés dans l'obscurité à -20 ° C pendant plusieurs semaines sans perte significative de sonde conféré signal de fluorescence.
5. Microscopie
- Après FISH et le lavage, apply deux gouttes de près antifadent les extrémités gauche et droite d'une diapositive (tranches congelé doit être réchauffé à la température ambiante avant cette étape).
- Placez un couvercle sur le dessus de glissement de microscope et attendre que le antifadent s'est répandu sur la lame entière. Notez qu'une quantité excessive de antifadent peuvent brouiller l'image du microscope.
- Observez les échantillons sous un microscope confocal à balayage laser équipé de filtres appropriés ou des lasers. Nous avons utilisé un Leica TCS unité (HCX PL APO/63x; NA 1.2). Les données peuvent être analysées avec un logiciel tel que Imaris ou Amira.
- Diapositives intégrées dans antifadent peuvent être conservés à 4 ° C (ne pas congeler) jusqu'à 7 jours avant la sonde de fluorescence conféré commence à diminuer. Alternativement, le antifadent peuvent être enlevés avec ddH 2 O, et les lames séchées peuvent être conservées à -20 ° C pour une période de temps prolongée.
6. Les résultats représentatifs:
Grattage biofilm hors appareils orthodontiques fixes (Figure 5) de flocons de rendements adéquats (figure 6) qui peuvent être hybridées directement sur lames de verre recouvertes de microscopie. De cette façon, les différents groupes de bactéries orobiome peuvent être identifiés dans leur milieu naturel en trois dimensions environnement en marquage ARNr bactériens étiquetés différemment des sondes spécifiques (figures 7 et 8). Dans la figure 7, le biofilm était tachée de EUBmix (vert, toutes les bactéries) et LGCmix (jaune, Firmicutes). Firmicutes apparaissent en vert, comme ils ont été colorés avec du jaune et du bleu. Dans la figure 8, le biofilm était tachée de EUBmix (rouge, toutes les bactéries), Bac303 (bleu, Bacteroidetes) et POGI (jaune, Porphyromonas gingivalis). Porphyromonas gingivalis est montré dans blanc jaunâtre, comme tous les trois sondes se lient à l'ADN et le chevauchement des résultats de couleurs dans un signal blanc. Les différences morphologiques entre les groupes de bactéries peuvent également être identifiés (figures 9 et 10). Grands groupes de bactéries coccoïdes sont présentés dans la figure 9, où la coloration a été réalisée avec EUBmix (vert, tous les bacteria). Différentes formes de bactéries orales ont été visualisées dans la figure 10, où les bactéries coccoïdes et filamenteuses peuvent être distingués par coloration avec EUBmix (rouge). En outre, un type de champignon comme la structure du biofilm peut être traitée via la modélisation 3D des données CLSM (figures 11 et 12) Cliquez ici pour regarder un film de la modélisation 3D.
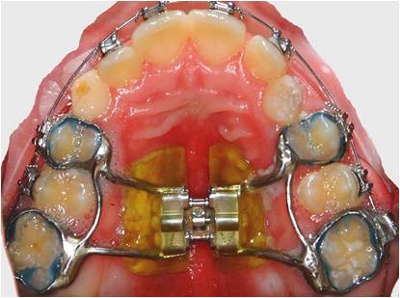
Figure 1. Correction d'extension palatine in situ.
Figure 2. Système de Nola terrain sec.

Figure 3. Stérilisé pinces, des gants et un plateau.
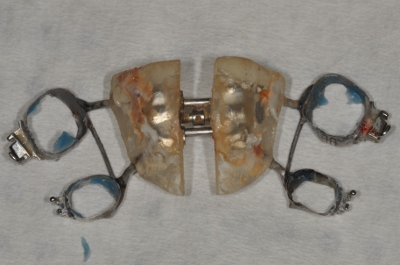
Figure 4. Suppression d'extension.

Figure 5. Grattage biofilm avec un scalpel stérile.

Flocons de résine figure 6. Directement hybridés sur des lames de verre enduit.

Figure 7 Image CLSM:. Différenciation d'un groupe spécifique de bactéries. Superposition de données 2D 3D pile CLSM. Biofilm colorés avec EUBmix (vert, toutes les bactéries) et LGCmix (jaune, Firmicutes).

Figure 8 images CLSM:. Différenciation d'un groupe spécifique de bactéries. Superposition de données 2D 3D pile CLSM. Tachés biofilm avec EUBmix (rouge, toutes les bactéries), Bac303 (bleu, Bacteroidetes) et POGI (jaune, Porphyromonas gingivalis).
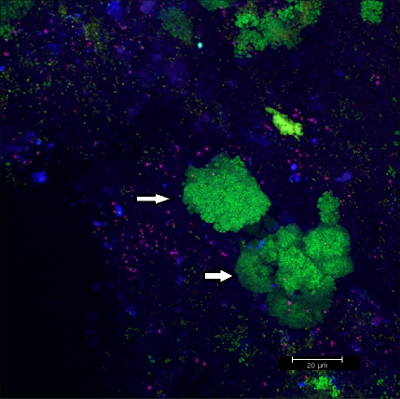
Figure 9 images CLSM:. Différenciation des morphologies particulières. Superposition de données 2D 3D pile CLSM. Biofilm colorés avec EUBmix (vert, toutes les bactéries). Grands groupes de bactéries coccoïdes (flèches).
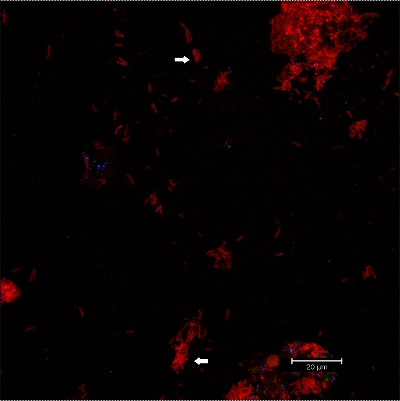
Images CLSM Figure 10:. Différenciation des morphologies particulières. Superposition de données 2D 3D pile CLSM. Biofilm colorés avec EUBmix (rouge, toutes les bactéries). Coccoïde (flèche bas) et des bactéries filamenteuses (flèche haut) peuvent être distingués.
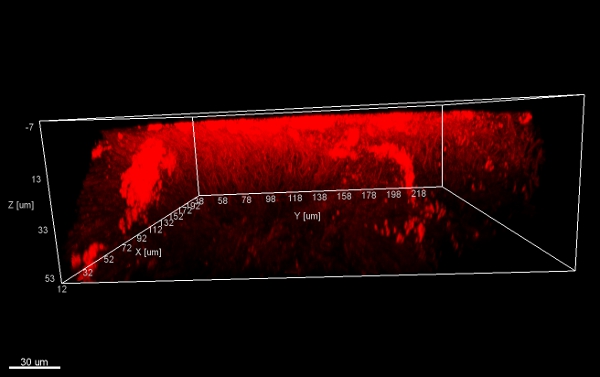
Structure de champignons Figure 11., Vues 3D à partir de ci-dessous. Piles de flocons de biofilm (gratté la surface d'un appareil orthodontique), colorées avec EUBmix et procéduresSSED avec Imaris (image CLSM).

Structure de champignons Figure 12., Vue de côté 3D. Piles de flocons de biofilm (gratté la surface d'un appareil orthodontique) traitées avec Imaris (image CLSM).
| Tampon d'hybridation (200 pi) | |||
| Concentration de formamide | 10% | 20% | 45% |
| 5 M de NaCl | 36 | 36 | 36 |
| 1 M Tris-HCl | 4 | 4 | 4 |
| 2% de SDS | 1 | 1 | 1 |
| FA | 20 | 40 | 90 |
| DdH 2 O | 138 | 118 | 68 |
| Toute sonde FISH | 2 | 2 | 2 |
Constituants Tableau 1. De tampon d'hybridation (concentrations en pl).
| Tampon de lavage (50 ml) | |||
| Concentration de formamide | 10% | 20% | 45% |
| 5 M de NaCl | 4500 | 2150 | 300 |
| 1 M Tris-HCl | 1000 | 1000 | 1000 |
| EDTA 0,5 M | 0 | 500 | 500 |
| ddH 2 O | 44 500 | 46 350 | 48 200 |
Constituants Tableau 2. De tampon de lavage (concentrations en pl).
Vidéo 1. Cliquez ici pour regarder le film.
Discussion
Le présent protocole décrit une approche très réaliste de biofilms coloration recueillies à partir de matériaux durs. L'échantillonnage et l'hybridation sont les étapes les plus critiques. Lors de l'échantillonnage, il faut prendre soin que les tranches d'épaisseur suffisante, sont collectées afin de s'assurer que la structure du biofilm reste intacte. Pendant l'hybridation, il est essentiel d'éviter les fluctuations excessives de température, évitant ainsi la liaison non spécifique, ou de perte de liaison, des sondes marquées par fluorescence. Ce protocole FISH est une méthode élégante pour colorer normale biofilm hétérogènes directement sur les lames de verre, sans perturber sa composition. Les diapositives peuvent être immédiatement utilisés pour la microscopie, sans besoin de déplacer l'échantillon une fois de plus. De cette façon, une amélioration par rapport à coloration dans des tubes est réalisé par la force de cisaillement moins d'être appliquée à la biofilm. Tranches> 50 um d'épaisseur peut être préparé et étudié dans ce mode.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par le Fonds d'hygiène de l'Université médicale de Graz. Tous les sujets ont donné leur consentement éclairé. L'approbation institutionnelle du protocole d'étude a été obtenue de l'Université médicale de Graz.
matériels
| Name | Company | Catalog Number | Comments |
| Oligonucleotides | Target organism | Fluorochrome | |
|---|---|---|---|
| EUB338 - 338III | Eubacteria | Cy3 | |
| LGC354 A-C | Firmicutes | FITC | |
| Bac303 | Bacteroidetes | Cy5 | |
| Mut590 | Streptococcus mutans | FITC | |
| POGI | Porphyromonas gingivalis | FITC |
Table 3. Oligonucleotides (refer to probeBase13 for details).
| Component | Company | Comments |
|---|---|---|
| 4% paraformaldehyde | 4% solution in PBS | |
| 1 x PBS | 3 x solution prepared | |
| ddH2O | Millipore | |
| Ethanol (100%) | Merck | |
| Lysozyme | Roth | 100 mg/ml stock solution |
| Formamide | Roth | 99.5% solution |
| 5 M NaCl | Roth | |
| 1 M Tris-HCl | Roth | |
| 2% SDS | Roth | |
| FISH probes (oligonucleotides) | Invitrogen, Sigma | |
| ProLong Gold antifadent | Invitrogen | |
| Nail polish | ||
| Equipment | ||
| Incubator | Thermo Scientific | |
| Water bath | IKA Tez | |
| 50 ml tubes | Sarstedt | |
| Polysine-coated slides | Thermo Scientific |
Table 4. Materials and equipment.
Références
- Sunde, P. T. Fluorescence in situ hybridization (FISH) for direct visualization of bacteria in periapical lesions of asymptomatic root-filled teeth. Microbiology. 149, 1095-1102 (2003).
- Sussman, M., Loya, Y., Fine, M., Rosenberg, E. The marine fireworm Hermodice carunculata is a winter reservoir and spring-summer vector for the coral-bleaching pathogen Vibrio shiloi. Environ. Microbiol. 5, 250-255 (2003).
- Kolenbrander, P. E. Communication among oral bacteria. Microbiol. Mol. Biol. Rev. 66, 486-505 (2002).
- Zijnge, V. Oral biofilm architecture on natural teeth. PLoS One. 5, e9321-e9321 (2010).
- Thurnheer, T., Gmur, R., Giertsen, E., Guggenheim, B. Automated fluorescent in situ hybridization for the specific detection and quantification of oral streptococci in dental plaque. J. Microbiol. Methods. 44, 39-47 (2001).
- Hojo, K., Nagaoka, S., Ohshima, T., Maeda, N. Bacterial interactions in dental biofilm development. J. Dent. Res. 88, 982-990 (2009).
- Jung, D. J. Visualization of initial bacterial colonization on dentine and enamel in situ. J. Microbiol. Methods. 81, 166-174 (2010).
- Al-Ahmad, A. Bacterial colonization of enamel in situ investigated using fluorescence in situ hybridization. J. Med. Microbiol. 58, 1359-1366 (2009).
- Bryers, J. D. Medical biofilms. Biotechnol. Bioeng. 100, 1-18 (2008).
- Cardinale, M., Vieira de Castro, J., Muller, H., Berg, G., Grube, M. In situ analysis of the bacterial community associated with the reindeer lichen Cladonia arbuscula reveals predominance of Alphaproteobacteria. FEMS Microbiol. Ecol. 66, 63-71 (2008).
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Chin, M. Y., Busscher, H. J., Evans, R., Noar, J., Pratten, J. Early biofilm formation and the effects of antimicrobial agents on orthodontic bonding materials in a parallel plate flow chamber. Eur. J. Orthod. 28, 1-7 (2006).
- Loy, A., Maixner, F., Wagner, M., Horn, M. probeBase--an online resource for rRNA-targeted oligonucleotide probes: new features 2007. Nucleic. Acids. Res. 35, (2007).
- Diaz, P. I. Molecular characterization of subject-specific oral microflora during initial colonization of enamel. Appl. Environ. Microbiol. 72, 2837-2848 (2006).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J. Oral Sci. 115, 459-467 (2007).
- Kolenbrander, P. E. Bacterial interactions and successions during plaque development. Periodontology. 42, 47-79 (2000).
- Kolenbrander, P. E., Palmer, R. J., Periasamy, S., Jakubovics, N. S. Oral multispecies biofilm development and the key role of cell-cell distance. Nat. Rev. Microbiol. 8, 471-480 (2010).
- Chalmers, N. I. Use of quantum dot luminescent probes to achieve single-cell resolution of human oral bacteria in biofilms. Appl. Environ. Microbiol. 73, 630-636 (2007).
- Wecke, J. A novel technique for monitoring the development of bacterial biofilms in human periodontal pockets. FEMS Microbiol. Lett. 191, 95-101 (2000).
- Moter, A., Gobel, U. B. Fluorescence in situ hybridization (FISH) for direct visualization of microorganisms. J. Microbiol. Methods. 41, 85-112 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon