Method Article
Устные Анализ биопленки небных расширителей по флуоресценции in-situ гибридизация и конфокальной лазерной сканирующей микроскопии
В этой статье
Резюме
Мы представляем протокол для структурного и композиционного анализа природных устной биопленки из ортодонтических аппаратов с На месте Гибридизации (FISH) и конфокальной микроскопии лазерного сканирования (CLSM). Устные образцы биопленки были собраны из небных расширителей, очищая акриловой смолы отслаивается их поверхности и направлять их для молекулярных обработки.
Аннотация
Конфокальной микроскопии лазерного сканирования (CLSM) природных гетерогенных биопленки сегодня способствует широкий спектр окраски техники, одним из которых является флуоресценции в гибридизация (FISH). 1,2 Мы провели пилотное исследование, в котором образцы устного биопленки собранной со стационарных ортодонтические аппараты (небные расширители) окрашивали по FISH, цель которого оценить трехмерной организации природного биопленки и налета накопления. 3,4 FISH создает возможность для окрашивания клеток в их родной среде биопленки с помощью флуоресцентно меченного 16S рРНК-таргетинга зондов. 4-7,19 По сравнению с альтернативными методами, как иммунофлуоресцентного маркировке, это недорогой, точный и простой маркировки техники для исследования различных групп бактерий в смешанных консорциумов биопленки. 18,20 генеральный зондами, которые связываются с эубактерий ( EUB338 + + EUB338II EUB338III; далее EUBmix), 8-10 Firmicutes (LGC354 переменного тока;. LGCmix далее), 9,10 и Bacteroidetes (Bac303) 11 Кроме того, специфические зонды связывания с стрептококками (MUT590) 12,13 и Porphyromonas gingivalis (POGI) 13,14 использовались . Чрезвычайной твердости поверхности материалов, используемых (из нержавеющей стали и акриловые смолы) заставила нас искать новые способы подготовки биопленки. Как эти поверхностные материалы не могут быть легко резать замораживающий микротом, различные методы отбора проб были исследованы получить нетронутыми устной биопленки. Наиболее действенным из этих подходов, представленные в этой связи. Малый хлопья биопленки несущих акриловые смолы соскабливают стерильным скальпелем, стараясь не повредить структуру биопленки. Пинцет были использованы для сбора биопленки из стальных поверхностей. Собранные образцы были установлены и помещены непосредственно на polysine покрытием слайды стекло. FISH была выполнена непосредственно на эти слайды с м зондовentioned выше. Различные протоколы FISH были объединены и изменены, чтобы создать новый протокол, который был прост в обращении. 5,10,14,15 Впоследствии образцы были проанализированы с помощью конфокальной микроскопии лазерного сканирования. Известный конфигураций 3,4,16,17 могут быть визуализированы, в том числе грибов стиле формирований и групп кокковые бактерии проникнут каналов. Кроме того, бактериальный состав этих типичных структур биопленки, были проанализированы и 2D-и 3D-изображений, созданных.
протокол
1. Для забора проб
- Удалить фиксированной небных расширителей после 4 месяцев внутриротовой службе. Используйте NOLA Сухой Система поле, чтобы изолировать техники, прежде чем снимать их (рис. 1 и 2).
- Используйте стерилизованные щипцы, перчатки и лотки для удаления расширители, не добавляя загрязнения (рисунки 3 и 4).
- Хранить объекты в Sarstedt 120 мл флаконах при температуре -20 ° C. Возьмите в лабораторию на льду и процесс в течение 24 часов.
2. Биопленка фиксации
- Соскоблите биопленки хлопья с стерильный скальпель, или собирать куски стерильных щипцов.
- Добавить ледяной 4% PFA решением, пока образец хорошо освещены.
- Выдержите смесь при температуре +4 ° C (не замораживать) от 3 до 12 часов. Более фиксации раза или более высоких температурах фиксации может сделать ячейку конверты грамм-негативные клетки менее проницаемой для олигонуклеотидных зондов.
- Удалить PFA раствора и промыть ледяной 1X PBS. Повторите этот шаг 2-3 раза до галить остаточной PFA.
- Ресуспендируют образца в 1 об. ледяной 1X PBS и добавьте 1 об. ледяной 96% (объем / объем) этанола.
- Храните образцы при -20 ° C. Образцы установленное в соответствии с этим протоколом можно хранить в течение нескольких месяцев до нескольких лет.
3. Обезвоживание основных образцов
- Применить 5-30 мкл PFA-фиксированный образец материала, чтобы стекло микроскопа.
- Сухой при 46 ° С в течение около 15 минут или при комнатной температуре дольше. Оттепель лизоцима и формамида.
- Добавить 250 мкл лизоцима (1mg/ml) при комнатной температуре в течение 10 мин, тем самым способствуя проникновению зонда в клетки частичным разрушением клеточных стенок.
- Dip слайдов на 50%, 80% и 96% (объем / объем) этанола в течение 3 минут каждый. Обезвоживания влияние ряд концентрации этанола распадаются клеточных мембран.
- Сухой слайды при 46 ° С в течение 10 мин.
4. В-гибридизация
- Подготовка 1 млсвежего буфера гибридизации (см. таблицу 1 для концентрации). Формамид концентрациях, используемых в данном исследовании: 10% (EUBmix), 20% (Bac303, POGI, MUT590) или 45% (LGCmix).
- Оттепель олигонуклеотидных решения зонда. Талая зонды должны находиться на льду и защищенном от света месте.
- Добавьте 2 мкл каждого датчика до 200 мкл буфера гибридизации, хорошо перемешайте и нанесите смесь обезвоженных образцов на предметном стекле микроскопа.
- Место папиросную бумагу в квадратных чашке Петри и залить оставшейся гибридизации буфер на папиросную бумагу.
- Сразу же место слайд горизонтально на блюдо и закрыть блюдо. Выдержите в духовке при температуре 46 ° С в течение 1-5 часов (90 минут будет достаточно в большинстве случаев). Блюдо функции влаги камеры предотвращения испарения гибридизации решение от слайда. В частности, испарение формамида могут вызвать неспецифические зонд привязки к нецелевых клеток.
- Подготовка 50 мл промывочного буфера (см. Таблицу 2 для concentrations). Подготовка промывочного буфера в 50 мл трубки и подогреть до 48 ° С на водяной бане. Мытье шаг выполняется на 48 ° C.
- Снимите посуду с слайд из гибридизации духовке. Немедленно смыть гибридизации буфер с небольшим объемом подогретого моющего буфера, и передача скользить в оставшиеся промывочным раствором.
- Место трубку с моющим буфером и слайд обратно в ванну воды и инкубируют при 48 ° С в течение 10-15 мин.
- Удалить слайд из трубки и окунуться в ледяную DDH 2 O в течение 2-3 секунд для устранения остаточного промывочного буфера.
- Высушите слайд как можно быстрее (использование сжатого воздуха рекомендуется). Быстрое высыхание снизит зонд диссоциации.
- Сушеные слайды можно хранить в темном месте при температуре -20 ° С в течение нескольких недель без значительной потери пробного присвоено сигнала флуоресценции.
5. Микроскопия
- После рыбы и мытья, заявлу две капли antifadent близко к левой и правой части слайда (замороженные ломтики должны быть прогреты до комнатной температуры до этого шага).
- Место микроскопом покровное стекло сверху и ждать, пока antifadent распространился по всему слайду. Обратите внимание, что чрезмерное количество может привести к размыванию antifadent микроскопе изображение.
- Соблюдайте образцов конфокальной лазерной сканирующей микроскопии оснащена подходящими фильтрами или лазеров. Мы использовали Leica TCS единицы (HCX PL APO/63x; Н. А. 1.2). Данные могут быть проанализированы с помощью программного обеспечения, таких как IMARIS или AMIRA.
- Слайды встроенные в antifadent можно хранить при температуре +4 ° C (не замораживать) на срок до 7 дней до пробного присвоено флуоресценции начинает снижаться. Кроме того, antifadent могут быть удалены с DDH 2 O, а также сушеные слайды могут храниться при температуре -20 ° С в течение длительного периода времени.
6. Представитель Результаты:
Зачистка биопленки от фиксированных ортодонтических аппаратов (Рисунок 5) дает подходящую хлопья (рис. 6), которые могут быть гибридизированных непосредственно на покрытие слайды стекло для микроскопии. Таким образом, различные группы orobiome бактерии могут быть определены в их естественной трехмерной среде путем пометки бактериальной РНК с по-разному меченых зондов (рис. 7 и 8). На рисунке 7, биопленки окрашивали EUBmix (зеленый, все бактерии) и LGCmix (желтый, Firmicutes). Firmicutes отображаться зеленым цветом, так как они были окрашены желтым и синим цветом. На рисунке 8, биопленки окрашивали EUBmix (красный, все бактерии), Bac303 (синий, Bacteroidetes) и POGI (желтый, Porphyromonas gingivalis). Porphyromonas gingivalis показан в желтовато-белый, так как все три зонда связываются с его ДНК и перекрытия цветов результатов в белый сигнал. Морфологические различия между группами бактерий также могут быть определены (рис. 9 и 10). Большие скопления кокковые бактерий показано на рисунке 9, где окрашивание проводили с EUBmix (зеленый, все баcteria). Разные формы бактерии полости рта были визуализированы на рисунке 10, где кокковые и нитевидные бактерии можно отличить по окраске EUBmix (красный). Кроме того, типичная грибовидные структуры биопленки могут быть обработаны с помощью 3D-моделирования CLSM данных (рис. 11 и 12) Нажмите здесь, чтобы посмотреть фильм в 3D моделировании.
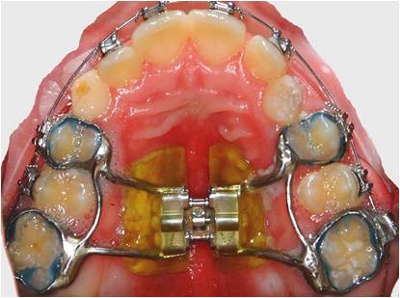
Рисунок 1. Исправлен небный расширитель на месте.
Рисунок 2. Нола Сухой системы возбуждения.

Рисунок 3. Стерилизованные щипцы, перчатки и лоток.
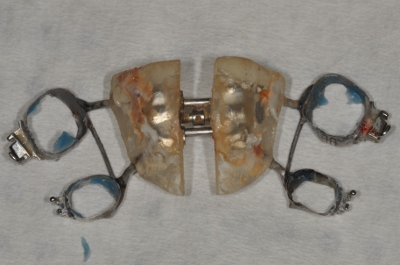
Рисунок 4. Удалены расширителя.

Рисунок 5. Соскабливания биопленки стерильным скальпелем.

Хлопья Рисунок 6. Смола непосредственно гибридизированных на покрытие стеклянные пластинки.

Рисунок 7 CLSM изображения. Дифференциацию конкретных бактериальных группы. 2D наложения данных 3D CLSM стека. Биопленка окрашивали EUBmix (зеленый, все бактерии) и LGCmix (желтый, Firmicutes).

Рисунок 8 CLSM изображения. Дифференциацию конкретных бактериальных группы. 2D наложения данных 3D CLSM стека. Биопленка окрашивали EUBmix (красный, все бактерии), Bac303 (синий, Bacteroidetes) и POGI (желтый, Porphyromonas gingivalis).
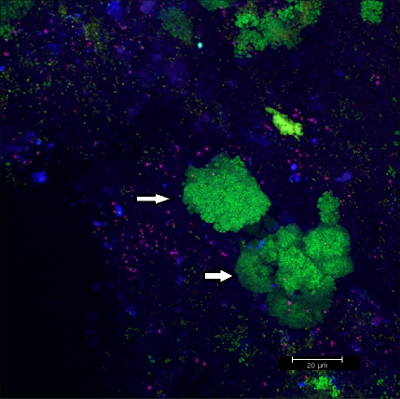
Рисунок 9 CLSM изображения. Дифференциацию конкретных морфологии. 2D наложения данных 3D CLSM стека. Биопленка окрашивали EUBmix (зеленый, все бактерии). Большие скопления кокковые бактерий (стрелки).
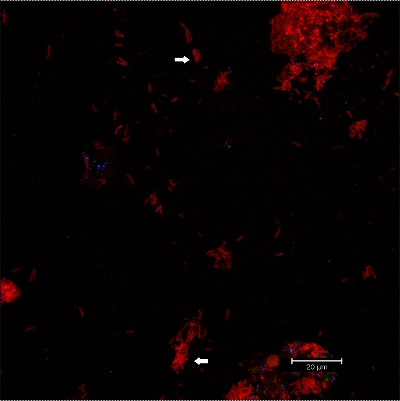
. Рисунок 10 CLSM изображений: дифференциация конкретных морфологии. 2D наложения данных 3D CLSM стека. Биопленка окрашивали EUBmix (красный, все бактерии). Кокковые (стрелка ниже) и нитчатых бактерий (стрелка выше) могут быть выделены.
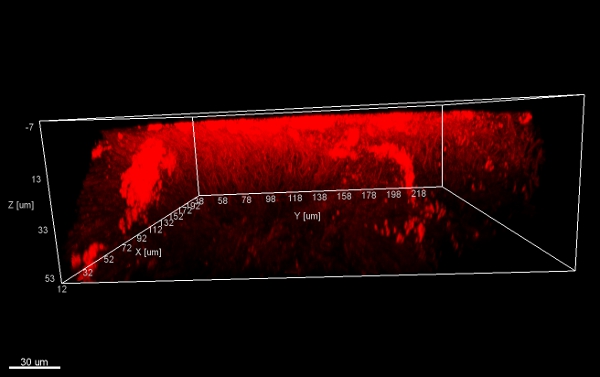
Рисунок 11. Грибы структуры, 3D виды снизу. Стеки биопленки хлопья (соскрести поверхности ортодонтического аппарата), окрашивали EUBmix и процедурssed с IMARIS (CLSM изображения).

Рисунок 12. Грибы структуры, 3D вид сбоку. Стеки биопленки хлопья (соскрести поверхности ортодонтического аппарата) обрабатывается IMARIS (CLSM изображения).
| Гибридизация буфере (200 мкл) | |||
| Формамид концентрации | 10% | 20% | 45% |
| 5 М NaCl | 36 | 36 | 36 |
| 1 М Трис-HCl | 4 | 4 | 4 |
| 2% SDS | 1 | 1 | 1 |
| FA | 20 | 40 | 90 |
| DDH 2 O | 138 | 118 | 68 |
| Любая рыба, зонд | 2 | 2 | 2 |
Таблица 1. Составляющие гибридизации буфере (концентрации в мкл).
| Стиральная буфера (50 мл) | |||
| Формамид концентрации | 10% | 20% | 45% |
| 5 М NaCl | 4500 | 2150 | 300 |
| 1 М Трис-HCl | 1000 | 1000 | 1000 |
| 0,5 М ЭДТА | 0 | 500 | 500 |
| DDH 2 O | 44 500 | 46 350 | 48 200 |
Таблица 2. Составляющие промывочным буфером (концентрации в мкл).
Обсуждение
Описанный здесь протокол является весьма реальный подход к образованию пятен биопленки собраны из жестких материалов. Отбор проб и гибридизации наиболее важных шагов. Во время отбора проб, необходимо позаботиться, что ломтики достаточной толщины собираются для того, чтобы биопленки структура остается без изменений. Во время гибридизации, важно, чтобы избежать чрезмерных колебаний температуры, что позволяет избежать неспецифического связывания, или потеря обязательными, из флуоресцентно меченых зондов. Эта рыба протокол изящный метод, чтобы окрасить нормальным гетерогенных биопленки прямо на стеклах, не нарушая его состав. Слайды могут быть немедленно использованы для микроскопии без необходимости перехода образца в очередной раз. Таким образом, улучшение по сравнению с окрашиванием в трубах достигается за счет меньшей поперечной силы, применяемых к биопленки. Ломтики> 50 мкм могут быть подготовлены и исследованы в такой форме.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана гигиены Фонды медицинского университета Граца. Все испытуемые дали свое информированное согласие. Институциональные одобрения протокола исследования была получена из Медицинского университета Граца.
Материалы
| Name | Company | Catalog Number | Comments |
| Oligonucleotides | Target organism | Fluorochrome | |
|---|---|---|---|
| EUB338 - 338III | Eubacteria | Cy3 | |
| LGC354 A-C | Firmicutes | FITC | |
| Bac303 | Bacteroidetes | Cy5 | |
| Mut590 | Streptococcus mutans | FITC | |
| POGI | Porphyromonas gingivalis | FITC |
Table 3. Oligonucleotides (refer to probeBase13 for details).
| Component | Company | Comments |
|---|---|---|
| 4% paraformaldehyde | 4% solution in PBS | |
| 1 x PBS | 3 x solution prepared | |
| ddH2O | Millipore | |
| Ethanol (100%) | Merck | |
| Lysozyme | Roth | 100 mg/ml stock solution |
| Formamide | Roth | 99.5% solution |
| 5 M NaCl | Roth | |
| 1 M Tris-HCl | Roth | |
| 2% SDS | Roth | |
| FISH probes (oligonucleotides) | Invitrogen, Sigma | |
| ProLong Gold antifadent | Invitrogen | |
| Nail polish | ||
| Equipment | ||
| Incubator | Thermo Scientific | |
| Water bath | IKA Tez | |
| 50 ml tubes | Sarstedt | |
| Polysine-coated slides | Thermo Scientific |
Table 4. Materials and equipment.
Ссылки
- Sunde, P. T. Fluorescence in situ hybridization (FISH) for direct visualization of bacteria in periapical lesions of asymptomatic root-filled teeth. Microbiology. 149, 1095-1102 (2003).
- Sussman, M., Loya, Y., Fine, M., Rosenberg, E. The marine fireworm Hermodice carunculata is a winter reservoir and spring-summer vector for the coral-bleaching pathogen Vibrio shiloi. Environ. Microbiol. 5, 250-255 (2003).
- Kolenbrander, P. E. Communication among oral bacteria. Microbiol. Mol. Biol. Rev. 66, 486-505 (2002).
- Zijnge, V. Oral biofilm architecture on natural teeth. PLoS One. 5, e9321-e9321 (2010).
- Thurnheer, T., Gmur, R., Giertsen, E., Guggenheim, B. Automated fluorescent in situ hybridization for the specific detection and quantification of oral streptococci in dental plaque. J. Microbiol. Methods. 44, 39-47 (2001).
- Hojo, K., Nagaoka, S., Ohshima, T., Maeda, N. Bacterial interactions in dental biofilm development. J. Dent. Res. 88, 982-990 (2009).
- Jung, D. J. Visualization of initial bacterial colonization on dentine and enamel in situ. J. Microbiol. Methods. 81, 166-174 (2010).
- Al-Ahmad, A. Bacterial colonization of enamel in situ investigated using fluorescence in situ hybridization. J. Med. Microbiol. 58, 1359-1366 (2009).
- Bryers, J. D. Medical biofilms. Biotechnol. Bioeng. 100, 1-18 (2008).
- Cardinale, M., Vieira de Castro, J., Muller, H., Berg, G., Grube, M. In situ analysis of the bacterial community associated with the reindeer lichen Cladonia arbuscula reveals predominance of Alphaproteobacteria. FEMS Microbiol. Ecol. 66, 63-71 (2008).
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Chin, M. Y., Busscher, H. J., Evans, R., Noar, J., Pratten, J. Early biofilm formation and the effects of antimicrobial agents on orthodontic bonding materials in a parallel plate flow chamber. Eur. J. Orthod. 28, 1-7 (2006).
- Loy, A., Maixner, F., Wagner, M., Horn, M. probeBase--an online resource for rRNA-targeted oligonucleotide probes: new features 2007. Nucleic. Acids. Res. 35, (2007).
- Diaz, P. I. Molecular characterization of subject-specific oral microflora during initial colonization of enamel. Appl. Environ. Microbiol. 72, 2837-2848 (2006).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J. Oral Sci. 115, 459-467 (2007).
- Kolenbrander, P. E. Bacterial interactions and successions during plaque development. Periodontology. 42, 47-79 (2000).
- Kolenbrander, P. E., Palmer, R. J., Periasamy, S., Jakubovics, N. S. Oral multispecies biofilm development and the key role of cell-cell distance. Nat. Rev. Microbiol. 8, 471-480 (2010).
- Chalmers, N. I. Use of quantum dot luminescent probes to achieve single-cell resolution of human oral bacteria in biofilms. Appl. Environ. Microbiol. 73, 630-636 (2007).
- Wecke, J. A novel technique for monitoring the development of bacterial biofilms in human periodontal pockets. FEMS Microbiol. Lett. 191, 95-101 (2000).
- Moter, A., Gobel, U. B. Fluorescence in situ hybridization (FISH) for direct visualization of microorganisms. J. Microbiol. Methods. 41, 85-112 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены