Method Article
Análise de biofilme oral de Palatal Expansores por fluorescência de hibridização in situ e microscopia confocal a laser Scanning
Neste Artigo
Resumo
Nós apresentamos um protocolo para análise estrutural e de composição do biofilme oral natural de aparelhos ortodônticos com In situ Hybridization (FISH) e microscopia de varredura confocal a laser (CLSM). Amostras de biofilme oral foram coletados de expansores palatinos, raspagem de resina acrílica flocos de fora de sua superfície e encaminhá-los para o processamento molecular.
Resumo
Microscopia de varredura confocal a laser (CLSM) do biofilme heterogênea natural é hoje facilitado por uma vasta gama de técnicas de coloração, sendo um deles hibridização fluorescente in situ (FISH). 1,2 Realizamos um estudo piloto em que as amostras coletadas de biofilme oral fixa aparelhos ortodônticos (palatal expansores) foram corados por FISH, com o objectivo de avaliar a organização tridimensional de biofilme naturais e acúmulo de placa. 3,4 FISH cria uma oportunidade para corar as células em seu ambiente nativo do biofilme com o uso de 16S fluorescente etiquetado rRNA de metas de sondas. 4-7,19 Em comparação com técnicas alternativas como a rotulagem de imunofluorescência, este é um barato, a técnica de rotulagem rigorosa e direto para investigar diferentes grupos de bactérias em biofilme consórcios mistos. 18,20 sondas foram usadas Geral que se ligam a Eubacteria ( EUB338 + + EUB338II EUB338III; seguir EUBmix), 8-10 Firmicutes (LGC354 AC;. LGCmix seguir), 9,10 e Bacteroidetes (Bac303) 11 Além disso, as sondas de ligação específico para Streptococcus mutans (MUT590) 12,13 e Porphyromonas gingivalis (IGP) foram usados 13,14 . A extrema dureza dos materiais de superfície envolvidos (aço inoxidável e resina acrílica) obrigaram-nos a encontrar novas maneiras de preparar o biofilme. Como estes materiais de superfície não poderia ser facilmente cortado com uma cryotome, vários métodos de amostragem foram exploradas para obter biofilme oral intacta. O mais viável dessas abordagens é apresentada na presente comunicação. Pequenos flocos da resina biofilme de transporte de acrílico foram raspados com um bisturi estéril, tomando cuidado para não danificar a estrutura do biofilme. Fórceps foram usados para coletar biofilme das superfícies de aço. Uma vez coletadas, as amostras foram fixadas e colocado diretamente sobre lâminas de vidro revestidas polysine. FISH foi realizada diretamente sobre esses slides com as sondas mentioned acima. FISH vários protocolos foram combinados e modificados para criar um novo protocolo que foi fácil de manusear. 5,10,14,15 Posteriormente as amostras foram analisadas por microscopia confocal de varredura a laser. Bem conhecidos 3,4,16,17 configurações podem ser visualizados, inclusive cogumelo estilo de formações e aglomerados de bactérias cocóide permeado por canais. Além disso, a composição bacteriana do biofilme típico dessas estruturas foram analisados e imagens 2D e 3D criado.
Protocolo
1. Coleta de amostras
- Remover fixa palatal expansores após 4 meses de serviço intra-oral. Use NOLA Sistema de campo seco para isolar os aparelhos antes de removê-los (Figuras 1 e 2).
- Use um alicate esterilizado, luvas e bandejas para remover expansores sem adição de contaminação (Figuras 3 e 4).
- Armazenar objetos em Sarstedt 120 ml frascos a -20 ° C. Leve para o laboratório em gelo e processo no prazo de 24 horas.
2. Fixação de biofilme
- Raspe biofilme flocos com um bisturi estéril, ou coletar peças com pinças esterilizadas.
- Adicionar gelada 4% solução de PFA até amostra é bem cobertos.
- Incubar a mistura a +4 ° C (não congelar) durante 3 a 12 horas. Vezes maior fixação ou temperaturas mais altas de fixação pode tornar a célula de envelopes gram-negativas células menos permeável a sondas de oligonucleotídeo.
- Remoção da solução de PFA e lave com gelado 1X PBS. Repita este passo 2-3 vezes ao remove PFA residual.
- Ressuspender a amostra em 1 vol. gelada 1X PBS e adicionar 1 vol. gelada-96% (v / v) de etanol.
- Conservar a amostra a -20 ° C. Amostras fixadas de acordo com este protocolo pode ser armazenado por vários meses a anos.
3. Desidratação das amostras fixas
- Aplicar mL 50-30 de PFA fixa material de amostra para uma lâmina de microscópio.
- Seco a 46 ° C por cerca de 15 min ou em temperatura ambiente por mais tempo. Descongele a lisozima ea formamida.
- Adicionar 250 mL de lisozima (1mg/ml) em temperatura ambiente por 10 min, facilitando assim a penetração das sondas nas células por destruição parcial das paredes celulares.
- Dip slides em 50%, 80% e 96% (v / v) de etanol por 3 min cada. O efeito desidratante da série concentração de etanol irão se desintegrar as membranas celulares.
- Secar as lâminas a 46 ° C por 10 min.
4. Hibridização in situ
- Prepare 1 ml detampão de hibridação fresco (ver Tabela 1 para as concentrações). Formamida concentrações utilizadas neste estudo: 10% (EUBmix), 20% (Bac303, IGP, MUT590) ou 45% (LGCmix).
- Descongele as soluções sonda de oligonucleotídeos. Sondas descongelados devem ser mantidos em gelo e protegido da luz.
- Adicionar 2 mL de cada sonda a 200 mL de tampão de hibridação, misture bem e aplique a mistura para a amostra desidratada em uma lâmina de microscópio.
- Coloque um pedaço de papel de tecido em uma placa de Petri quadrados e despeje o tampão de hibridação restantes para o papel de seda.
- Colocar imediatamente a lâmina horizontalmente no prato e fechar o prato. Incubar em estufa a 46 ° C por 1-5 horas (90 min será suficiente na maioria dos casos). As funções prato como uma câmara de umidade evitando a evaporação da solução de hibridização do slide. Em particular, a evaporação de formamida pode causar não-específica sonda ligação a células não-alvo.
- Prepare 50 ml de tampão de lavagem (ver Tabela 2 para concentrations). Prepare a solução de lavagem em um tubo de 50 ml e pré-aquecimento a 48 ° C em banho-maria. A etapa de lavagem é realizada a 48 ° C.
- Retire o prato com a lâmina do forno de hibridização. Lave imediatamente o tampão de hibridação com um pequeno volume de pré-aquecido tampão de lavagem, e transferir o deslizar para dentro do tampão de lavagem restante.
- Colocar o tubo contendo a solução de lavagem eo slide volta para o banho de água e incubar a 48 ° C por 10-15 min.
- Remover slide do tubo e mergulhar gelada DDH 2 O por 2-3 segundos para eliminar a tampão de lavagem residual.
- De ar seco a lâmina o mais rápido possível (o uso do ar comprimido é recomendado). Secagem rápida vai reduzir sonda dissociação.
- Slides secas podem ser armazenadas no escuro a -20 ° C por várias semanas sem perda significativa de sonda-conferidos sinal de fluorescência.
5. Microscopia
- Depois de FISH e lavagem, apply duas gotas de perto antifadent para as extremidades esquerda e direita de um slide (fatias congelado deve ser aquecido à temperatura ambiente antes de esta etapa).
- Coloque uma tampa microscópio escorregar em cima e espere até que o antifadent se espalhou por todo o slide. Note-se que uma quantidade excessiva de antifadent podem borrar a imagem de microscópio.
- Observe as amostras sob um microscópio confocal de varredura a laser equipado com filtros adequados ou lasers. Nós usamos uma Leica TCS unidade (HCX PL APO/63x; NA 1.2). Os dados podem ser analisados com software, tais como IMARIS ou AMIRA.
- Slides embutidos em antifadent podem ser armazenados a +4 ° C (não congelar) por até 7 dias antes da sonda de fluorescência conferidos começa a declinar. Alternativamente, o antifadent pode ser removido com DDH 2 O, e as lâminas secas podem ser armazenadas a -20 ° C por um período prolongado de tempo.
6. Resultados representativos:
Raspagem biofilme off aparelhos ortodônticos fixos (Figura 5) produz flocos adequado (Figura 6) que pode ser hibridizado diretamente sobre lâminas de vidro revestidas de microscopia. Desta forma, diferentes grupos de bactérias orobiome podem ser identificadas no seu ambiente tridimensional natural por rRNA marcação bacteriana com diferentes sondas marcadas específicas (Figuras 7 e 8). Na Figura 7, o biofilme foi corado com EUBmix (verde, todas as bactérias) e LGCmix (amarelo, Firmicutes). Firmicutes aparecem em verde, como eles foram coradas com amarelo e azul. Na Figura 8, o biofilme foi corado com EUBmix (vermelho, todas as bactérias), Bac303 (azul, Bacteroidetes) e IGP (amarelo, Porphyromonas gingivalis). Porphyromonas gingivalis é mostrado em branco amarelado, como todos os três sondas se ligam ao seu DNA e da sobreposição de cores resulta em um sinal branco. Diferenças morfológicas entre os grupos de bactérias também podem ser identificados (Figuras 9 e 10). Grandes aglomerados de bactérias cocóide são mostrados na Figura 9, onde a coloração foi realizada com EUBmix (verde, todos os bacteria). Formas diferentes de bactérias orais foram visualizados na Figura 10, onde as bactérias filamentosas cocóide e podem ser distinguidos pela coloração com EUBmix (vermelho). Além disso, uma estrutura em forma de cogumelo típico do biofilme pode ser processado através de modelagem em 3D dos dados CLSM (figuras 11 e 12) Clique aqui para assistir a um filme da modelagem 3D.
Figura 1. Fixed expansor palatal in situ.
Figura 2. Nola Sistema de campo seco.

Figura 3. Esterilizado alicates, luvas e bandeja.
Figura 4. Removido expansor.

Figura 5. Scraping off biofilme com um bisturi estéril.

Flocos de resina Figura 6. Diretamente hibridizado em lâminas de vidro revestido.

Figura 7 imagem CLSM:. Diferenciação de um grupo específico de bactérias. Sobreposição de dados 2D em 3D CLSM pilha. Biofilme corado com EUBmix (verde, todas as bactérias) e LGCmix (amarelo, Firmicutes).

Figura 8 imagem CLSM:. Diferenciação de um grupo específico de bactérias. Sobreposição de dados 2D em 3D CLSM pilha. Manchada com biofilme EUBmix (vermelho, todas as bactérias), Bac303 (azul, Bacteroidetes) e IGP (amarelo, Porphyromonas gingivalis).
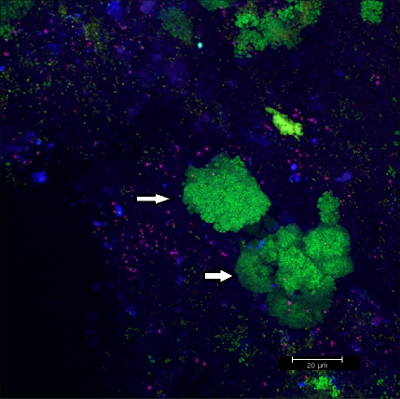
Figura 9 imagem CLSM:. Diferenciação de morfologias específicas. Sobreposição de dados 2D em 3D CLSM pilha. Biofilme corado com EUBmix (verde, todas as bactérias). Grandes aglomerados de bactérias cocóide (setas).
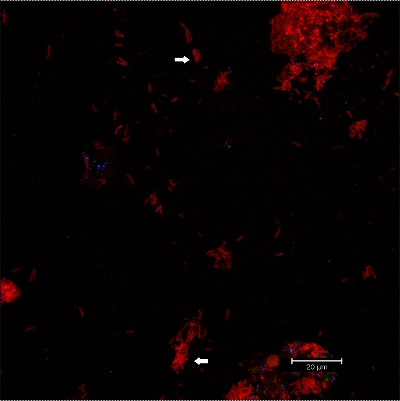
. Figura 10 imagens CLSM: diferenciação de morfologias específicas. Sobreposição de dados 2D em 3D CLSM pilha. Biofilme corado com EUBmix (vermelho, todas as bactérias). Cocóide (seta abaixo) e bactérias filamentosas (seta acima) podem ser distinguidas.
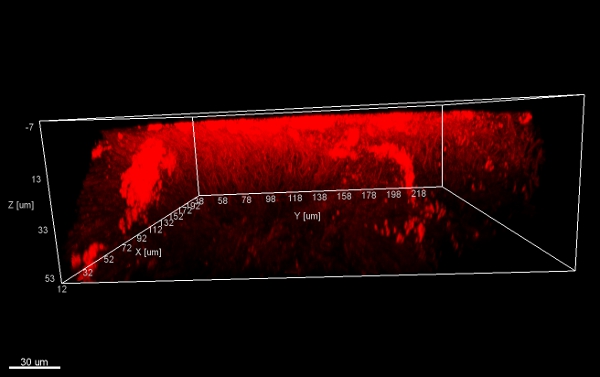
Figura 11. Mushroom estrutura, vistas 3D a partir de baixo. Pilhas de biofilme flocos (raspado a superfície de um aparelho ortodôntico), coradas com EUBmix e procedimentosssed com IMARIS (imagem CLSM).

Figura 12. Mushroom estrutura, vista lateral 3D. Pilhas de biofilme flocos (raspado a superfície de um aparelho ortodôntico) processados com IMARIS (imagem CLSM).
| Tampão de hibridação (200 mL) | |||
| Concentração de formamida | 10% | 20% | 45% |
| 5 M NaCl | 36 | 36 | 36 |
| 1 M Tris-HCl | 4 | 4 | 4 |
| 2% SDS | 1 | 1 | 1 |
| FA | 20 | 40 | 90 |
| DDH 2 O | 138 | 118 | 68 |
| Qualquer sonda FISH | 2 | 2 | 2 |
Tabela 1. Constituintes de tampão de hibridação (concentrações em mL).
| Tampão de lavagem (50 ml) | |||
| Concentração de formamida | 10% | 20% | 45% |
| 5 M NaCl | 4500 | 2150 | 300 |
| 1 M Tris-HCl | 1000 | 1000 | 1000 |
| 0,5 M EDTA | 0 | 500 | 500 |
| 2 O DDH | 44 500 | 46 350 | 48 200 |
Tabela 2. Constituintes de tampão de lavagem (concentrações em mL).
Movie 1. Clique aqui para assistir o filme.
Discussão
O protocolo descrito aqui é uma abordagem altamente viável para biofilmes coloração coletados de materiais duros. Amostragem e hibridação são as etapas mais críticas. Durante a amostragem, os cuidados devem ser tomados para que as fatias de espessura adequada são coletados para garantir que a estrutura do biofilme permanece intacta. Durante a hibridização, é essencial para evitar flutuações excessivas de temperatura, evitando ligação não específica, ou perda de ligação, das sondas fluorescente etiquetado. Este protocolo FISH é um método elegante para a mancha biofilme heterogêneos normal diretamente em lâminas de vidro, sem interromper sua composição. Os slides podem ser imediatamente utilizado para microscopia sem precisar mover a amostra, mais uma vez. Desta forma, uma melhoria em relação a coloração em tubos é obtido pela força de cisalhamento menor sendo aplicada ao biofilme. Fatias de> 50 mm de espessura podem ser preparados e investigados dessa forma.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi apoiado pelo Fonds de Higiene da Universidade Médica de Graz. Todos os atletas deram o seu consentimento informado. Aprovação institucional do protocolo do estudo foi obtido a partir da Universidade Médica de Graz.
Materiais
| Name | Company | Catalog Number | Comments |
| Oligonucleotides | Target organism | Fluorochrome | |
|---|---|---|---|
| EUB338 - 338III | Eubacteria | Cy3 | |
| LGC354 A-C | Firmicutes | FITC | |
| Bac303 | Bacteroidetes | Cy5 | |
| Mut590 | Streptococcus mutans | FITC | |
| POGI | Porphyromonas gingivalis | FITC |
Table 3. Oligonucleotides (refer to probeBase13 for details).
| Component | Company | Comments |
|---|---|---|
| 4% paraformaldehyde | 4% solution in PBS | |
| 1 x PBS | 3 x solution prepared | |
| ddH2O | Millipore | |
| Ethanol (100%) | Merck | |
| Lysozyme | Roth | 100 mg/ml stock solution |
| Formamide | Roth | 99.5% solution |
| 5 M NaCl | Roth | |
| 1 M Tris-HCl | Roth | |
| 2% SDS | Roth | |
| FISH probes (oligonucleotides) | Invitrogen, Sigma | |
| ProLong Gold antifadent | Invitrogen | |
| Nail polish | ||
| Equipment | ||
| Incubator | Thermo Scientific | |
| Water bath | IKA Tez | |
| 50 ml tubes | Sarstedt | |
| Polysine-coated slides | Thermo Scientific |
Table 4. Materials and equipment.
Referências
- Sunde, P. T. Fluorescence in situ hybridization (FISH) for direct visualization of bacteria in periapical lesions of asymptomatic root-filled teeth. Microbiology. 149, 1095-1102 (2003).
- Sussman, M., Loya, Y., Fine, M., Rosenberg, E. The marine fireworm Hermodice carunculata is a winter reservoir and spring-summer vector for the coral-bleaching pathogen Vibrio shiloi. Environ. Microbiol. 5, 250-255 (2003).
- Kolenbrander, P. E. Communication among oral bacteria. Microbiol. Mol. Biol. Rev. 66, 486-505 (2002).
- Zijnge, V. Oral biofilm architecture on natural teeth. PLoS One. 5, e9321-e9321 (2010).
- Thurnheer, T., Gmur, R., Giertsen, E., Guggenheim, B. Automated fluorescent in situ hybridization for the specific detection and quantification of oral streptococci in dental plaque. J. Microbiol. Methods. 44, 39-47 (2001).
- Hojo, K., Nagaoka, S., Ohshima, T., Maeda, N. Bacterial interactions in dental biofilm development. J. Dent. Res. 88, 982-990 (2009).
- Jung, D. J. Visualization of initial bacterial colonization on dentine and enamel in situ. J. Microbiol. Methods. 81, 166-174 (2010).
- Al-Ahmad, A. Bacterial colonization of enamel in situ investigated using fluorescence in situ hybridization. J. Med. Microbiol. 58, 1359-1366 (2009).
- Bryers, J. D. Medical biofilms. Biotechnol. Bioeng. 100, 1-18 (2008).
- Cardinale, M., Vieira de Castro, J., Muller, H., Berg, G., Grube, M. In situ analysis of the bacterial community associated with the reindeer lichen Cladonia arbuscula reveals predominance of Alphaproteobacteria. FEMS Microbiol. Ecol. 66, 63-71 (2008).
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Chin, M. Y., Busscher, H. J., Evans, R., Noar, J., Pratten, J. Early biofilm formation and the effects of antimicrobial agents on orthodontic bonding materials in a parallel plate flow chamber. Eur. J. Orthod. 28, 1-7 (2006).
- Loy, A., Maixner, F., Wagner, M., Horn, M. probeBase--an online resource for rRNA-targeted oligonucleotide probes: new features 2007. Nucleic. Acids. Res. 35, (2007).
- Diaz, P. I. Molecular characterization of subject-specific oral microflora during initial colonization of enamel. Appl. Environ. Microbiol. 72, 2837-2848 (2006).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J. Oral Sci. 115, 459-467 (2007).
- Kolenbrander, P. E. Bacterial interactions and successions during plaque development. Periodontology. 42, 47-79 (2000).
- Kolenbrander, P. E., Palmer, R. J., Periasamy, S., Jakubovics, N. S. Oral multispecies biofilm development and the key role of cell-cell distance. Nat. Rev. Microbiol. 8, 471-480 (2010).
- Chalmers, N. I. Use of quantum dot luminescent probes to achieve single-cell resolution of human oral bacteria in biofilms. Appl. Environ. Microbiol. 73, 630-636 (2007).
- Wecke, J. A novel technique for monitoring the development of bacterial biofilms in human periodontal pockets. FEMS Microbiol. Lett. 191, 95-101 (2000).
- Moter, A., Gobel, U. B. Fluorescence in situ hybridization (FISH) for direct visualization of microorganisms. J. Microbiol. Methods. 41, 85-112 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados