Method Article
Análisis de biofilm oral del paladar Expansores por fluorescencia de hibridación in situ y microscopía de escaneo láser confocal
En este artículo
Resumen
Se presenta un protocolo para el análisis estructural y de composición del biofilm oral, natural de aparatos de ortodoncia con In situ (FISH) y la microscopía láser confocal de barrido (CLSM). Muestras orales de biopelículas se obtuvieron de expansores del paladar, el raspado de resina acrílica, copos de su superficie y someterlas a la transformación molecular.
Resumen
Microscopía de escaneo láser confocal (CLSM) de la biopelícula heterogénea naturales que hoy es facilitado por una amplia gama de técnicas de tinción, siendo uno de ellos hibridación in situ fluorescente (FISH). 1,2 Se realizó un estudio piloto en el que las muestras orales recogidas de biofilm fija aparatos de ortodoncia (expansores del paladar) fueron teñidas por los peces, con el objetivo de evaluar la organización tridimensional del biofilm natural y la acumulación de placa 3,4. PESCADO crea una oportunidad para teñir las células en su ambiente nativo de biofilm por el uso de 16S marcado con fluorescencia rRNA de metas de las sondas. 4-7,19 En comparación con otras técnicas, como el etiquetado de inmunofluorescencia, se trata de una técnica de bajo costo, el etiquetado preciso y sencillo para investigar diferentes grupos de bacterias en el biofilm de consorcios mixtos. 18,20 sondas general se utilizaron que se unen a las eubacterias ( EUB338 + + EUB338II EUB338III; adelante EUBmix), 80-10 Firmicutes (LGC354 AC;. LGCmix en adelante), 9,10 y Bacteroidetes (Bac303) 11 Además, las sondas de unión específico para Streptococcus mutans (MUT590) 12,13 y Porphyromonas gingivalis (institución de giro postal) 13,14 se utilizaron . La extrema dureza de los materiales de la superficie involucrada (de acero inoxidable y resina acrílica) nos obligó a buscar nuevas formas de preparación de la biopelícula. A medida que estos materiales de la superficie no puede ser fácilmente cortado con un cryotome, los distintos métodos de muestreo se analizaron para obtener biofilm bucal intacta. La más viable de estos enfoques se presenta en esta comunicación. Pequeñas escamas de la resina de biofilm de transporte de acrílico se desprendieron con un bisturí estéril, teniendo cuidado de no dañar la estructura del biofilm. Fórceps se utilizan para recoger la biopelícula de las superficies de acero. Una vez recogidas, las muestras fueron fijadas y se coloca directamente en Polysine diapositivas de vidrio recubierto. FISH se realiza directamente en las diapositivas con las sondas de mencionó arriba. Varios protocolos de peces se combinan y modifican para crear un nuevo protocolo que era fácil de manejar. 5,10,14,15 Posteriormente las muestras fueron analizadas por microscopía confocal de barrido láser. Conocido configuraciones 3,4,16,17 puede ser visualizado, incluyendo formaciones de estilo hongo y grupos de bacterias cocoides invadido por los canales. Además, la composición bacteriana de las estructuras típicas de biopelículas se analizaron y crearon imágenes en 2D y 3D.
Protocolo
1. Recogida de muestras
- Quitar fija expansores palatinos después de 4 meses de servicio intraoral. Utilizar el Sistema de NOLA campo seco para aislar a los aparatos antes de sacarlos (Figuras 1 y 2).
- Utilice pinzas esterilizadas, guantes y bandejas para eliminar la contaminación sin necesidad de añadir expansores (Figuras 3 y 4).
- Almacenar objetos en Sarstedt 120 ml viales a -20 ° C. Tome al laboratorio en hielo y el proceso dentro de las 24 horas.
2. Biofilm fijación
- Raspar escamas biofilm con un bisturí estéril, o cobrar piezas con una pinza estéril.
- Añadir helada solución al 4% PFA hasta que la muestra está bien cubierta.
- Incubar la mezcla a 4 ° C (no congelar) de 3 a 12 horas. Ya veces la fijación o la fijación de las temperaturas más altas pueden hacer que la envoltura celular de bacterias gram-negativos células menos permeable a las sondas de oligonucleótidos.
- Retire la solución PFA y lavar con helado de PBS 1X. Repita este paso 2-3 veces a la remove residual PFA.
- Resuspender la muestra en un vol. helado de PBS 1X y añadir vol 1. helada del 96% (v / v) de etanol.
- Almacenar las muestras a -20 ° C. Las muestras fijadas de acuerdo con este protocolo se pueden almacenar por varios meses o años.
3. La deshidratación de las muestras fijas
- Aplicar l 50-30 de PFA-fijo material de la muestra a un portaobjetos de microscopio.
- Seco a 46 ° C durante 15 min a temperatura ambiente o durante más tiempo. Descongele la lisozima y la formamida.
- Añadir 250 l de lisozima (1mg/ml) a temperatura ambiente durante 10 minutos, lo que facilita la penetración de las sondas en las células por la destrucción parcial de las paredes celulares.
- Dip caer en 50%, 80% y 96% (v / v) de etanol durante 3 minutos cada uno. El efecto deshidratante de la serie de la concentración de etanol va a desintegrar las membranas celulares.
- Secar los portaobjetos a 46 ° C durante 10 min.
4. Hibridación in situ
- Prepare 1 ml detampón de hibridación fresca (ver Tabla 1 para la concentración). Las concentraciones de formamida utilizados en este estudio: 10% (EUBmix), el 20% (Bac303, institución de giro postal, MUT590) o 45% (LGCmix).
- Descongele las soluciones sonda de oligonucleótidos. Sondas descongelado debe mantenerse en hielo y protegido de la luz.
- Añadir 2 l de cada sonda de 200 l de tampón de hibridación, mezclar bien y aplicar la mezcla de la muestra deshidratada en un portaobjetos de microscopio.
- Coloque un pedazo de papel de seda en una plaza una placa de Petri y verter el resto de tampón de hibridación en el papel de seda.
- Inmediatamente colocar la placa horizontal en el plato y cerca del plato. Incubar en una estufa a 46 ° C durante 1-5 horas (90 minutos será suficiente en la mayoría de los casos). Las funciones de plato como una cámara de humedad evitando la evaporación de la solución de hibridación de la diapositiva. En particular, la evaporación de la formamida puede causar no específicos de la sonda unión a las células no deseadas.
- Prepare 50 ml de tampón de lavado (ver Tabla 2 para concentrations). Prepare la solución de lavado en un tubo de 50 ml y de precalentamiento a 48 ° C en un baño de agua. La etapa de lavado se realiza a 48 ° C.
- Retirar la cápsula con la tapa del horno de hibridación. Lávese inmediatamente el tampón de hibridación con un pequeño volumen de tampón de lavado pre-calentado, y la transferencia de la diapositiva en el buffer de lavado restante.
- Coloque el tubo que contiene el tampón de lavado y deslice la espalda en el baño de agua y se incuba a 48 ° C durante 10-15 min.
- Eliminar diapositiva del tubo y echar mano helada ddH 2 O durante 2-3 segundos para eliminar el tampón de lavado residual.
- Deje secar al aire la diapositiva lo más rápido posible (el uso de aire comprimido se recomienda). De secado rápido se reducirá la sonda disociación.
- Diapositivas seco se puede almacenar en la oscuridad a -20 ° C durante varias semanas sin una pérdida significativa de la sonda, confiere señal de fluorescencia.
5. Microscopía
- Después de FISH y lavado, aply dos gotas de cerca antifadent a los extremos izquierdo y derecho de una diapositiva (rodajas congeladas se debe calentar a temperatura ambiente antes de este paso).
- Coloque una cubierta microscopio de deslizamiento en la parte superior y esperar hasta que el antifadent se ha extendido por toda la diapositiva. Tenga en cuenta que una cantidad excesiva de antifadent puede distorsionar la imagen del microscopio.
- Observar las muestras con un microscopio láser confocal de barrido equipados con filtros adecuados o láser. Se utilizó un Leica TCS unidad (HCX PL APO/63x; NA 1.2). Los datos pueden ser analizados con el software como Imaris o AMIRA.
- Diapositivas integrados en antifadent se puede almacenar a 4 ° C (no congelar) hasta 7 días antes de la sonda, confiere fluorescencia comienza a declinar. Por otra parte, la antifadent se puede quitar con ddH2O, y las diapositivas seco se puede almacenar a -20 ° C durante un período prolongado de tiempo.
6. Los resultados representativos:
Raspado del biofilm de aparatos ortodóncicos fijos (Figura 5) los rendimientos de copos adecuado (Figura 6) que puede ser hibridado directamente sobre láminas de vidrio recubierto para microscopía. De esta manera, los diferentes grupos de bacterias orobiome se pueden identificar en sus recursos naturales, entorno tridimensional por rRNA bacteriano etiquetado con diferente marcado con sondas específicas (Figuras 7 y 8). En la figura 7, la biopelícula se tiñeron con EUBmix (verde, todas las bacterias) y LGCmix (amarillo, Firmicutes). Firmicutes aparecen en color verde, ya que estaban manchadas de amarillo y azul. En la Figura 8, la biopelícula se tiñeron con EUBmix (rojo, todas las bacterias), Bac303 (azul, Bacteroidetes) y instituciones de giro postal (amarillo, Porphyromonas gingivalis). Gingivalis se muestra en color blanco amarillento, como las tres sondas se unen a su ADN y la superposición de de los resultados de los colores en una señal de blanco. Las diferencias morfológicas entre los grupos de bacterias también pueden ser identificados (Figuras 9 y 10). Grandes grupos de bacterias cocoides se muestra en la Figura 9, donde la tinción se realizó con EUBmix (verde, todos los bacteria). Diferentes formas de las bacterias orales se visualizaron en la Figura 10, donde las bacterias cocoides y filamentosas se pueden distinguir por la tinción con EUBmix (rojo). Además, una típica seta-como la estructura del biofilm pueden ser procesados a través del modelado 3D de los datos CLSM (Figuras 11 y 12) Haga clic aquí para ver una película de la modelación 3D.
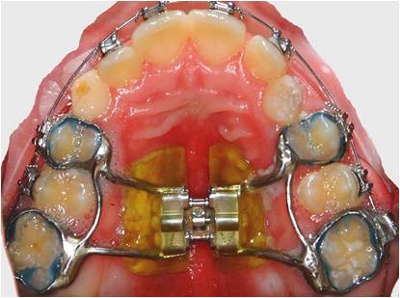
Figura 1. Expansor palatino fijo in situ.
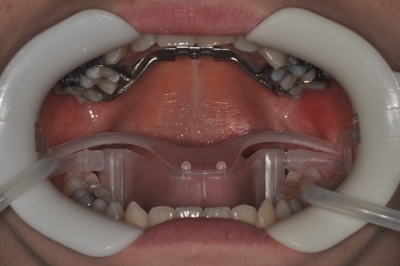
Figura 2. Sistema de Nola campo seco.

Figura 3. Pinzas esterilizadas, guantes y una bandeja.
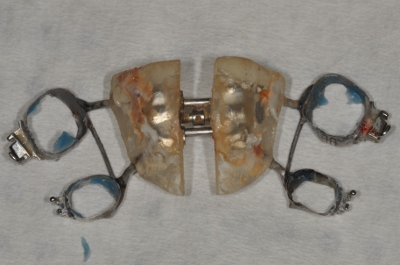
Figura 4. Eliminado de expansión.

Figura 5. Raspado de biofilm con un bisturí estéril.

Escamas de la figura 6. Resina directamente hibridizada en portaobjetos de vidrio recubierto.

Figura 7 CLSM imagen:. Diferenciación de un grupo de bacterias específicas. Superposición de los datos 2D en 3D CLSM pila. Biofilm teñidas con EUBmix (verde, todas las bacterias) y LGCmix (amarillo, Firmicutes).

Figura 8 CLSM imagen:. Diferenciación de un grupo de bacterias específicas. Superposición de los datos 2D en 3D CLSM pila. Biofilm teñidas con EUBmix (rojo, todas las bacterias), Bac303 (azul, Bacteroidetes) y instituciones de giro postal (amarillo, Porphyromonas gingivalis).
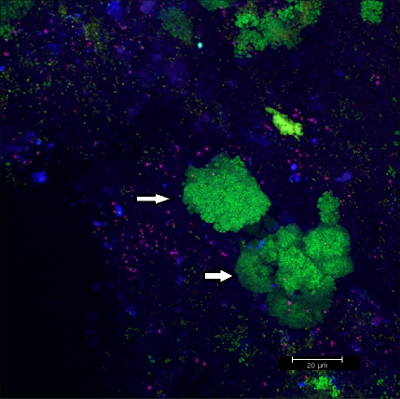
Figura 9 CLSM imagen:. Diferenciación de las morfologías específicas. Superposición de los datos 2D en 3D CLSM pila. Biofilm teñidas con EUBmix (verde, todas las bacterias). Grandes grupos de bacterias cocoides (flechas).
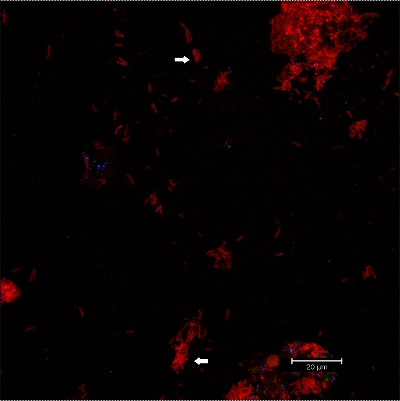
. Figura 10 imágenes CLSM: la diferenciación de las morfologías específicas. Superposición de los datos 2D en 3D CLSM pila. Biofilm teñidas con EUBmix (rojo, todas las bacterias). Cocoides (flecha abajo) y bacterias filamentosas (flecha arriba) se pueden distinguir.
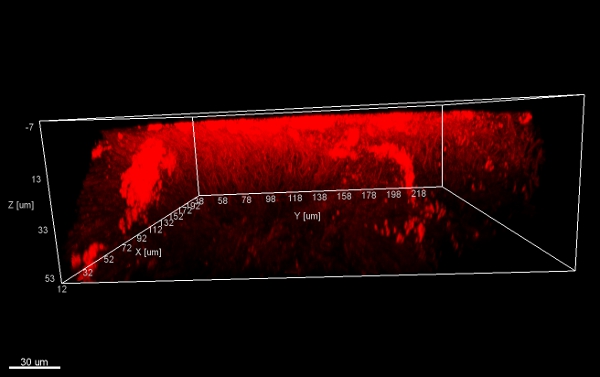
Figura 11. Estructura de hongos, vistas en 3D desde abajo. Las pilas de copos biofilm (raspado de la superficie de un aparato de ortodoncia), teñidas con EUBmix y procedimientosssed con Imaris (imagen CLSM).

Figura 12. Estructura de hongos, vista lateral en 3D. Las pilas de copos biofilm (raspado de la superficie de un aparato de ortodoncia) elaborado con Imaris (imagen CLSM).
| La hibridación de amortiguación (200 l) | |||
| Concentración de formamida | 10% | 20% | 45% |
| 5 M NaCl | 36 | 36 | 36 |
| 1 M Tris-HCl | 4 | 4 | 4 |
| 2% de SDS | 1 | 1 | 1 |
| FA | 20 | 40 | 90 |
| DdH2O | 138 | 118 | 68 |
| Cualquier FISH sonda | 2 | 2 | 2 |
Tabla 1. Componentes de tampón de hibridación (concentraciones en l).
| Tampón de lavado (50 ml) | |||
| Concentración de formamida | 10% | 20% | 45% |
| 5 M NaCl | 4500 | 2150 | 300 |
| 1 M Tris-HCl | 1000 | 1000 | 1000 |
| EDTA 0,5 M | 0 | 500 | 500 |
| ddH2O | 44 500 | 46 350 | 48 200 |
Tabla 2. Constituyentes de tampón de lavado (concentraciones en l).
Movie 1. Haga clic aquí para ver la película.
Discusión
El protocolo descrito en este documento es un enfoque muy práctico a los biofilms tinción recogida de materiales duros. Muestreo y la hibridación son los pasos más críticos. Durante el muestreo, se debe tener cuidado de que las rebanadas de un espesor adecuado se recogen para asegurar que la estructura del biofilm se mantiene intacta. Durante la hibridación, es esencial para evitar las fluctuaciones excesivas de temperatura, evitando así la unión no específica, o pérdida de unión, de las sondas de la etiqueta fluorescente. Este protocolo FISH es un método elegante para teñir biopelícula heterogénea normal directamente en placas de vidrio sin alterar su composición. Las diapositivas se pueden utilizar inmediatamente para microscopia, sin necesidad de mover la muestra una vez más. De esta manera, una mejora con respecto a la tinción de los tubos se consigue por la fuerza a menos de corte que se aplica a la biopelícula. Rodajas de> 50 m de espesor se puede preparar e investigar de esta manera.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el Fonds de Higiene de la Universidad Médica de Graz. Todos los sujetos dieron su consentimiento informado. La aprobación institucional del protocolo del estudio se obtuvo de la Universidad Médica de Graz.
Materiales
| Name | Company | Catalog Number | Comments |
| Oligonucleotides | Target organism | Fluorochrome | |
|---|---|---|---|
| EUB338 - 338III | Eubacteria | Cy3 | |
| LGC354 A-C | Firmicutes | FITC | |
| Bac303 | Bacteroidetes | Cy5 | |
| Mut590 | Streptococcus mutans | FITC | |
| POGI | Porphyromonas gingivalis | FITC |
Table 3. Oligonucleotides (refer to probeBase13 for details).
| Component | Company | Comments |
|---|---|---|
| 4% paraformaldehyde | 4% solution in PBS | |
| 1 x PBS | 3 x solution prepared | |
| ddH2O | Millipore | |
| Ethanol (100%) | Merck | |
| Lysozyme | Roth | 100 mg/ml stock solution |
| Formamide | Roth | 99.5% solution |
| 5 M NaCl | Roth | |
| 1 M Tris-HCl | Roth | |
| 2% SDS | Roth | |
| FISH probes (oligonucleotides) | Invitrogen, Sigma | |
| ProLong Gold antifadent | Invitrogen | |
| Nail polish | ||
| Equipment | ||
| Incubator | Thermo Scientific | |
| Water bath | IKA Tez | |
| 50 ml tubes | Sarstedt | |
| Polysine-coated slides | Thermo Scientific |
Table 4. Materials and equipment.
Referencias
- Sunde, P. T. Fluorescence in situ hybridization (FISH) for direct visualization of bacteria in periapical lesions of asymptomatic root-filled teeth. Microbiology. 149, 1095-1102 (2003).
- Sussman, M., Loya, Y., Fine, M., Rosenberg, E. The marine fireworm Hermodice carunculata is a winter reservoir and spring-summer vector for the coral-bleaching pathogen Vibrio shiloi. Environ. Microbiol. 5, 250-255 (2003).
- Kolenbrander, P. E. Communication among oral bacteria. Microbiol. Mol. Biol. Rev. 66, 486-505 (2002).
- Zijnge, V. Oral biofilm architecture on natural teeth. PLoS One. 5, e9321-e9321 (2010).
- Thurnheer, T., Gmur, R., Giertsen, E., Guggenheim, B. Automated fluorescent in situ hybridization for the specific detection and quantification of oral streptococci in dental plaque. J. Microbiol. Methods. 44, 39-47 (2001).
- Hojo, K., Nagaoka, S., Ohshima, T., Maeda, N. Bacterial interactions in dental biofilm development. J. Dent. Res. 88, 982-990 (2009).
- Jung, D. J. Visualization of initial bacterial colonization on dentine and enamel in situ. J. Microbiol. Methods. 81, 166-174 (2010).
- Al-Ahmad, A. Bacterial colonization of enamel in situ investigated using fluorescence in situ hybridization. J. Med. Microbiol. 58, 1359-1366 (2009).
- Bryers, J. D. Medical biofilms. Biotechnol. Bioeng. 100, 1-18 (2008).
- Cardinale, M., Vieira de Castro, J., Muller, H., Berg, G., Grube, M. In situ analysis of the bacterial community associated with the reindeer lichen Cladonia arbuscula reveals predominance of Alphaproteobacteria. FEMS Microbiol. Ecol. 66, 63-71 (2008).
- Aas, J. A., Paster, B. J., Stokes, L. N., Olsen, I., Dewhirst, F. E. Defining the normal bacterial flora of the oral cavity. J. Clin. Microbiol. 43, 5721-5732 (2005).
- Chin, M. Y., Busscher, H. J., Evans, R., Noar, J., Pratten, J. Early biofilm formation and the effects of antimicrobial agents on orthodontic bonding materials in a parallel plate flow chamber. Eur. J. Orthod. 28, 1-7 (2006).
- Loy, A., Maixner, F., Wagner, M., Horn, M. probeBase--an online resource for rRNA-targeted oligonucleotide probes: new features 2007. Nucleic. Acids. Res. 35, (2007).
- Diaz, P. I. Molecular characterization of subject-specific oral microflora during initial colonization of enamel. Appl. Environ. Microbiol. 72, 2837-2848 (2006).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J. Oral Sci. 115, 459-467 (2007).
- Kolenbrander, P. E. Bacterial interactions and successions during plaque development. Periodontology. 42, 47-79 (2000).
- Kolenbrander, P. E., Palmer, R. J., Periasamy, S., Jakubovics, N. S. Oral multispecies biofilm development and the key role of cell-cell distance. Nat. Rev. Microbiol. 8, 471-480 (2010).
- Chalmers, N. I. Use of quantum dot luminescent probes to achieve single-cell resolution of human oral bacteria in biofilms. Appl. Environ. Microbiol. 73, 630-636 (2007).
- Wecke, J. A novel technique for monitoring the development of bacterial biofilms in human periodontal pockets. FEMS Microbiol. Lett. 191, 95-101 (2000).
- Moter, A., Gobel, U. B. Fluorescence in situ hybridization (FISH) for direct visualization of microorganisms. J. Microbiol. Methods. 41, 85-112 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados