Method Article
دراسة دور النسيج اللمفي البلعوم المرتبط (NALT) في الردود الفأر إلى اللقاحات
In This Article
Summary
وصفت وسائل لدراسة مساهمات للأنسجة البلعوم المرتبط اللمفي (NALT) إلى الاستجابات المناعية الأنف والنظامية من الفئران لقاحات داخل الأنف. علينا أن نبرهن لعملية جراحية لوضع نموذج الفأر NALT التي تعتمد على و خارج الحي ثقافات NALT المستخرجة.
Abstract
أنسجة البلعوم المرتبط اللمفي (NALT) وجدت في البشر، والقوارض، وغيرها من الثدييات، والمساهمة في الحصانة في الجيوب الأنفية 1-3. وNALT هما مواز على شكل جرس الهياكل الموجودة في الممرات الأنفية فوق الحنك الصلب، وعادة ما تعتبر أن تكون المكونات الثانوية للنظام المخاطية المرتبطة اللمفاوية و 4-6. تقع داخل NALT هي مقصورات منفصلة من الخلايا الليمفاوية B و T تتخللها مستضد تقديم الخلايا الجذعية 4،7،8. وتحاط هذه الخلايا من قبل طبقة الخلايا الظهارية مقحم مع M-الخلايا التي هي المسؤولة عن استرجاع مستضد من الأسطح المخاطية في الممرات الجوية 9،10. تستعد الخلايا الليمفاوية ساذج المتداولة خلال NALT للرد على اللقاءات الأولى مع مسببات الأمراض التنفسية 7. في حين NALT تختفي في البشر قبل سن سنتين، أجهزة فالداير اللمفاوي الطوق ومنظم على نحو مماثل لا تزال قائمة الroughout الحياة 6. وعلى النقيض من البشر والفئران الاحتفاظ NALT في جميع مراحل الحياة، وبالتالي توفير نموذج حيواني مناسب لدراسة الاستجابات المناعية تنشأ داخل الجيوب الأنفية 11.
ثقافات وحيدة الخلية تعليق من NALT ليست عملية بسبب العائدات المنخفضة من خلايا وحيدات النوى. ومع ذلك، يمكن النظر NALT البيولوجيا بواسطة استزراع الأحياء السابقين من الجهاز سليمة، وهذا الأسلوب له ميزة إضافية للحفاظ على بنية الأنسجة الطبيعية. لفي الدراسات المجراة، ونماذج خروج المغلوب الوراثية تقديم العيوب تقتصر على NALT غير متوفرة حاليا بسبب وجود سوء فهم من المسار التنموي. على سبيل المثال، في حين سم لمفي-α الفئران خروج المغلوب وقد ضمر NALT، تتغير أيضا البقع باير، والعقد اللمفاوية الطرفية، والخلايا الجذعية والأنسجة اللمفاوية مسامي الأخرى في هذه الفئران التلاعب وراثيا 12،13. كبديل عن الفئران خروج المغلوب الجينات، والعمليات الجراحية ص الاجتثاثيلغي ermanently NALT من ممر الأنف دون أن يؤثر ذلك الأنسجة الأخرى. وقد استخدم نموذج الفأر مما أدى إلى إقامة علاقات بين استجابات NALT والمناعية للقاحات 1،3. جمع المسلسل من مصل الدم، ويغسل، لعاب الانف والافرازات المهبلية هو ضروري لوضع الأساس للاستجابات المضيف إلى تلقيح، في حين يمكن التأكد من الاستجابات المناعية المنشأ مباشرة من NALT بواسطة زراعة الأنسجة. الإجراءات التالية الخطوط العريضة لعملية جراحية، وزراعة الأنسجة وجمع العينات اللازمة لفحص المحلية والنظامية الاستجابات المناعية الخلطية للتلقيح (IN) داخل الأنف.
Protocol
1. NALT جمع والتثقيف
- الموت ببطء الفئران باستخدام التوجيه IACUC المعتمدة. تجنب استخدام مواد التخدير المستنشق التي قد تؤثر على NALT. نقل الفئران على مساحة العمل العقيم أو مجلس الوزراء للسلامة الأحيائية. إزالة الفك السفلي من الفأرة وتنظيف منطقة الحنك العلوي مع مناديل الكحول واليود.
- استخدام رقم (11) شفرة جراحية في مقبض سكين جراحية لقطع بعناية والمكوس في الحنك العلوي وذلك باتباع كفاف داخل القواطع الماوس والأسنان المولي.
- بلطف قشر ظهر الحنك بالملقط، والحرص على عدم تمزيق الحنك.
- هذه الخطوة كانت ضرورية للحد من التلوث من الثقافات وصممت لمعالجة الأذواق متعددة. الأذواق مكان في الآبار الفردية في العمود الأول من لوحة 48-جيدا معقم معبأة سلفا مع 250 ميكرولتر من الثقافة المتوسطة كاملة (37 درجة مئوية)، ويتألف من RPMI 1640 تستكمل مع مصل بقري جنيني 10٪، 100 ميكروغرام / مل الستربتومايسين، و 100 UI / البنسلين مل، 50 ميكروغرام / مل جنتاميسينو1 ميكروغرام / مل fungizone / الأمفوتريسين. وينبغي أن تكون وسائل الاعلام كربونات مخزنة إذا تستزرع الأذواق في ثاني أكسيد الكربون بنسبة 5٪ 2/95٪ الرطبة الهواء الحاضنة (37 درجة مئوية)، أو بدلا من استخدام 10 درجة الحموضة HEPES ملي 7.4، للثقافة 2 غير ثاني أكسيد الكربون.
- لغسل الأذواق، واستخدام الملقط لنقل الأذواق في كل بئر على التوالي في صف واحد، والتنصت بعناية لوحة بين يغسل، حتى الحنك خضع ما مجموعه ثمانية يغسل.
- نقل الأذواق إلى لوحة 48-جيدا عقيمة جديدة تحتوي على 250 ميكرولتر من جديد، وسط ثقافة كاملة (37 درجة مئوية) في الآبار.
- وضع لوحات تحتوي على الأذواق في الحاضنة 37 درجة مئوية للزراعة لمدة الدراسة.
- جمع عينات للتحليل من خلال نقل جو معقم و مطهر 100 ميكرولتر من المتوسط من الآبار ثقافة في أنابيب إيبندورف كل 24 ساعة، ليحل محل مع 100 ميكرولتر من 37 الطازجة ° C الثقافة المتوسطة.
- منبذة ثقافة وسائل الإعلام عينات بمبلغ 380 XG لمدة 10 دقائق، 4 درجات مئوية، على الحطام بيليه.
- نقل طاف من العينة طرده مركزيا لأنابيب إيبندورف الطازجة ومخزن في -20 درجة مئوية حتى جاهزة للتحليل.
- ويتم قياس مستضد محدد مفتش الحكومة، الغلوبولين المناعي، و IgA، أو السيتوكينات يفرز في الأنسجة ثقافة supernatants بواسطة المقايسات انزيم مرتبط معيار المناعي (ELISA).
2. تذرية جراحي من NALT
- الإناث BALB / ج الفئران، من 7 إلى 9 أسابيع من العمر، هي مواضيع مناسبة، ولكن السلالات الأخرى هي أيضا مقبولة. توفير هلام مثل الغذاء الرطب قبل ثلاثة أيام من عملية جراحية حتى يتأقلم الماوس إلى البديل الغذاء والماء الذي سوف يدار في مرحلة ما بعد العملية.
- إدارة قطرة واحدة من دواء تخفيف ألم Metacam (1.5 ملغ / مل أو 0.05 مغ / الانخفاض) في تجويف الفم قبل الجراحة.
- تخدير الفئران باستخدام التوجيه IACUC تمت الموافقة عليها، على سبيل المثال، مع الكيتامين، آسيبرومازين، وخليط زيلازين (KAX) وتطبيق Puralube مرهم البيطرية على العينين لمنع جفاف. تجنب استخدام مواد التخدير المستنشق التي قد تؤثر على NALT. Aويمكن التأكد من nesthesia بسبب عدم وجود استجابة منعكس على معسر لطيف من أصابع القدم.
- إدارة 1 مل ملحي (0.9٪ حقن كلوريد الصوديوم USP) تحت الجلد بين عظام الكتف باستخدام إبرة قياس 22-28 وحقنة لمنع الجفاف المحتملة للفأر بعد الجراحة. تدير أيضا 0.1 مل من Respiram تحت الجلد بين عظام الكتف باستخدام إبرة قياس 22-28 وحقنة لتعزيز التنفس صحية أثناء وبعد عملية جراحية.
- تقديم الدعم إلى الحرارية الماوس أثناء كل تلاعب لاحق.
- ضع الماوس تخدير في موقف ضعيف، واستخدام اثنين من حلقات منفصلة من خياطة جراحية في جميع أنحاء القواطع العلوية والسفلية لابعاد بلطف فتح الفم، ويعرض الحنك العلوي.
- استخدام رقم 11 شفرة جراحية لإجراء شق حوالي 3 ملم في الطول أسفل خط الوسط من الحنك العلوي في موقع NALT.
- اضافة الى وجود microcurette مم 0.5 في شق وكشط بلطف تحت حواف إلىتعطيل NALT.
- كوى شق لوقف النزيف مع حلقة غرامة على التوالي على وحدة الكي الحراري.
- مواصلة تقديم الدعم الحرارية بينما الفأر يسترد وعيه الكامل ونشاط.
- توفر الماوس مع أوقات تصل إلى ثلاثة المالحة تحت الجلد يوميا، 1 مل لكل الحقن بين عظام الكتف، لمنع الجفاف والمسكنات اللازمة وعن طريق الفم مرة واحدة يوميا لمدة 3 أيام بعد الجراحة. تحديد الجفاف عن طريق إجراء اختبار الجلد خيمة للتحقق من وتورم الجلد. فهم من الجلد والفرو بين لوحي الكتفين بحيث يتم الخيام عنه. إذا كان جلد يعود بسرعة إلى موقف، طبيعي السابقة، الفأر ليس المجففة. إذا كان الجلد لا تزال مرتفعة ويتحرك ببطء، الفأر هو في حالة من الجفاف ويتطلب المالحة. توفير الغذاء الرطب لثلاثة أيام على الأقل بعد عملية جراحية لإتاحة الوقت الكافي لتحقيق الانتعاش.
- قبل الشروع في أي إجراءات التجريبية، ومراقبة الفئران لمدة 8-10 أيام عن طريق تتبع زيادة الوزن. الفقراء الوزن الانتعاشعادة ما يشير الى عدم اكتمال شفاء الحنك، وينبغي سحب هذه الفئران من إجراء المزيد من الدراسات.
3. إعداد NALT لعلم الأنسجة وتقييم نجاح جراحة NALT
- يجب أن نجاح عملية جراحية NALT التأكد من الأنسجة كما هو موضح أدناه. بعد الانتهاء من جميع الدراسات التجريبية، وإعداد الفئران لمجموعات الجمجمة بواسطة euthanizing باستخدام التوجيه IACUC المعتمدة. تجنب استخدام مواد التخدير المستنشق التي قد تؤثر على NALT.
- فهم مؤخر العنق من الفأرة الموت الرحيم. إزالة انخفاض الفك السفلي من بقية جمجمة بواسطة القص من خلال عمليات لقمي مع مقص على كلا الجانبين.
- بدءا من مؤخر العنق، إزالة الجلد والفرو من الجمجمة بواسطة تقشير ببطء وقطع نحو الجانب البطني من الجمجمة.
- إزالة بعناية الجلد حول منطقة الأنف وقص الجلد الخروج من غيض من الخطم إلى إزالة تماما.
- فصل الجمجمة من الطرافة فقراتقص هكتار من مقص.
- أدخل المقص في ماغنوم الثقبة وقطع نصف الطريق أسفل الجمجمة على طول خط الوسط للسماح للتغلغل من الفورمالين في الأنسجة الرخوة أثناء التثبيت.
- إصلاح الجمجمة في 10٪ محايد مخزنة الفورمالين (NBF) لمدة 24 ساعة في درجة حرارة الغرفة.
- ليزيل الكلس، ضع العينة وكاسيت منفصلة، ملفوفة في الشاش لمنع Rexyn من لمس العظم، في زجاجة مع خليط حمض الفورميك. احتضان لمدة 12 ساعة في درجة حرارة الغرفة، ثم شطف بشكل مستمر تحت ماء الصنبور لحوالي 20 دقيقة.
- تقليم عينة إلى الحاجز والماضي مدارات العين بشفرة حلاقة.
- ويمكن تخزين العينات وكاسيت للمدى القصير في بنك الفجيرة الوطني 10٪.
- وضع عينة على معالج الأنسجة لمعالجة بين عشية وضحاها. يتم ذلك لإزالة المياه من العينة استعدادا لتضمين البارافين.
- إزالة الأنسجة المصنعة، تغرس في كتلة البارافين مع خطم إلى أسفل، والسماح لتبرد.
- تقليم صough 15 ميكرومتر المقاطع العرضية للكتلة مع مشراح الآلي، والاقتراب من الموقع التقريبي للNALT، ثم يستمر القطع في 5 أقسام ميكرومتر للتركيب على الشرائح الزجاجية في 44.3 درجة مئوية حمام الماء.
- وينبغي أن تستخدم هيماتوكسيلين ويوزين تلطيخ الأنسجة (H & E) لتقييم الاجتثاث NALT.
4. جمع العينات البيولوجية من الفئران
4.1 المصل
- ورفع درجة حرارة الجسم بدقة مع مصباح الحرارة زيادة تدفق الدم. جمع الدم عن طريق الوريد الخدش الذيل الأفقي مع شفرة جراحية. السماح للالدم إلى بالتنقيط بحرية في فاصل Microtainer أنبوب المصل.
- تطبيق ضغط لطيف على نيك مع مادة ماصة، مثل الشاش أو منشفة، لوقف تدفق الدم.
- السماح على تجلط الدم في Microtainers لمدة 30 دقيقة، ثم منبذة بين 6-15 ز س 1000 ما لا يقل عن 90 ثانية.
- نقل فصل المصل من Microtainer في أنبوب إيبندورف نظيفة للالتخزين في -80 درجة مئوية.
4.2 اللعاب
- عقد الماوس تخدير عموديا في حين pipetting 20-30 فوسفات معقم ميكرولتر مخزنة المالحة (PBS) بين الوجنة واللثة. جمع اللعاب المخفف عن طريق توجيه رأس ماصة بين الخد واللثة.
- نقل اللعاب المخفف لأنبوب جديد تحتوي على 10 ميكرولتر من مثبطات الأنزيم البروتيني 2X وتخزينها عند درجة حرارة -20 درجة مئوية.
4.3 إفرازات الأنف
- الموت ببطء الماوس قبل جمع إفرازات الأنف، وذلك باستخدام المعتمدة IACUC التوجيه. تجنب استخدام مواد التخدير المستنشق التي قد تؤثر على NALT.
- عقد الماوس عموديا، ماصة بعناية 30 ميكرولتر من برنامج تلفزيوني العقيمة في واحد المنخر، وجمع من شطف الأنف الأخرى.
- نقل شطف إلى أنبوب الطازجة التي تحتوي على 10 ميكرولتر من مثبطات الأنزيم البروتيني 2X وتخزينها عند درجة حرارة -20 درجة مئوية.
4.4 الافرازات المهبلية
- إدراج غيض من micropipette في افتتاح اله الفرج من الفأر الموت الرحيم، شطف المهبل مع 50 ميكرولتر من برنامج تلفزيوني العقيمة، وجمع كل السوائل عن طريق micropipette.
- نقل شطف إلى أنبوب الطازجة التي تحتوي على 10 ميكرولتر من مثبطات الأنزيم البروتيني 2X وتخزينها عند درجة حرارة -20 درجة مئوية.
5. ويمكن قياس مستضد محددة الأجسام المضادة أو السيتوكينات في العينات التي تم جمعها بواسطة ELISA أو طريقة أخرى الكمي.
6. ممثل النتائج
ويقدم الشكل 1 التخطيطي العام للالخطوات التي تنطوي عليها مع معالجة الأنسجة NALT المحتوية على التحليل المجراة سابقا. في الشكل 2 (A، B)، ويظهر حجم الحنك، فضلا عن مكان وجود شق خلال جراحة الاستئصال (A)، كما يدل على ذلك الخط المتقطع. يشار إلى موقع NALT بواسطة الأسهم في منطقة ضاحكة على الحنك الهيماتوكسيلين الملطخة استئصاله في الشكل 2 (C)، والتي تبين أنسجة متوازية.
الشكل (3)ويعرض خطوات عملية جراحية تعطل NALT، والتي تبين تعرض الحنك العلوي للوصول إلى NALT (A، B)، التذرية (C)، والكي النهائية من شق (D). ويرد نموذجي H & E المقطع العرضي للمنطقة الجيوب الأنفية المحيطة NALT قبل الجراحة في الشكل 3E، في حين أن صورة اضطراب NALT من microcurette مباشرة بعد الجراحة يظهر في الشكل 3F. يتيح وقتا كافيا للاستجمام من عملية جراحية، ينبغي إغلاق الشقوق، وتجويف الأنف خاليا من NALT الشكل (3G).
وتظهر النتائج التجريبية النموذجية التي تم الحصول عليها باستخدام هذه التقنيات في الشكل (4)، مقارنة supernatants زراعة الأنسجة والعينات البيولوجية من دراسة أجريت على لقاح الوحيدات العنقودية (STEBVax). كانت تدار من قبل الفئران STEBVax الأنف (IN) أو الطرق داخل الصفاق (IP). وقد وضعت لقاح مع مادة مساعدة التي ينشط تول مثل مستقبلات 4 مسار 3،1 وقدمت 4، والضوابط فقط المالحة أو لقاح من دون مساعد. NALT مثقف تم الحصول عليها من المجموعات التجريبية يفرز مستضد محدد المناعية إلى المتوسطة التي كانت قابلة للقياس بواسطة ELISA. في هذا المثال (الشكل 4A)، فإن النتائج تشير إلى أن تم الإفراج عن كميات أكبر من ايغا بواسطة NALT تم الحصول عليها من الفئران مع تطعيمهم في لقاح الوحيدات جنبا إلى جنب مع المواد المساعدة.
ويمكن استخدام العينات البيولوجية (مثل اللعاب، الدم، إفرازات الأنف، الافرازات المهبلية) تم الحصول عليها من مراقبة أو الفئران NALT خالية لمحة عن الاستجابة المناعية في الجسم الحي لمستضدات الأنف للمقارنة مع نتائج زراعة الأنسجة. وانخفضت بشكل ملحوظ في الشكل 4B، ال IgG، الاستجابات لفي التلقيح دون NALT وظيفي. وكانت مستويات مستضد محدد ايغا أكبر عموما من مفتش في إفرازات مخاطية (لعاب، ويغسل الأنف) من الفئران الملقحة.
upload/3960/3960fig1.jpg "/>
الشكل 1. تخطيطي لجمع NALT والسابقين زراعة الجسم الحي.
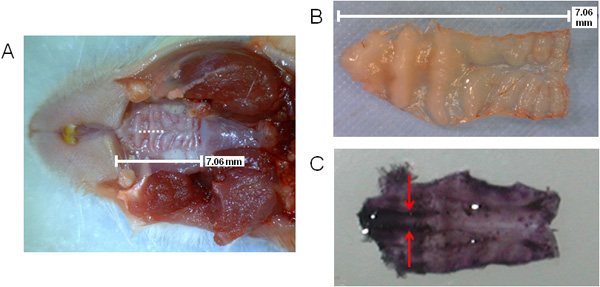
الشكل 2. التصور لحنك الفأر تشير إلى موقف شق NALT والجراحة. حجم وموقع الحنك العلوي مع شق جراحة الرمز بواسطة خط منقط (A)؛ الحنك العلوي استئصاله (B) أو ملطخة في الهيماتوكسيلين (C) لعرض NALT موازية في منطقة ضاحكة من الحنك (اللون الأرجواني الداكن الملون على الجانب الأمامي من الحنك ). وأشار NALT بواسطة السهام.
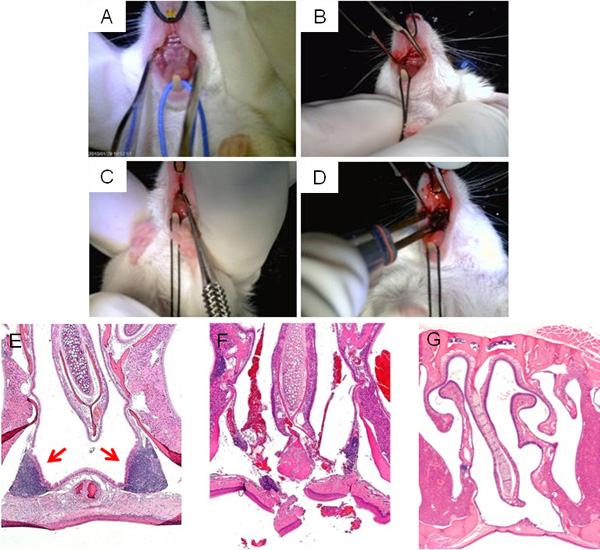
الشكل 3. الجراحية تعطل NALT. مفتاح مراحل عملية جراحية تعطل NALT: عرض ضعيف من الحنك الماوس العليا قبل الجراحة (A)؛ شق خط الوسط المحرز في الحنك العلوي للوصول إلى NALT (ب)؛ microcurette التحقيق عبارة عن طريق شق خط الوسط لتعطيل هيكل في NALTtegrity (C)؛ الكي من شق في ختام عملية جراحية (D). المجهرية صور من الجيوب الأنفية، H & E الملون، قبل الجراحة (E)، مباشرة بعد عملية جراحية (F)، وتلتئم بنجاح، NALT خالية من الماوس (G).
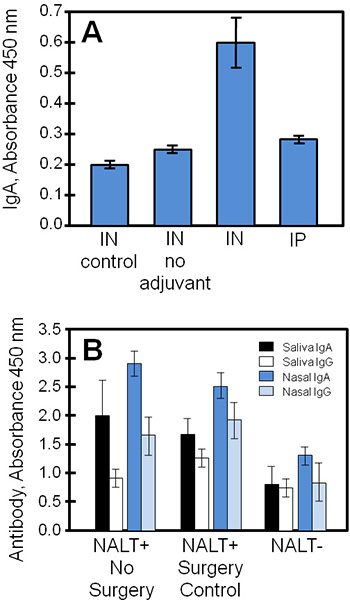
الشكل 4. لقاح محدد من الأجسام المضادة NALT مثقف، اللعاب، والإفرازات الأنفية التي تم جمعها من الفئران الملقحة. تم تحصين الفئران التي تحكم NALT خالية أو عادية في الملكية الفكرية أو مع STEBVax، وجمعت العينات البيولوجية. تم قياس مستويات الأجسام المضادة من العينات باستخدام ثلاث نسخ ELISA. (أ) أزيلت NALT من السيطرة على الفئران (وليس التلاعب جراحيا)، وتربيتها لدراسة استجابات الأجسام المضادة. كانت الاستجابة لقاح ايغا الخاصة في ثقافة لفي الفئران المحصنة مختلفة إحصائيا من الضوابط (الطالب اختبار t، P ≤ 0.01، مقارنة مع أي مساعد أو لقاح لا). (ب) اختلال NALT انخفاض كبير استجابات الأجسام المضادة المحددةإليها في التطعيم. كانت هناك اختلافات كبيرة بين مستويات الأجسام المضادة المحددة لNALT وNALT + المجموعات (أي جراحة أو السيطرة) لجميع المقارنات ما عدا نتائج مفتش لعاب (الطالب اختبار t، P ≤ 0.05).
Discussion
قدمنا وسائل جماعية لتطوير نموذج حيواني، والحصول على العينات البيولوجية، وفحوصات لدراسة NALT المرتبطة الاستجابات المناعية 1-4. هناك عوامل إضافية للنظر في أثناء أداء هذه الأساليب. وينبغي اتباع الأساليب العقيمة معيار للجراحة وزراعة الأنسجة. وهناك مجموعة من العوامل المضادة للبكتيريا ومضاد للفطريات التي استخدمت خلال العزلة والثقافة، فضلا عن الحفاظ على الآلات المعقمة، مجال العمل، والأذواق تطهيرها لحد من مخاطر التلوث. وينبغي أن يتم فحص اللعاب، ويغسل الأنف وعينات مماثلة إفراز المخاطية للتلوث محتمل مع الدم، كما تم العثور على أضداد المصل بشكل عام في تركيزات أعلى. كذلك، يجب فقط الافرازات المخاطية أن تضعف قليلا لتحليل لتركيزات أقل من الأجسام المضادة موجودة في هذه العينات بالمقارنة مع المصل.
يجب أن تبقى الفئران دافئ مباشرة بعد عملية جراحية لمرحلة ما قبلتنفيس عن إمكانية التخدير التي يسببها انخفاض حرارة الجسم. الفئران بديل يستريح على جنوبهم أثناء النقاهة بعد الجراحة لتقليل تنفس غير منتظم. الإجراء الجراحي هو أكثر كفاءة مع ثلاثة أشخاص يعملون معا لإتمام هذه المهام: 1 أداء عملية جراحية، واحدة للمساعدة في عقد فتح الفم، واحد لتوفير الرعاية بعد العمليات الجراحية مثل الفئران على التعافي من التخدير.
فمن الضروري استخدام H & E تلطيخ من المقاطع عبر الجمجمة في نهاية كل الإجراءات التجريبية أو دراسات للتحقق من نجاح عملية جراحية لكل فأر. نتائج الجراحة ممكنة هي: الكامل والثنائية الاجتثاث NALT، الاجتثاث غير مكتملة، أو NALT سليمة. ويمكن استخدام ذلك لأن ليس كل العمليات الجراحية سوف يؤدي إلى فقدان كامل للNALT والحيوانات مع NALT المتبقية أو سليمة والضوابط الداخلية. آخر النتائج المحتملة هو أن الحنك فشل للشفاء تماما، وترك فتحة توصيل الأنف والتجاويف عن طريق الفم. غير كاملوالشفاء من الحنك يؤدي إلى انخفاض الوزن وعدم قدرته على النمو، ويجب إزالة هؤلاء الأفراد من الدراسات.
وسوف تدرس الردود اللقاح الأول مع نموذج الفأر تعمل على إنشاء دور للNALT في نتائج الدراسة المقصود (استجابة الأجسام المضادة، والبقاء على قيد الحياة، وما إلى ذلك). جراحيا إزالة NALT يسهل تحديد الاشتراكات الأنف لحصانة المحلية والنظامية. النهج الجراحية وصفها هنا هو الأسلوب الأكثر مباشرة للحصول على نموذج الفأر تخلو من NALT. حدد بنظام خروج المغلوب وقد أبلغ عن نماذج الماوس إلى NALT نقص، ولكن هذه الحيوانات هي أيضا من نقص في السيتوكينات أو كيموكينات أساسي في تطوير الأنسجة الأخرى اللمفاوية الثانوية، ويمكن أن تؤوي عيوب إضافية 12،13. علاوة على ذلك، تم تطوير أساليب وصفها هنا لدراسة جوانب عديدة من الاستجابات المناعية تنشأ داخل الممرات الأنفية. وتستند النتائج التي حققناها في دراسات تجريبية باستخدام كامل الحنك العلويه من الماوس لزراعة الأنسجة، على الرغم من أنه من الممكن أن يمكن استخدام المقاطع. أخيرا، فإن النموذج NALT مثقف مفيد لإجراء التجارب تماما في زراعة الأنسجة.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقدم الدعم من قبل تقنيات بيكتون ديكنسون. الآراء الواردة في هذا البيان هي آراء المؤلفين ولا تدعي لتعكس السياسة الرسمية للحكومة الولايات المتحدة. وقد أجريت بحوث في الامتثال لقانون رعاية الحيوان والقوانين الاتحادية واللوائح الأخرى المتعلقة الحيوانات والتجارب التي تنطوي على الحيوانات ويلتزم المبادئ المنصوص عليها في دليل لرعاية واستخدام الحيوانات المختبرية، المجلس القومي للبحوث، عام 1996. وتماما المعتمدين منشأة حيث تم إجراء هذا البحث من قبل جمعية تقويم والاعتماد من المنظمة الدولية لرعاية الحيوان المعملية.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| الفولاذ المقاوم للصدأ العقيمة شفرات جراحية، رقم (11) | Miltex | 4-311 | |
| مقبض السكين، رقم (3) | Miltex | 4-7 | |
| 48-جيدا لوحات خلية الثقافة | Costar | 3548 | |
| RPMI 1640 | إينفيتروجن | 11875-093 | |
| الأبقار مصل الجنين، والحرارة المعطل | Gibco / إينفيتروجن | 16000-044 | اضرب النهائية: 10٪ من حيث الحجم في وسائل الإعلام ثقافة |
| ستربتومايسين سلفات | سيغما | S9137 | اضرب النهائية: 100 ميكروغرام / مل |
| بنسلين | سيغما | P7794 | اضرب النهائية: 100 UI / مل |
| جنتاميسين | سيغما الدريخ | G1397-10ML | اضرب النهائية: 50 ميكروغرام / مل |
| Fungizone | Gibco / إينفيتروجن | 15290-018 | اضرب النهائي: 1 ميكروغرام / مل |
| HEPES | سيغما الدريخ | H0887 | اضرب النهائية: 10 مم |
| أنابيب إيبندورف Microcentrifuge | إيبندورف | 022364111 | |
| نوترا جل الكرز الغذاء الفأر بنكهة الرطب | الحيوي خدمة | S4798-TRAY | |
| Metacam | بورنغير إنغلهايم | 601531000 | قطرة واحدة من التعليق مغ / 1.5 مل عن طريق الفم |
| الكيتامين | فايزر | 00856440301 | نهائي المشاركنورث كارولاينا: 6.06 ملغ / مل |
| آسيبرومازين | Vedco | VEDC207 | نهائي اضرب: 0،061 ملغ / مل |
| زيلازين | لويد | 4811 | نهائي اضرب: 0،667 ملغ / مل |
| Puralube الطبيب البيطري مرهم | Pharmaderm صحة الحيوان | 1621 | |
| 0.9٪ حقن كلوريد الصوديوم جامعة جنوب المحيط الهادئ | باكستر | 2B1302 | |
| 0.5 مم Microcurette | Roboz | RS-6350 | |
| الكي الحراري وحدة | جيجر | 150-S/150A-S | |
| TCU تلميح استبدال، حلقة الجميلة على التوالى | جيجر | 214 | |
| مقص جراحي | |||
| التخزين المؤقت 10٪ محايد الفورمالين | سيغما | HT501128 | |
| حمض الفورميك | الصياد | A119P-4 | خلط 426 مل من حمض الفورميك إلى 1047 مل ماء الصنبور، ثم يضاف 45 مل Rexyn 101 (H) |
| Rexyn 101 (H) | الصياد | R231-500 | |
| الأنسجة تيك VIP E150/E300 | ساكورا | ||
| مشراح دوار | لايكا | RM2255 | |
| ماير الهيماتوكسيلين | سيغما | MHS16-500ML | |
| جيل NO.1 الهيماتوكسيلين | سيغما | GHS116 | |
| يوزين B | سيغما | 2853 | |
| Microtainer المصل فاصل | دينار بحريني Medical | 365956 | |
| التخزين المؤقت فوسفات المالحة | 100 ملي مول ناه 2 PO 4، 140 مم كلوريد الصوديوم، ودرجة الحموضة 7.4 | ||
| البروتيني كوكتيل المانع، EDTA خالية | الحرارية العلمية | 78415 |
References
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved