Method Article
לבחון את תפקידה של רקמות האף והלוע הקשורים Lymphoreticular (NALT) בתגובות עכבר לחיסונים
In This Article
Summary
שיטות לבחון את תרומתם של האף והלוע הקשורים רקמות lymphoreticular (NALT) על המערכת החיסונית האף מערכתית של עכברים לחיסונים אפי מתוארים. אנחנו מדגימים ניתוח לבסס מודל NALT תלוי העכבר לשעבר vivo תרבויות NALT חילוץ.
Abstract
את האף והלוע הקשורים רקמות lymphoreticular (NALT) נמצאו אצל בני אדם, מכרסמים, ויונקים אחרים, לתרום חסינות הסינוסים באף 1-3. NALT שני מקבילים פעמון מבנים הממוקמים את מעברי האף מעל החיך הקשה, והם נחשבים בדרך כלל להיות מרכיבים משניים של מערכת הרירית הקשורים הלימפה 4-6. ממוקם בתוך NALT הם תאים נפרדים של לימפוציטים מסוג B ו-T-וביניהם אנטיגן הצגת תאים דנדריטים 4,7,8. תאים אלו מוקפים בשכבת תאים אפיתל intercalated עם M-התאים אשר אחראים אחזור אנטיגן מן המשטחים הריריים של מעברי האוויר 9,10. לימפוציטים נאיביים במחזור דרך NALT עומדים להגיב על המפגשים הראשונים עם גורמי מחלה בדרכי הנשימה 7. בעוד NALT נעלמים אצל בני אדם עד גיל שנתיים, טבעת ומובנית דומה של Waldeyer הלימפה לאיברים להמשיך להתמיד הroughout חיים 6. בניגוד לבני אדם, עכברים לשמור NALT לאורך כל החיים, ובכך לספק מודל חיה נוח לחקר המערכת החיסונית שמקורם בתוך הסינוסים האף 11.
תרבויות של תא יחיד המתלים של NALT לא מעשית בשל תשואות נמוכות של תאים mononuclear. עם זאת, ביולוגיה NALT ניתן לבדוק על ידי culturing vivo לשעבר של איבר שלם, בשיטה זו יש יתרון נוסף של שמירה על הרקמה הטבעית. עבור במחקרים vivo, מודלים בנוקאאוט הצגת פגמים גנטיים מוגבל NALT לא זמין כרגע בשל הבנה לקויה של מסלול ההתפתחות. לדוגמה, בעוד lymphotoxin למוצרי אלפא עכברים בנוקאאוט התנוון NALT, תיקונים של Peyer, בלוטות לימפה הפריפריה, דנדריטים ותאי זקיקי הלימפה ורקמות אחרות שינו גם אלה מניפולציות גנטיות בעכברים 12,13. כחלופה עכברים בנוקאאוט גנים, עמ 'אבלציה כירורגיתermanently מבטלת NALT מן המעבר באף מבלי לפגוע ברקמות אחרות. מודל העכבר וכתוצאה מכך נעשה שימוש כדי ליצור קשרים בין התגובות NALT ו החיסונית לחיסונים 1,3. אוסף סדרתי של נסיוב, רוק, שטיפות האף הפרשות הנרתיק הכרחי להקמת בסיס של תגובות מארחים את החיסון, תוך כדי התגובה החיסונית שמקורם ישירות NALT שניתן לאשר על ידי תרביות רקמה. ההליכים הבאים מתארים את הניתוחים, תרבות רקמות ואיסוף המדגם יש לבחון מקומיים מערכתית התגובה החיסונית לחיסון הלחות (IN) אפי.
Protocol
1. אוסף culturing NALT ו
- להרדים עכברים באמצעות הדרכה IACUC אושרה. הימנעו שימוש הרדמה שאיפה שעשויים להשפיע NALT. העברת עכברים כדי סביבת העבודה מזוהם או biosafety הממשלה. הסר את הלסת התחתונה של העכבר ולנקות את השטח החיך העליון עם מגבונים אלכוהול ויוד.
- השתמש 11 מס 'להב כירורגי ידית סכין כירורגית כדי לחתוך בזהירות והבלו החיך העליון, פעל לפי קווי המתאר הפנימי של החותכות עכבר ושיניים טוחנות.
- מקלפים בעדינות את החיך האחורי עם מלקחיים, נזהר שלא לקרוע את החך.
- צעד זה דרוש כדי להפחית את זיהום של תרבויות, והוא נועד לעיבוד חיך מרובים. מקום חיך לתוך בארות בודדים בעמודה הראשונה של צלחת 48-גם סטרילית מראש מלא μL 250 של המדיום תרבות שלמה (37 ° C) בהיקף של RPMI 1640 השלימו עם סרום 10% שור עוברית, 100 מיקרוגרם / מ"ל סטרפטומיצין, 100 ממשק משתמש / mL פניצילין, 50 מיקרוגרם / מ"ל גנטמיציןו 1 מיקרוגרם / מ"ל fungizone / amphotericin. התקשורת צריכה להיות קרבונט שנאגרו אם הם חיך בתרבית CO 5% 2/95% לחות האוויר בחממה (37 ° C), או לחילופין להשתמש HEPES 10 mM pH 7.4, לתרבות 2 ללא CO.
- לשטוף את חיך, להשתמש במלקחיים להעביר את חיך גם עוקב ברציפות, בזהירות הקשה על הצלחת בין הכביסות, עד החיך עבר בסך הכל שמונה שוטף.
- להעביר את חיך לתוך צלחת חדשה 48-גם סטרילי המכיל 250 μL של המדיום, טרי תרבות שלמה (37 ° C) וולס.
- מניחים את לוחות המכילים את חיך תוך 37 ° C חממה culturing לתקופת המחקר.
- איסוף דגימות לניתוח בסביבה נקייה מחיידקים, על ידי העברת 100 μL של המדיום מבארות תרבות לתוך צינורות Eppendorf כל 24 שעות, החלפת עם μL 100 של טרי 37 ° C בינוני התרבות.
- בצנטריפוגה מדיה דגימות תרבות ב XG 380 במשך 10 דקות, 4 ° C, על פסולת גלולה.
- העברת supernatant ממדגם centrifuged כדי טריים צינורות Eppendorf ו לאחסן -20 ° C עד מוכנים לנתח.
- אנטיגן ספציפי IgG, IgM, IgA ו, או ציטוקינים המופרשים נמדדים רקמות תרבות supernatants ידי אנזים צמודות מבחני תקן immunosorbent (ELISA).
2. אבלציה כירורגית של NALT
- נשים BALB / C עכברים, 7 עד 9 שבועות של גיל, הם נושאים ראויים, אבל זנים אחרים יתקבלו אף הן. לספק ג'ל דמוי מזון רטוב שלושה ימים לפני הניתוח להסתגל העכבר תחליף מזון ושתייה תנוהל שלאחר הניתוח.
- ניהול טיפה אחת של משככי כאבים Metacam הקלה (1.5 מ"ג / מ"ל או 0.05 מ"ג / ירידה) אל תוך חלל הפה לפני הניתוח.
- להרדים עכברים באמצעות הדרכה IACUC אישר, למשל, עם קטמין, acepromazine, תערובת xylazine (KAX) ולהחיל משחה וטרינר Puralube על העיניים כדי למנוע התייבשות. הימנעו שימוש הרדמה שאיפה שעשויים להשפיע NALT.nesthesia שניתן לאשר על ידי בהעדר תגובה רפלקס צביטה עדינה של האצבעות.
- ניהול 1 מ"ל מי מלח (0.9% נתרן כלוריד USP הזרקה) תת עורית בין השכמות באמצעות מחט מד 22-28 ו המזרק על מנת למנוע התייבשות הפוטנציאל של העכבר לאחר הניתוח. גם לנהל 0.1 מ"ל של Respiram תת עורית בין השכמות באמצעות מחט מד 22-28 ו המזרק כדי לקדם את הנשימה בריא במהלך ואחרי הניתוח.
- לספק תמיכה תרמית העכבר במהלך כל המניפולציות הבאות.
- מניחים את העכבר הרדים במצב שכיבה, ולהשתמש שתי לולאות נפרדות של תפר כירורגי סביב החותכות העליונות והתחתונות כדי לחטט בעדינות לפתוח את הפה, חושף את החיך העליון.
- שימוש בלהב כירורגי מס '11 לעשות חתך של כ 3 מ"מ אורך עד קו האמצע של החיך העליון באתר של NALT.
- הכנס microcurette 0.5 מ"מ לתוך החתך ובעדינות לגרד את הקצוות מתחת ללשבש את NALT.
- לצרוב את החתך כדי לעצור את הדימום עם לולאה קנס ישירות על יחידת כויה תרמית.
- המשך תמיכה תוך תרמית העכבר משחזרת לתודעה פעילות מלאה.
- ספק עכבר עם תת עורי עד שלוש פעמים ביום, מלוחים 1 מ"ל לכל זריקה בין השכמות, כדי למנוע התייבשות כמו משככי כאבים הכרחי אוראלי פעם ביום למשך 3 ימים ניתוח פוסט. לקבוע התייבשות על ידי ביצוע בדיקת אוהל העור כדי לבדוק turgor העור. לתפוס את עור ופרווה בין עצמות הכתפיים, כך הוא צמודות למעלה. אם העור מהר חוזר למצב נורמלי, הקודמת, העכבר אינו מיובש. אם העור נותר גבוה ונע לאט, העכבר נמצא במצב של התייבשות דורש מלוחים. לספק מזון רטוב לפחות שלושה ימים לאחר הניתוח, כדי לאפשר מספיק זמן להתאוששות.
- לפני כל הליך הניסוי, עכברים לצפות במשך 8-10 ימים על ידי מעקב אחר עלייה במשקל. משקל העניים התאוששותבדרך כלל מעיד על החיך ריפוי שלם, אלה עכברים יש מחשבון מחקרים נוספים.
3. הכנת NALT עבור היסטולוגיה והערכת ההצלחה של ניתוח NALT
- הצלחת הניתוח NALT יש לוודא על ידי היסטולוגיה כמתואר להלן. לאחר השלמת כל מחקרים ניסיוניים, להכין עכברים for collections הגולגולת ידי והרדמת חסד באמצעות הדרכה IACUC אושרה. הימנעו שימוש הרדמה שאיפה שעשויים להשפיע NALT.
- לתפוס את העורף של העכבר להרדים. הסר את הלסת התחתונה נמוכה יותר משאר הגולגולת ידי לגזום את התהליכים condylar עם מספריים על שני הצדדים.
- החל בעורף, להסיר את העור והפרווה מהגולגולת ידי לאט קילוף וחיתוך כלפי הצד הגחוני של הגולגולת.
- מוציאים בזהירות את העור סביב אזור האף לגזור את העור של קצה החוטם להסיר לחלוטין.
- לנתק את הגולגולת מן שנינות חוליותחה חיתוך של המספריים.
- הכנס מספריים אל מגנום foramen וחותכים באמצע הגולגולת לאורך קו האמצע כדי לאפשר חלחול של פורמלין לתוך הרקמות הרכות במהלך קיבעון.
- תיקון הגולגולת של 10% נייטרלי שנאגרו פורמלין (NBF) במשך 24 שעות בטמפרטורת החדר.
- כדי decalcify, הצב את המדגם קלטת נפרדת, עטופה בתחבושת כדי למנוע Rexyn מלגעת העצם, בבקבוק בתערובת חומצה פורמית. דגירה במשך 12 שעות בטמפרטורת החדר, ולאחר מכן לשטוף ברציפות תחת מי ברז למשך כ 20 דקות.
- חתוך את המדגם כדי מחצה ו האחרונות מסלולים עין עם סכין גילוח.
- לדוגמה קלטת יכול להיות מאוחסן במשך לטווח קצר ב NBF 10%.
- מניחים על גבי מעבד מדגם רקמות לעיבוד לילה. הדבר נעשה כדי להסיר המים ממדגם לקראת הטבעה פרפין.
- הסרה של רקמת מעובד להטביע בבלוק פרפין עם החרטום כלפי מטה, ולאפשר לו להתקרר.
- חתוך Rough 15 מיקרומטר חתכים של הבלוק עם microtome אוטומטי, מתקרב המיקום המשוער של NALT, ולאחר מכן המשך קיצוץ של 5 מיקרומטר חלקים להרכבה על גבי שקופיות זכוכית אמבטיה 44.3 ° C מים.
- Hematoxylin ו eosin (H & E) מכתים היסטולוגיה יש להשתמש כדי להעריך אבלציה NALT.
4. אוסף של דגימות ביולוגיות של עכברים
4.1 סרום
- בזהירות להעלאת טמפרטורת הגוף עם מנורת חום יגביר את זרימת הדם. איסוף דם על ידי מוכנים לעצור וריד הזנב לרוחב עם להב כירורגי. אפשר לטפטף דם באופן חופשי לתוך הצינור מפריד סרום Microtainer.
- להפעיל לחץ עדין על ניק עם חומר סופג, כגון גזה או מגבת, כדי לעצור את זרימת הדם.
- לאפשר לדם להיקרש בתוך Microtainers למשך 30 דקות, ואז סרכזת בין 6-15 גרם 1000 x לפחות 90 שניות.
- העברת להפריד סרום מ Microtainer לתוך צינור Eppendorf נקיאחסון ב -80 ° C.
4.2 הרוק
- החזק את העכבר הרדים אנכית תוך pipetting 20-30 פוספט סטרילית μL בופר סליין (PBS) בין הלחי קו החניכיים. איסוף הרוק בדילול מלא על ידי הפניית עצה פיפטה בין הלחי ואת קו החניכיים.
- להעביר את הרוק בדילול מלא לצינור טרי המכיל 10 μL של מעכבי פרוטאז חנות 2x ובו -20 ° C.
4.3 הפרשות האף
- להרדים העכבר לפני איסוף הפרשות האף באמצעות מאושר הדרכה IACUC. הימנעו שימוש הרדמה שאיפה שעשויים להשפיע NALT.
- מחזיק את העכבר אנכית, בזהירות פיפטה 30 μL של PBS סטרילי נחיר אחד ולאסוף לשטוף מן הנחיר השני.
- העברת לשטוף את צינור חדש המכיל 10 μL של מעכבי פרוטאז חנות 2x ובו -20 ° C.
4.4 הפרשות הנרתיק
- הכנס את קצה micropipette לתוך הפתח של הדואר הפות של עכבר המתת חסד, יש לשטוף את הנרתיק עם μL 50 סטרילית של PBS לאסוף את כל הנוזל על ידי micropipette.
- העברת לשטוף את צינור חדש המכיל 10 μL של מעכבי פרוטאז חנות 2x ובו -20 ° C.
5. אנטיגן ספציפי נוגדנים או ציטוקינים בדגימות שנאספו ניתן למדוד ELISA או שיטה אחרת, כמותית.
6. נציג תוצאות
איור 1 מספק סכמה כללית של שלבים עם עיבוד רקמות NALT המכיל ניתוח vivo לשעבר. באיור 2 (A, B), בגודל של החיך מוצג, כמו גם את מיקום החתך במהלך ניתוח אבלציה (א '), כפי שעולה הקו המקווקו. המיקום של NALT מסומנים על ידי חצים באזור מלתעה על החיך hematoxylin מוכתם נכרת באיור 2 (ג), מראה הרקמות מקבילים.
איור 3מציג את שלבי הניתוח הפרעה NALT, מראה החשיפה של החיך העליון עבור גישה NALT (א, ב), אבלציה (C), ו צריבה סופית של חתך (ד '). טיפוסי H & E חתך של אזור הסינוסים באף סביב NALT לפני הניתוח מוצג באיור 3E, תוך דימוי של שיבוש NALT ידי microcurette מיד לאחר הניתוח מופיע איור 3F. לאפשר מספיק זמן החלמה מניתוח, החתכים יש לסגור את חלל האף ללא NALT (איור דור 3).
תוצאות הניסוי אופייניות מתקבל על ידי שימוש בטכניקות אלה מוצגים בתרשים 4, השוואת בתרבית רקמה supernatants דגימות ביולוגיות מן המחקר של החיסון למקטע staphylococcal (STEBVax). עכברים ניתנו STEBVax על ידי אפי (IN) או intraperitoneal (IP) מסלולים. חיסון גובשה עם משלים, המפעיל חיוג כמו 4 הקולטן מסלול 3,1 4, בקרות קיבלו רק מלוחים או חיסון ללא אדג'ובנט. NALT תרבותי לקבל קבוצות הניסוי מופרש אנטיגן ספציפי נוגדנים לתוך מדיום זה היה למדידה ELISA. בדוגמה זו (איור 4 א), התוצאות מצביעות על כך את הסכומים הגדולים ביותר של IgA שוחררו על ידי NALT שהתקבלו בעכברים שחוסנו בעבר עם חיסון בשילוב עם משלים למקטע.
דגימות ביולוגיות (כמו הרוק, סרום, הפרשות האף, הפרשות וגינליות) שנרכשו שליטה או NALT ללא עכברים ניתן להשתמש לפרופיל בתגובה החיסונית vivo כדי אנטיגנים האף לצורך השוואה עם תוצאות תרביות רקמה. באיור 4 ב, IgA ו IgG התגובות אליהם החיסון ירדו באופן משמעותי ללא NALT תפקודית. רמות של אנטיגן ספציפי IgA היו בדרך כלל יותר מ IgG בהפרשות הריריות (רוק, שטיפות האף) של עכברים מחוסנים.
upload/3960/3960fig1.jpg "/>
באיור 1. סכמטי של אוסף NALT ו culturing vivo לשעבר.
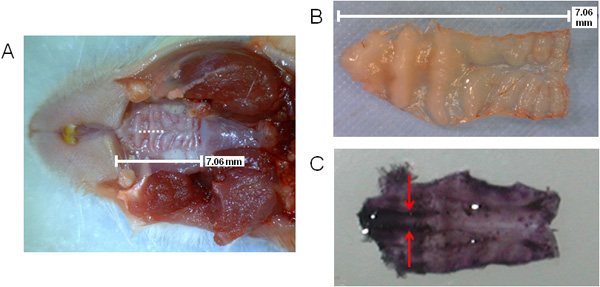
איור 2. ויזואליזציה של החיך העכבר המציין את מיקום החתך NALT וניתוח. הגודל והמיקום של החיך העליון עם חתך הניתוח מצוין על ידי קו מקווקו (); החיך העליון נכרת (ב) או מוכתמים ב hematoxylin (C) כדי להציג את NALT במקביל באזור מלתעה של החיך (סגול כהה צבעונית בצד הקדמי של החיך ). NALT מסומנים על ידי חצים.
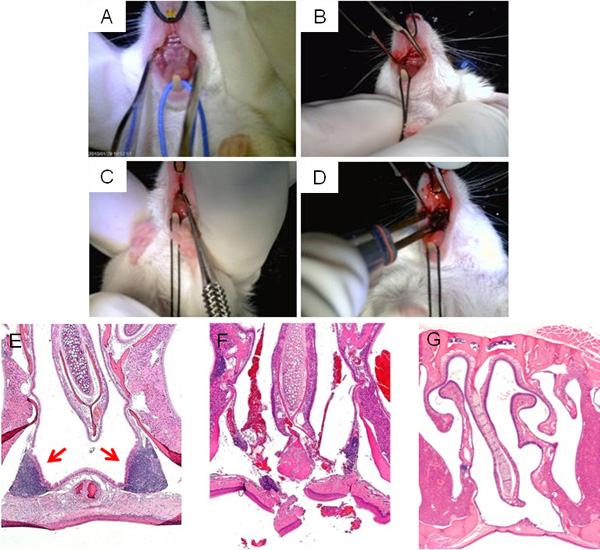
איור 3. הפרעה NALT כירורגי. השלבים העיקריים של הניתוח הפרעה NALT: תצוגת פרקדן על החיך העליון העכבר לפני הניתוח (); חתך קו האמצע עשה על החיך העליון כדי לגשת NALT (ב); בדיקה microcurette מוכנס דרך חתך קו האמצע כדי לשבש את המבנה NALT בtegrity (ג); צריבה של חתך בסיום הניתוח (ד '). תמונות מיקרוסקופיות של חללי האף, מוכתמים H & E, לפני הניתוח (E), מיד לאחר הניתוח (ו); ו נרפא בהצלחה, NALT ללא עכבר (G).
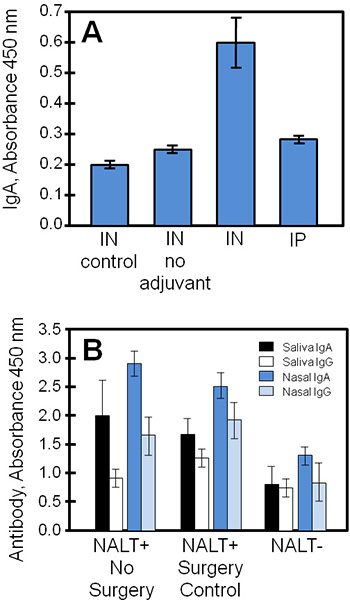
איור 4. חיסון נוגדנים ספציפיים של NALT רוק תרבותי, ולאחר הפרשות האף שנאספו עכברים שחוסנו. עכברים שליטה NALT ללא נורמלי או חוסנו IN או IP עם STEBVax, דגימות ביולוגיות שנאספו. רמת הנוגדנים של דגימות בשלושה עותקים נמדדו באמצעות ELISA. (א) NALT הוצאו עכברים שליטה (לא לטפל באמצעות ניתוח) ותרבותיים לבחון תגובות נוגדנים. תגובת חיסון ספציפי IgA בתרבות עבור בעכברים שחוסנו היה שונה מבחינה סטטיסטית בין הפקדים (סטודנט של מבחן t, p ≤ 0.01, בהשוואה ל משלים אין חיסון או לא). (ב) שיבוש NALT צימצמה באופן משמעותי תגובות נוגדנים ספציפייםאליהם החיסון. לא היו הבדלים משמעותיים בין רמת הנוגדנים הספציפיים של NALT ו NALT + קבוצות (אין ניתוח ניתוח או שליטה) עבור כל ההשוואות מלבד תוצאות רוק IgG (סטודנט של מבחן t, p ≤ 0.05).
Discussion
הצגנו שיטות קולקטיביות על פיתוח מודל החיה, קבלת דגימות ביולוגיות, מבחני לבחינת NALT הקשורים התגובה החיסונית 1-4. ישנם גורמים נוספים שיש להביא בחשבון בעת ביצוע שיטות אלה. טכניקות סטנדרטיות סטריליים לניתוח ותרבות רקמה יש ללכת. שילוב של סוכנים אנטיבקטריאלי נגד פטריות שימוש במהלך הבידוד ותרבות, כמו גם שמירה על מכשירים מעוקרים, אזור העבודה, ואת חיך מחוטאות תפחית את הסיכון של זיהום. בדיקת הרוק, האף דומים דגימות הפרשת הריריות יש לבדוק על אפשרות של זיהום בדם, כמו נוגדנים בסרום נמצאים בדרך כלל בריכוזים גבוהים יותר. יתר על כן, ההפרשות הריריות צריך רק להיות מדולל במעט לניתוח כי ריכוזים נמוכים יותר של נוגדנים נמצאים דגימות אלה לעומת בסרום.
עכברים יש לשמור על חם מיד לאחר הניתוח מראשלפרוק היפותרמיה הנגרמת הפוטנציאל הרדמה. עכברים מנוחה לסירוגין משני שלהם במהלך ההחלמה שלאחר הניתוח כדי למזער נשימה סדירה. ניתוח יעיל יותר עם שלושה אנשים עובדים יחד כדי להשלים את המשימות הבאות: 1 ביצוע הניתוח, 1 כדי לסייע מחזיק את הפה פתוח, ואחד לספק לאחר ניתוח טיפול כמו העכברים להתאושש מן ההרדמה.
יש צורך להשתמש ב H & E מכתים של חתכים הגולגולת בסוף כל ההליכים או מחקרים ניסויים כדי לוודא את הצלחת הניתוח על כל עכבר. ניתוח התוצאות האפשריות הן: אבלציה NALT מלא בין שתי המדינות, אבלציה שלם, או NALT ללא פגע. מאחר שלא כל הניתוחים תגרום לאובדן מוחלט של NALT, בעלי חיים עם NALT שיורית או תמים יכול לשמש הבקרה הפנימית. תוצאה נוספת היא כי הפוטנציאל החיך לא מצליח לרפא לחלוטין, משאיר פתח המחבר בין האף לבין הפה עששת. לא מושלםהריפוי של החיך תגרום משקל נמוך וכישלון לשגשג, אלה אנשים יש להסיר מחקרים.
בחינת התגובות החיסון הראשון עם מודל העכבר ישמש להקמת תפקיד NALT בתוצאות המחקר המיועד (תגובת נוגדנים, הישרדות וכו '). הסרה בניתוח של NALT מאפשר קביעת תרומות באף חסינות מקומית ומערכתית. הגישה הכירורגית המתוארת כאן היא השיטה הישירה ביותר להשגת במודל עכבר ללא NALT. בחר לדפוק הקצוב מודלים העכבר דווחו NALT חוסר, אבל החיות הללו הם גם חסר ציטוקינים או כמוקינים החיוניים להתפתחות רקמות הלימפה משניים אחרים, ועלול להכיל פגמים נוספים 12,13. יתר על כן, השיטות המתוארות כאן פותחו לבחינת היבטים שונים של התגובה החיסונית שמקורם בתוך מעברי האף. תוצאות הניסוי שלנו מבוססים על מחקרים באמצעות palat העליון כולוהדואר של העכבר על תרביות רקמה, אם כי יתכן כי ניתן יהיה להשתמש בחלקים. לבסוף, המודל NALT תרבותי שימושי לביצוע ניסויים לחלוטין בתרבות רקמות.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
תמיכה סופק על ידי בקטון דיקינסון טכנולוגיות. הדעות המובאות הגשת זה הם אלה של הכותבים ואינם מתיימרים לשקף את המדיניות הרשמית של ממשלת ארה"ב. המחקר נערך בהתאם לחוק לרווחת בעלי חיים וכן חוקים ותקנות פדרליים אחרים הקשורים בחיות וניסויים מעורבים בעלי חיים ועקרונות האמורים מדריך לטיפול ושימוש בחיות מעבדה, המועצה הלאומית למחקר, 1996. המתקן שבו המחקר נערך באופן מלא הוא מוכר על ידי האגודה הערכת הסמכה של מעבדה בעלי חיים טיפול הבינלאומי.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| נירוסטה סכין כירורגית סטריליות, מס '11 | Miltex | 4-311 | |
| ידית הסכין, מס '3 | Miltex | 4-7 | |
| 48 גם צלחות תרבית תאים | שחקן המשנה | 3548 | |
| RPMI 1640 | Invitrogen | 11875-093 | |
| בסרום שור עוברית, חום מומת | Gibco / Invitrogen | 16000-044 | קונצרט כלשהו הסופי: 10% לפי נפח בתקשורת תרבות |
| סטרפטומיצין סולפט | סיגמא | S9137 | קונצרט כלשהו סופי: 100 מיקרוגרם / מ"ל |
| פניצילין | סיגמא | P7794 | קונצרט כלשהו סופי: 100 UI / ml |
| גנטמיצין | Sigma-Aldrich | G1397-10 מ"ל | קונצרט כלשהו סופי: 50 מיקרוגרם / מ"ל |
| Fungizone | Gibco / Invitrogen | 15290-018 | קונצרט כלשהו סופי: 1 מיקרוגרם / מ"ל |
| HEPES | Sigma-Aldrich | H0887 | קונצרט כלשהו סופי: 10 מ"מ |
| Eppendorf צינורות Microcentrifuge | Eppendorf | 022364111 | |
| נוטרה ג'ל שרי מזון עכבר בטעמים רטוב | ביו מגישים | S4798 מגשים | |
| Metacam | Boehringer Ingelheim | 601531000 | טיפה אחת של השעיה מ"ג / מ"ל 1.5 שבעל פה |
| קטמין | פייזר | 00856440301 | סופי משותףNC: 6.06 מ"ג / מ"ל |
| Acepromazine | Vedco | VEDC207 | סופי קונצרט כלשהו: 0.061 מ"ג / מ"ל |
| Xylazine | לויד | 4811 | סופי קונצרט כלשהו: 0.667 מ"ג / מ"ל |
| Puralube משחה וטרינר | Pharmaderm לבריאות בעלי חיים | 1621 | |
| 0.9% נתרן כלורי להזרקה USP | בקסטר | 2B1302 | |
| 0.5 מ"מ Microcurette | Roboz | RS-6350 | |
| מצרב Thermal Unit | גייגר | 150-S/150A-S | |
| עצה החלפת TCU, לופ פיין סטרייט | גייגר | 214 | |
| כירורגי מספריים | |||
| 10% ניטרלי שנאגרו פורמלין | סיגמא | HT501128 | |
| חומצה פורמית | דיג | A119P-4 | מערבבים 426 מ"ל חומצה פורמית למים מהברז 1047 מ"ל, ואז מוסיפים 45 מ"ל Rexyn 101 (ג) |
| Rexyn 101 (ג) | דיג | R231-500 | |
| רקמת-Tek VIP E150/E300 | סאקורה | ||
| רוטרי Microtome | Leica | RM2255 | |
| מאיר חברה Hematoxylin | סיגמא | MHS16-500ml | |
| גיל מס '1 Hematoxylin | סיגמא | GHS116 | |
| Eosin B | סיגמא | 2853 | |
| Microtainer מפריד סרום | BD Medical | 365956 | |
| פוספט שנאגרו מלוחים | 100 מ"מ לאא 2 PO 4, 140 מ"מ NaCl, pH 7.4 | ||
| מעכבי פרוטאז קוקטייל, EDTA ללא | Thermo Scientific | 78415 |
References
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved