Method Article
Überprüfung der Rolle der Nasopharynx-assoziierte lymphoide Gewebe (NALT) in Maus auf Impfstoffe
In diesem Artikel
Zusammenfassung
Methoden zur Beiträge der nasopharyngealen-assoziierte lymphoide Gewebe (NALT) der Nasenschleimhaut und systemische Immunreaktionen von Mäusen zu untersuchen, intranasale Impfungen beschrieben. Wir zeigen einen chirurgischen Eingriff, um eine NALT-abhängige Maus-Modell zu etablieren und Ex vivo Kulturen extrahiert NALT.
Zusammenfassung
Die Nasen-Rachen-assoziierte lymphoide Gewebe (NALT) bei Menschen, Nagern und anderen Säugetieren gefunden, die Immunität in den Nasennebenhöhlen 3.1 beitragen. Die NALT sind zwei parallele glockenförmige Strukturen in der Nasenhöhle oberhalb des harten Gaumens gelegen, und werden für gewöhnlich als Nebenkomponenten der Schleimhaut-assoziierten lymphatischen System 6.4 sein. Innerhalb des NALT diskrete Kammern B und T-Lymphozyten mit Antigen-präsentierenden dendritischen Zellen 4,7,8 durchsetzt. Diese Zellen werden durch eine epitheliale Zellschicht mit M-Zellen, die für die Antigenerkennung verantwortlich Wiederauffindens aus den Schleimhautoberflächen der Luftwege 9,10 eingelagert sind, umgeben. Naive zirkulierenden Lymphozyten durch die NALT sind bereit, zu ersten Begegnungen mit Erregern von Atemwegsinfektionen, 7 reagieren. Während NALT beim Menschen verschwinden im Alter von zwei Jahren weiterhin den Waldeyer-Ring über ähnlich strukturierte lymphatischen Organen zu bestehen thCopyright bezüglich Lebensdauer 6. Im Gegensatz zum Menschen, Mäusen erhalten NALT während des gesamten Lebens, wodurch eine bequeme Tiermodell für die Untersuchung der Immunantwort mit Ursprung in den Nasennebenhöhlen 11.
Cultures of single-Zellsuspensionen von NALT sind nicht praktikabel wegen zu geringen Ausbeuten von mononukleären Zellen. Jedoch kann NALT Biologie durch ex vivo Kultivierung des intakten Organ untersucht werden, und dieses Verfahren hat den zusätzlichen Vorteil, die natürliche Gewebestruktur. Für die in vivo Studien, sind genetische Defekte Knockout-Modellen präsentiert beschränkt auf NALT derzeit nicht verfügbar wegen einer schlechten Verständnis der Entwicklungsweg. Während zum Beispiel Lymphotoxin-α-Knockout-Mäusen NALT verkümmert sind, werden die Peyer-Plaques, peripheren Lymphknoten, follikulären dendritischen Zellen und anderen lymphatischen Geweben auch in diesen genetisch veränderten Mäusen 12,13 verändert. Als Alternative zur Gen-Knockout-Mäusen, chirurgische Ablation S.ermanent eliminiert NALT aus dem Nasengang ohne Auswirkungen auf andere Gewebe. Das resultierende Mausmodell wurde verwendet, um Beziehungen zwischen NALT und Immunreaktionen auf Impfstoffe 1,3 herzustellen. Serielle Sammlung von Serum, Speichel, Nasenspülungen und Vaginalsekret ist die zum Nachweis der Grundlage der Host auf Impfungen, während Immunantworten, die direkt aus NALT durch Gewebekultur bestätigt werden kann. Die folgenden Verfahren beschreiben die Operationen, Gewebekulturen und Probenentnahme notwendig, um lokale und systemische humorale Immunantworten zu intranasal (IN) Impfung zu untersuchen.
Protokoll
1. NALT Sammlung und Anzucht
- Einschläfern Mäusen unter Verwendung genehmigt IACUC Führung. Vermeiden Sie die Verwendung von Inhalations-Anästhetika, die NALT beeinflussen können. Übertragen Mäusen zu einer aseptischen Arbeitsbereich oder Biosicherheitswerkbank. Entfernen Sie den Unterkiefer des Maus und reinigen Sie den oberen Gaumen mit Alkohol und Jod Tücher.
- Verwenden Sie eine chirurgische Klinge Nr. 11 in der chirurgischen Messergriff zu sorgfältig geschnitten und Verbrauchssteuern den oberen Gaumen, indem Sie die Innenkontur der Maus Schneidezähne und Backenzähne.
- Vorsichtig abziehen der Gaumen mit einer Pinzette vorsichtig ab, ohne zu reißen, um den Gaumen.
- Dieser Schritt ist notwendig, um eine Kontamination der Kulturen zu reduzieren und zum Verarbeiten mehrerer Gaumen gestalten. Platz Gaumen in einzelne Wells in der ersten Spalte einer sterilen 48-Well-Platte mit 250 ul vollständige Kulturmedium vorgefüllt (37 ° C), bestehend aus RPMI 1640, ergänzt mit 10% fötalem Rinderserum, 100 ug / ml Streptomycin, 100 UI / ml Penicillin, 50 ug / ml Gentamicinund 1 pg / ml Fungizon / Amphotericin. Die Medien sollten basisch gepuffert, wenn Gaumen in einem 5% CO 2/95% feuchter Luft Inkubator (37 ° C), oder nutzen Sie alternativ 10 mM HEPES pH 7,4, für Nicht-CO 2-Kultur gezüchtet werden.
- Um den Gaumen zu waschen, verwenden Pinzette Gaumen in jedem aufeinanderfolgenden gut in einer Reihe zu bewegen, vorsichtig Ausklopfen zwischen Wäschen, bis der Gaumen mit insgesamt acht Wäschen unterzogen wurde.
- Übertragen Sie die Gaumen in eine neue sterile 48-Well-Platte mit 250 ml frisches, komplettem Kulturmedium (37 ° C) in Brunnen.
- Legen Sie die Platten mit den Gaumen in ein 37 ° C Inkubator zur Kultivierung für die Dauer der Studie.
- Entnehmen Sie die Proben für die Analyse durch die Übertragung aseptisch 100 ul Medium aus Kultur-Wells in Eppendorf-Röhrchen alle 24 Stunden, ersetzen mit 100 ul frischen 37 ° C Kulturmedium.
- Zentrifugation der Kulturmedien Proben bei 380 × g für 10 Minuten, 4 ° C, um Zelltrümmer zu pelletieren.
- Den Überstand aus dem zentrifugierten Probe an die frische Eppendorf-Röhrchen und bei -20 ° C bis zum Gebrauch zu analysieren.
- Antigen-spezifische IgG, IgM und IgA oder sezerniert Zytokine werden in Gewebekultur-Überständen durch Standard-Enzyme-linked Immunosorbent Assays (ELISA) gemessen.
2. Chirurgische Ablation von NALT
- Weibliche BALB / c Mäuse, 7-9 Wochen alt sind, eignen sich Themen, aber auch andere Stämme sind ebenfalls akzeptabel. Geben gelartige Nassfutter 3 Tage vor der Operation, um Maus, um Nahrung und Wasser ersetzen, die nach der Operation verabreicht wird, akklimatisieren.
- Verwalten Sie einen Tropfen Metacam Schmerzmittel (1,5 mg / ml oder 0,05 mg / Drop) in die Mundhöhle vor der Operation.
- Anesthetize Mäusen unter Verwendung genehmigt IACUC Führung, zum Beispiel mit einer Ketamin, Acepromazin, und Xylazin Gemisch (KAX) und gelten Puralube Vet-Salbe auf die Augen ein Austrocknen zu verhindern. Vermeiden Sie die Verwendung von Inhalations-Anästhetika, die NALT beeinflussen können. Einnesthesia kann durch das Fehlen von Reflex auf einem sanften Einklemmen der Zehen bestätigt werden.
- Administrieren 1 ml Kochsalzlösung (0,9% Natriumchlorid-Injektion USP) subkutan zwischen die Schulterblätter mit einer 22-28 Gauge-Nadel und Spritze, um mögliche Austrocknung der Maus nach der Operation zu verhindern. Auch verabreichen 0,1 mL Respiram subkutan zwischen die Schulterblätter mit einer 22-28 Gauge-Nadel und Spritze an gesunde Atmung während und nach der Operation zu fördern.
- Stellen eine thermische Unterstützung für die Maus bei allen nachfolgenden Manipulationen.
- Setzen Sie den narkotisierten Maus in Rückenlage, und verwenden Sie zwei getrennte Schleifen von chirurgischen Naht um den oberen und unteren Schneidezähne zu hebeln den Mund öffnen, Freilegung der oberen Gaumen.
- Verwenden Sie einen Nr. 11 Skalpell, um einen Einschnitt von etwa 3 mm in der Länge entlang der Mittellinie des oberen Gaumen in der Stelle des NALT machen.
- Legen Sie eine 0,5 mm microcurette in den Einschnitt und vorsichtig unter die Kanten zu kratzenstören den NALT.
- Cauterize den Einschnitt, um eine Blutung mit einem geraden feinen Schleife auf einem Thermokauter Gerät zu stoppen.
- Weiter thermische Unterstützung während Maus wieder zu vollem Bewusstsein und Aktivität.
- Geben Maus mit Kochsalzlösung subkutan bis zu dreimal am Tag, 1 ml pro Injektion zwischen den Schulterblättern, zu Austrocknung und bei Bedarf orale Schmerzmittel verhindern einmal täglich für 3 Tage nach der Operation. Bestimmen Sie Austrocknung der Haut durch Ausführen eines Zelt-Test für Hautturgor überprüfen. Fassen Sie die Haut und das Fell zwischen den Schulterblättern Schaufeln, so dass diese Tented auf. Wenn die Haut schnell wieder in den normalen, vorherigen Position, ist die Maus nicht dehydriert. Wenn die Haut bleibt erhöht und bewegt sich langsam, ist die Maus in einem Zustand der Dehydrierung und erfordert Kochsalzlösung. Geben Sie Nassfutter für mindestens drei Tage nach der Operation, um genügend Zeit zur Erholung zu gestatten.
- Vor der Durchführung der experimentellen Verfahren, beobachten Mäuse für 8-10 Tage durch das Verfolgen Gewichtszunahme. Schlechte Gewicht Erholungnormalerweise darauf hin, unvollständige Gaumen Heilung, und diese Mäuse sollten von weiteren Studien zurückgezogen werden.
3. Vorbereiten NALT für Histologie und die Beurteilung des Erfolges NALT Chirurgie
- Der Erfolg der Operation NALT muss durch Histologie festgestellt, wie unten beschrieben. Nach Abschluss aller experimentellen Studien, bereiten Mäuse für die Schädel-Sammlung von euthanizing Verwendung genehmigt IACUC Führung. Vermeiden Sie die Verwendung von Inhalations-Anästhetika, die NALT beeinflussen können.
- Fassen Sie den Nacken der Maus eingeschläfert. Entfernen Sie den Unterkiefer aus dem Rest des Schädels durch Schnippeln durch die Gelenkfortsätze mit einer Schere auf beiden Seiten.
- Beginnend am Nacken, entfernen Sie die Haut und das Fell aus dem Schädel durch langsames Schälen und Schneiden in Richtung der ventralen Seite des Schädels.
- Entfernen Sie vorsichtig Haut um den Nasenbereich und schnippeln die Haut von der Spitze der Schnauze vollständig zu entfernen.
- Nehmen Sie den Schädel aus den Wirbeln Witzha snip der Schere.
- Legen Schere in das Foramen magnum und schneiden auf halber Höhe des Schädels entlang der Mittellinie gegen die Permeation von Formalin in die Weichteile während der Fixierung ermöglichen.
- Fix Schädels in 10% neutral gepuffertem Formalin (NBF) für 24 Stunden bei Raumtemperatur.
- Um entkalken, legen Sie die Probe und separaten Kassette, eingehüllt in Gaze zu Rexyn vom Berühren des Knochens, in der Flasche mit der Ameisensäure Mischung zu verhindern. Inkubieren Sie für 12 Stunden bei Raumtemperatur, dann kontinuierlich unter fließendem Wasser spülen für ca. 20 Minuten.
- Schneiden Sie die Probe auf die Vergangenheit Septum und das Auge Umlaufbahnen mit einer Rasierklinge.
- Sample und Kassette kann für kurzfristige in 10% NBF gespeichert werden.
- Platzieren Sie Probe auf eine Gewebe-Prozessor für die Verarbeitung über Nacht. Dies geschieht, um Wasser aus der Probe zu entfernen, in Vorbereitung auf Paraffineinbettung.
- Entfernen Sie verarbeiteten Gewebe, in einem Paraffin-Block mit der Schnauze nach unten einbetten, und lassen Sie es abkühlen.
- Trim rough 15 um Querschnitte des Blocks mit einem automatisierten Mikrotoms, nähert sich die ungefähre Lage des NALT, dann weiter Schneiden in 5 um Abschnitte zur Montage auf Glas-Objektträger in einer 44,3 ° C warmes Wasserbad.
- Hämatoxylin und Eosin (H & E)-Färbung Histologie sollte verwendet werden, um NALT Ablation zu beurteilen.
4. Sammlung von biologischen Proben von Mäusen
4,1 Serum
- Vorsichtig heben die Körpertemperatur mit einer Wärmelampe erhöht den Blutfluss. Blutentnahme durch Nicking die laterale Schwanzvene mit einer chirurgischen Klinge. Lassen Sie das Blut frei tropfen in eine Microtainer Serumtrennröhrchen.
- Drücken Sie vorsichtig auf Nick mit einem saugfähigen Material, wie zB Gaze oder ein Handtuch, um den Blutfluss zu stoppen.
- Lassen Sie die Blutgerinnung in den Microtainer für 30 Minuten, dann zwischen 6-15 x 1.000 g zentrifugieren für mindestens 90 Sekunden.
- Getrennt Serum Transfer vom Microtainer in ein sauberes Eppendorf-Röhrchen fürLagerung bei -80 ° C.
4,2 Saliva
- Halten Sie den narkotisierten Maus vertikal beim Pipettieren 20-30 ul sterilem Phosphat-gepufferter Kochsalzlösung (PBS) zwischen Wange und Zahnfleisch. Sammeln Sie die verdünnte Speichel durch Leiten Pipettenspitze zwischen Wange und Zahnfleisch.
- Übertragen Sie die verdünnte Speichel in ein frisches Röhrchen mit 10 l 2x Protease-Inhibitor und bei -20 ° C.
4,3 Nasensekret
- Einschläfern Maus vor dem Sammeln Nasensekret, mit zugelassenen IACUC Führung. Vermeiden Sie die Verwendung von Inhalations-Anästhetika, die NALT beeinflussen können.
- Halten Sie die Maus vertikal, sorgfältig pipettieren 30 ul sterilem PBS in ein Nasenloch und sammeln spülen aus anderen Nasenloch.
- Übertragen Sie spülen in ein frisches Röhrchen mit 10 l 2x Protease-Inhibitor und bei -20 ° C.
4,4 Vaginalsekret
- Legen Sie die Spitze einer Mikropipette in die Öffnung des the Vulva einer Maus eingeschläfert werden, spülen Sie die Vagina mit 50 ul sterilem PBS und sammeln Sie alle Flüssigkeit durch Mikropipette.
- Übertragen Sie spülen in ein frisches Röhrchen mit 10 l 2x Protease-Inhibitor und bei -20 ° C.
5. Antigen-spezifische Antikörper oder Cytokine in den gesammelten Proben können mittels ELISA oder einem anderen quantitativen Verfahren gemessen werden.
6. Repräsentative Ergebnisse
Abbildung 1 enthält eine allgemeine Schema der Schritte mit der Verarbeitung des NALT-haltige Gewebe für Ex-vivo-Analyse beteiligt. In 2 (A, B), wird die Größe des Gaumens dargestellt, sowie die Lage des den Schnitt während Ablationschirurgie (A), wie durch die gestrichelte Linie angedeutet. Die Lage des NALT sind durch Pfeile in der Prämolaren-Bereich auf einem ausgeschnittenen Hämatoxylin-gefärbten Gaumen in Abbildung 2 (C) und zeigt die parallel Gewebe angegeben.
Abbildung 3werden die erforderlichen Schritte des NALT Störungen Operation zeigt Exposition der oberen Gaumen für den Zugang zu NALT (A, B), Ablation (C) und ein abschließendes Ätzung der Einschnitt (D). Eine typische H & E Querschnitt der Nasenhöhle Umgebung des NALT vor der Operation wird in 3E gezeigt, während ein Bild der NALT Störung durch die microcurette direkt nach der Operation wird in 3F. Ausreichend Zeit zur Erholung von der Operation, sollten die Einschnitte geschlossen werden und der Nasenhöhle frei von NALT (3G).
Typische experimentellen Ergebnisse unter Verwendung dieser Techniken erhaltenen Ergebnisse sind in 4 gezeigt ist, verglichen Gewebekultur-Überständen und biologische Proben aus einer Studie eines Staphylokokken-Impfstoff (STEBVax). Die Mäuse wurden STEBVax durch intranasale (IN) oder intraperitoneale (IP) verabreicht werden. Der Impfstoff wurde mit einem Adjuvans, das die Toll-like Rezeptor 4-Weg 3,1 aktiviert formuliert 4, und Kontrollen wurden nur Kochsalzlösung oder Impfstoff ohne Adjuvans gegeben. Cultured NALT aus experimentellen Gruppen erhalten sezernierte Antigen-spezifische Immunglobuline in Medium, das mittels ELISA messbar war. In diesem Beispiel (Abbildung 4A), zeigen die Ergebnisse, dass die größten Mengen an IgA durch NALT von Mäusen, geimpft, mit einer Subunit-Impfstoff mit Adjuvans erhalten wurden, wurden freigelassen.
Biologische Proben (z. B. Serum, Speichel, Nasensekret, Vaginalsekret) von der Steuerung oder NALT-freien Mäuse erworben werden verwendet, um die in vivo Immunantwort auf Antigene nasal zum Vergleich mit den Gewebekulturen Ergebnisse Profils sein. In 4B Antworten IgA und IgG, um bei der Impfung waren signifikant ohne funktionelle NALT gesunken. Mengen an Antigen-spezifischen IgA waren im Allgemeinen größer als IgG in Schleimhautsekreten (Speichel, Nasenspülungen) der geimpften Mäuse.
upload/3960/3960fig1.jpg "/>
Abbildung 1. Schematische Darstellung der NALT Sammlung und ex vivo kultiviert.
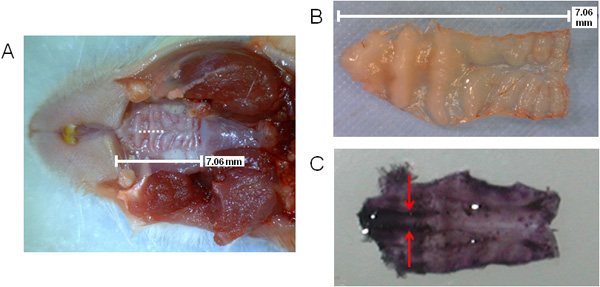
2. Visualisierung der Maus Gaumen, die die Position NALT und Chirurgie Schnitt. Größe und Lage der oberen Gaumen mit einer Operation Schnitt durch die gestrichelte Linie (A) bezeichnet; oberen Gaumen herausgeschnitten (B) oder gefärbt in Hämatoxylin (C), die parallel NALT im Bereich der Prämolaren Gaumen (dunkel gebeizt violett auf vorderen Seite des Gaumens sehen ). NALT durch Pfeile angedeutet.
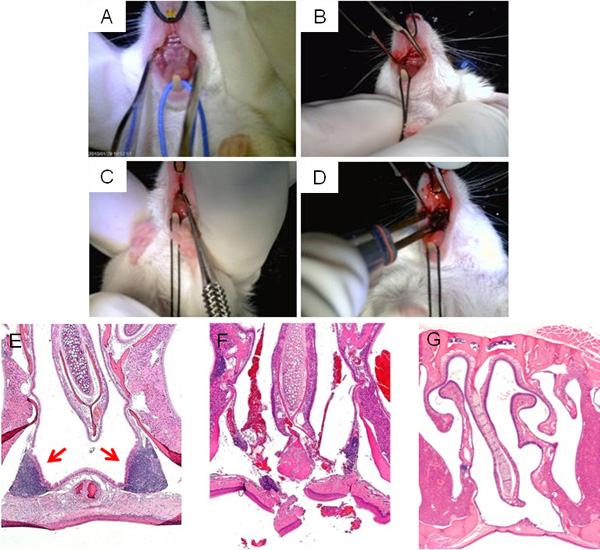
Abbildung 3. Chirurgische NALT Störung. Wichtigsten Phasen der Unterbrechung NALT Chirurgie: Rückenlage Blick Maus oberen Gaumen vor der Operation (A); Medianschnitt am oberen Gaumen gemacht, um die NALT (B) zuzugreifen; microcurette Sonde durch Medianschnitt eingefügt, um Struktur in NALT störenIntegrität (C); Kauterisation der Schnitt am Schluss der Operation (D). Mikroskopische Aufnahmen von Nasenhöhlen, H & E gefärbten, vor der Operation (E); unmittelbar nach der Operation (F) und ein erfolgreich geheilt, NALT-freie Maus (G).
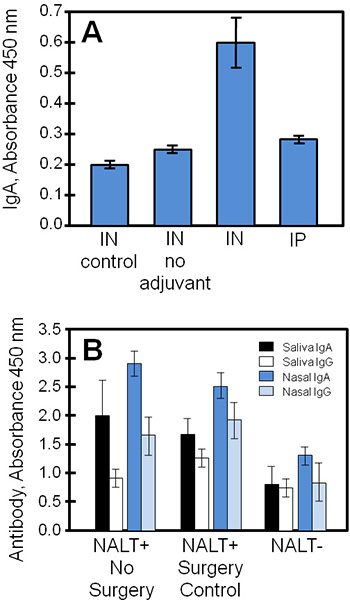
Abbildung 4. Impfstoff-spezifischen Antikörpern aus kultivierten NALT, Speichel, Nasensekret und von geimpften Mäusen gesammelt. NALT-freien oder normalen Mäusen der Kontrollgruppe wurden in IP oder mit STEBVax geimpft und biologischen Proben wurden gesammelt. Antikörper-Konzentrationen der Proben in dreifacher Ausfertigung wurden mittels ELISA gemessen. (A) NALT wurden aus Mäusen der Kontrollgruppe (nicht chirurgisch manipuliert) entnommen und kultiviert, um die Antikörper-Reaktionen zu untersuchen. Der Impfstoff-spezifischen IgA-Antwort in Kultur in geimpften Mäusen war statistisch signifikant von den Kontrollen (Student-t-Test, p ≤ 0,01 im Vergleich zu ohne Adjuvans oder keinen Impfstoff). (B) NALT Störungen wesentlich reduziert spezifischen Antikörper-Antwortenum bei der Impfung. Es zeigten sich signifikante Unterschiede zwischen den spezifischen Antikörper-Spiegel von NALT-und NALT +-Gruppen (keine Operation oder Steuerung Chirurgie) für alle Vergleiche außer Speichel IgG Ergebnisse (Student t-Test, p ≤ 0,05).
Diskussion
Wir haben gemeinsame Verfahren zur Entwicklung eines Tiermodells dargestellt, Erhalten biologischer Proben und Assays zur Untersuchung NALT-assoziierten Immunantwort 1-4. Es gibt weitere Faktoren, die während der Durchführung dieser Verfahren zu prüfen. Standard-sterile Techniken für Chirurgie und Gewebekultur sollten befolgt werden. Eine Kombination aus antibakterielle und antimykotische Mittel bei der Isolierung und Kultur, sowie das Beibehalten der sterilisierten Instrumente, Arbeitsbereich, desinfiziert und Gaumen verwendet werden um das Risiko der Kontamination. Speichel, Nasen-Wäschen und ähnliche Schleimhautsekret Proben sollten für mögliche Kontamination mit Blut untersucht werden, wie Serum-Antikörper in der Regel in höheren Konzentrationen gefunden werden. Ferner sollte Schleimhautsekreten nur geringfügig zur Analyse verdünnt werden, da niedrigere Konzentrationen von Antikörpern, die in diesen Proben im Vergleich zu Serum.
Mäuse müssen warm gehalten werden direkt nach der Operation vor,entlüften Potenzial Anästhesie-induzierten Hypothermie. Alternate Ruhestätte Mäuse auf ihren Seiten während der postoperativen Erholung zu minimieren, unregelmäßige Atmung. Das chirurgische Verfahren ist effizienter mit drei Individuen, die zusammenarbeiten, um diese Aufgaben zu erledigen: eine Durchführung der Operation, ein, um das Halten der Mund offen zu unterstützen, und ein bis postoperative Betreuung bieten als die Mäuse von der Narkose erholen.
Es ist notwendig, H & E Färbung von kranialen Querschnitte am Ende aller experimentellen Verfahren oder Studien, um den Erfolg der Operation für jede Maus benutzen zu überprüfen. Mögliche Chirurgie Ergebnisse sind: vollständige und bilateralen NALT Ablation, Ablation unvollständige oder NALT intakt. Da nicht alle Operationen werden im vollständigen Verlust der NALT, Tiere mit Rest-oder intakt NALT führen können als interne Kontrollen eingesetzt werden. Ein weiteres mögliches Ergebnis ist, dass der Gaumen vollständig zu heilen ausfällt, lassen Sie eine Öffnung Anschluss der Nasenschleimhaut und der Mundhöhle. UnvollständigHeilung der Gaumen wird in geringen Gewichts und Gedeihstörungen führen, und diese Personen müssen aus entfernt werden.
Untersuchen Impfstoff Reaktionen zunächst mit dem Maus-Modell wird dazu dienen, eine Rolle für NALT in der beabsichtigten Studienergebnis (Antikörper-Reaktion, Überleben, etc.) zu etablieren. Chirurgischen Entfernung der NALT erleichtert die Bestimmung der nasalen Beiträge zur lokalen und systemischen Immunität. Die chirurgische hier beschriebene Ansatz ist die direkteste Methode zur Gewinnung eines Maus-Modell ohne NALT. Wählen Knock-out Mausmodellen haben mangels NALT berichtet worden, aber diese Tiere sind auch in Zytokine oder Chemokine wesentlich für die Entwicklung von anderen sekundären lymphatischen Gewebe mangelhaft und bergen mögliche weitere Mängel 12,13. Ferner wurden die hier beschriebenen Verfahren für die Prüfung mehrerer Aspekte der Immunreaktion mit Ursprung in die Nasenwege entwickelt. Unsere experimentellen Ergebnisse beruhen auf Untersuchungen unter Verwendung des gesamten oberen palat BasisE aus der Maus für die Gewebekultur, obwohl es möglich ist, dass die Abschnitte verwendet werden können. Schließlich ist das gezüchtete NALT Modell brauchbar für die Durchführung von Experimenten vollständig in Gewebekultur.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Unterstützung wurde von Becton Dickinson Technologies zur Verfügung gestellt. Ansichten in dieser Vorlage geäusserten Meinungen sind diejenigen der Autoren und erheben keinen Anspruch auf die offizielle Politik der US-Regierung widerspiegeln. Forschung wurde in Übereinstimmung mit dem Tierschutzgesetz und anderen Bundesgesetzen und Verordnungen in Bezug auf Tiere und Experimente mit Tieren und hält sich an Prinzipien in der Anleitung zur Pflege und Verwendung von Labortieren, National Research Council, 1996, durchgeführt. Die Einrichtung, wo diese Forschung durchgeführt wurde vollständig von der Gesellschaft für Evaluierung und Akkreditierung of Laboratory Animal Care International akkreditiert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Edelstahl Steril chirurgische Messer, Nr. 11 | Miltex | 4-311 | |
| Messergriff, Nr. 3 | Miltex | 4-7 | |
| 48-Well-Zellkulturplatten | Costar | 3548 | |
| RPMI 1640 | Invitrogen | 11875-093 | |
| Rinderfötenserum, hitzeinaktiviertem | Gibco / Invitrogen | 16000-044 | Endkonzentration: 10 Vol.% in Kulturmedien |
| Streptomycinsulfat | Sigma | S9137 | Endkonzentration: 100 ug / ml |
| Penicillin | Sigma | P7794 | Endkonzentration: 100 IE / ml |
| Gentamicin | Sigma-Aldrich | G1397-10ml | Endkonzentration: 50 pg / ml |
| Fungizone | Gibco / Invitrogen | 15290-018 | Endkonzentration: 1 pg / ml |
| HEPES | Sigma-Aldrich | H0887 | Endkonzentration: 10 mM |
| Eppendorf Reaktionsgefäße | Eppendorf | 022364111 | |
| Nutra-Gel-Kirschgeschmack Maus Nassfutter | Bio-Serve | S4798-TRAY | |
| Metacam | Boehringer Ingelheim | 601531000 | Ein Tropfen von 1,5 mg / ml Suspension zum |
| Ketamin | Pfizer | 00856440301 | Abschließende CoNC: 6,06 mg / mL |
| Acepromazin | Vedco | VEDC207 | Endkonzentration: 0,061 mg / mL |
| Xylazin | Lloyd | 4811 | Endkonzentration: 0,667 mg / mL |
| Puralube Vet-Salbe | PharmaDerm Tiergesundheit | 1621 | |
| 0,9% Natriumchlorid-Injektion USP | Baxter | 2B1302 | |
| 0,5 mm Microcurette | Roboz | RS-6350 | |
| Thermokauter Einheit | Geiger | 150-S/150A-S | |
| TCU Ersatz-Spitze, gerade Feinkreis | Geiger | 214 | |
| Chirurgische Schere | |||
| 10% neutral gepuffertem Formalin | Sigma | HT501128 | |
| Ameisensäure | Fischer | A119P-4 | Mischen Sie 426 ml Ameisensäure in 1047 ml Leitungswasser, dann fügen Sie 45 ml Rexyn 101 (H) |
| Rexyn 101 (H) | Fischer | R231-500 | |
| Tissue-Tek VIP E150/E300 | Sakura | ||
| Rotationsmikrotom | Leica | RM2255 | |
| Mayers Hämatoxylin | Sigma | MHS16-500ml | |
| Gill Hämatoxylin No.1 | Sigma | GHS116 | |
| Eosin B | Sigma | 2853 | |
| Microtainer Serumtrennröhrchen | BD Medizinische | 365956 | |
| Phosphate Buffered Saline | 100 mM NaH 2 PO 4, 140 mM NaCl, pH 7,4 | ||
| Protease Inhibitor Cocktail, EDTA-free | Thermo Scientific | 78415 |
Referenzen
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten