Method Article
Рассматривая роль носоглотки связанных лимфоретикулярных тканей (NALT) в мышь Ответы на вакцины
В этой статье
Резюме
Методы изучения вклада носоглотки связанных лимфоретикулярной ткани (NALT) для носа и системные иммунные реакции мышей на интраназальных вакцин описаны. Мы показываем, хирургической процедуры, чтобы установить NALT зависит от модели мыши и Бывший естественных условиях Культур извлеченных NALT.
Аннотация
Носоглотки связанных лимфоретикулярной ткани (NALT) у людей, грызунов и других млекопитающих, способствуют иммунитета в носовых пазух 1-3. NALT два параллельных колоколообразной структур, расположенных в носовые проходы над твердого неба, и, как правило, считаются вторичными компонентами слизистой-лимфоидной системы 4-6. Расположенный в NALT дискретные отсеков и Т-лимфоциты перемежаются с антиген-представляющих дендритных клеток 4,7,8. Эти клетки окружены слоем клеток эпителиального интеркалированного М-клетки, которые отвечают за антиген поиск от поверхности слизистой оболочки дыхательных путей 9,10. Наивные лимфоцитов циркулирующей через NALT готовы ответить на первые встречи с возбудителей инфекций дыхательных путей 7. Хотя NALT исчезают люди в возрасте до двух лет, кольца и в аналогично построенных Вальдейерова в органах лимфатической продолжают сохраняться йroughout жизни 6. В отличие от людей, мышей сохранить NALT на протяжении всей жизни, обеспечивая удобную модель животного для изучения иммунных реакций, происходящих в придаточные пазухи носа 11.
Культур одноклеточных суспензий NALT не практично из-за низкой урожайности мононуклеаров. Тем не менее, NALT биологии можно рассматривать экс культивирование естественных условиях интактного органа, и у этого метода есть дополнительное преимущество поддержания естественной структуры тканей. Ведь в естественных условиях исследования, генетические модели нокаутом представления дефектов ограничивается NALT в настоящее время отсутствуют в связи с плохим пониманием путь ее развития. Например, в то время как лимфотоксина-α мышей атрофировались NALT, патчи Пейера, периферические лимфатические узлы, фолликулярные дендритные клетки и других лимфоидных тканей также изменены в этих генетически модифицированных мышей 12,13. В качестве альтернативы мышам ген нокаутом, хирургическое удаление рermanently исключает NALT из носовой ход, не затрагивая другие ткани. В результате мышь модель была использована для установления связей между NALT и иммунные реакции на вакцины 1,3. Последовательный сбор сыворотки, слюна, носовые моет и вагинальных выделений необходимо для создания основы принимающих ответ на вакцинацию, в то время как иммунный ответ, происходящих непосредственно из NALT может быть подтверждено культуре ткани. Следующие процедуры наметить операции, культуры тканей и отбора образцов необходимо изучить местные и системные гуморальный иммунный ответ на интраназально (IN) вакцинации.
протокол
1. NALT сбора и культивирования
- Усыпить мышей с использованием утвержденных IACUC руководства. Избегайте использования ингаляционных анестетиков, которые могут повлиять NALT. Передача мышей асептических рабочей области или биобезопасности кабинета. Снимите нижнюю челюсть мышью и очистить верхнюю часть неба со спиртом и йодом салфетки.
- Используйте № 11 хирургические лезвия в хирургической ручкой ножа аккуратно вырезать и акцизов верхнего неба, следуя внутри контура мышь резцы и коренные зубы.
- Аккуратно отогните неба пинцетом, стараясь не порвать пасть.
- Этот шаг необходим для снижения загрязнения культур и предназначен для обработки нескольких вкус. Место неба в отдельных скважинах в первом столбце стерильных 48-луночного планшета предварительно заполнены 250 мкл полной культуральной среде (37 ° C), состоящей из RPMI 1640 с добавлением 10% эмбриональной телячьей сыворотки, 100 мкг / мл стрептомицина, 100 UI / мл пенициллина, 50 мкг / мл гентамицинаи 1 мкг / мл Fungizone / амфотерицин. СМИ должны быть буфером, если карбонат неба культивируют в 5% CO 2/95% влажного воздуха инкубатор (37 ° C), или же использовать 10 мМ HEPES рН 7,4, для не-CO 2 культуру.
- Для мытья вкус, используйте щипцы для перемещения неба в каждом последующем также в ряд, аккуратно нажав пластину между мойками, до неба прошел в общей сложности восемь стирок.
- Передача неба в новую стерильную 48-луночного планшета, содержащие 250 мкл свежей, полной культуральной среде (37 ° C) в скважинах.
- Поместите чашки, содержащие неба в 37 ° C инкубатор для культивирования в течение всего срока обучения.
- Сбор образцов для анализа асептической передачи 100 мкл среды от культуры скважин в Эппендорф трубы каждые 24 часа, заменяя 100 мкл свежей 37 ° С культуральной среды.
- Центрифуга культуры образцы печатных носителей на 380 мкг в течение 10 минут, 4 ° C, для мусора гранулу.
- Перенести супернатант центрифугируют от образца к свежим труб Eppendorf и хранить при температуре -20 ° C до готовности анализа.
- Антиген-специфические IgG, IgM, IgA и, или выделяются цитокины измеряется в ткани культуральной жидкости по стандартной иммуноферментного анализа (ИФА).
2. Хирургическое Удаление NALT
- Женский BALB / с мышами, от 7 до 9-недельного возраста, пригодные предметы, но и другие штаммы также являются приемлемыми. Обеспечить гелеобразной влажный корм за три дня до операции, чтобы акклиматизироваться мыши к пище и воде замену, которая будет проводиться после операции.
- Администрирование одна капля Metacam боли препаратов (1,5 мг / мл или 0,05 мг / вывода) в полости рта до операции.
- Обезболить мышей с использованием утвержденных IACUC руководства, например, кетамин, acepromazine и ксилазина смеси (KAX) и применить мазь Puralube ветеринара на глаза для предотвращения высыхания. Избегайте использования ингаляционных анестетиков, которые могут повлиять NALT.nesthesia может быть подтверждено отсутствие рефлекса ответ на нежный защемления пальцев ног.
- Администрирование 1 мл физиологического раствора (0,9% раствор натрия хлорида инъекций USP) подкожно между лопатками использованием 22-28 иглой и шприцем для предотвращения потенциальных обезвоживания мыши после операции. Кроме того, управление 0,1 мл подкожно Respiram между лопатками использованием 22-28 иглой и шприцем по пропаганде здорового дыхания во время и после операции.
- Обеспечить тепловой поддержки мыши в течение всех последующих манипуляций.
- Положите под наркозом мыши в горизонтальном положении, а также использовать два отдельных петель хирургического шва вокруг верхних и нижних резцов мягко взломать рот, обнажая верхнее небо.
- Используйте № 11 хирургические лезвия, чтобы сделать разрез приблизительно 3 мм в длину вдоль средней линии верхнего неба в месте NALT.
- Вставьте 0,5 мм microcurette в разрез и аккуратно соскоблить по краямнарушить NALT.
- Прижечь разрез, чтобы остановить кровотечение с прямой тонкой петлей на тепловую единицу прижигания.
- Продолжить поддержку в то время как тепловые мышь возвращается в полном сознании и деятельности.
- Обеспечить мыши подкожно физиологический раствор до трех раз в день, 1 мл на инъекцию между лопатками, чтобы предотвратить обезвоживание при необходимости и устные обезболивающие один раз в день в течение 3 дней после операции. Определить обезвоживание, выполнив тест кожи палатки для проверки тургор кожи. Возьмитесь за кожей и мехом между плечами лопасти так, чтобы она палаточный вверх. Если кожа быстро возвращается к нормальному, предыдущее положение, мышь не обезвожен. Если кожа остается повышенным, и движется медленно, мышь находится в состоянии обезвоживания и требует физиологического раствора. Обеспечить влажные корма, по крайней мере три дня после операции, чтобы обеспечить достаточное время для восстановления.
- До любой экспериментальной процедуры, соблюдать мышей в течение 8-10 дней, отслеживая веса. Плохо восстановления весаобычно указывает на неполное заживление неба, и эти мыши должны быть выведены из дальнейших исследований.
3. Подготовка NALT для гистологии и оценки успешности хирургии NALT
- Успех NALT операции должны быть установлены по гистологии, как описано ниже. После завершения всех экспериментальных исследований, подготовки мышей черепной коллекций эвтаназии с использованием утвержденных IACUC руководства. Избегайте использования ингаляционных анестетиков, которые могут повлиять NALT.
- Возьмитесь за затылок из эвтаназии мыши. Снимите нижнюю челюсть от остальной части черепа на Ножницы по мыщелкового процессов с ножницами с обеих сторон.
- Начиная с затылка, снять кожу и мех с черепом на медленно слезать и резать на вентральной стороне черепа.
- Осторожно снимите кожу вокруг носовой области и отрезать кожу от кончика морды до полностью удалить.
- Снимите черепа с позвонками остроумиега надрез на ножницы.
- Вставить ножницы в большое затылочное отверстие и сократить наполовину черепа по средней линии, чтобы проникновения формалина в мягкие ткани во время фиксации.
- Исправить черепа в 10% нейтральном буферном растворе формалина (НБФ) в течение 24 часов при комнатной температуре.
- Чтобы удалить известковые отложения, поместить образец и отдельные кассеты, завернутый в марлю, чтобы предотвратить Rexyn от прикосновения к кости, в бутылке с муравьиной кислотой смеси. Выдержите в течение 12 часов при комнатной температуре, затем смойте непрерывно в проточной воде в течение примерно 20 минут.
- Обрежьте образца перегородки и прошлое орбиты глаз бритвой.
- Примеры и кассеты могут быть сохранены для краткосрочных на 10% НБФ.
- Поместите образец на ткань на ночь процессор обработки. Это делается для удаления воды из образца в рамках подготовки к парафин вложения.
- Удалить обработанные ткани, использования на парафиновых блоков с мордой вниз, и дайте ему остыть.
- Обрежьте тух 15 мкм сечения блока с автоматизированной микротома, приближаясь к приблизительное местоположение NALT, а затем продолжить резки в разделах 5 мкм для монтажа на стеклах в 44.3 ° C на водяной бане.
- Гематоксилином и эозином (H & E) гистологической окраски должны быть использованы для оценки NALT абляции.
4. Сбор биологических образцов от мышей
4,1 сыворотки
- Тщательно подъемные температуры тела с тепловой лампой увеличится приток крови. Сбор крови уменьшение поперечного сечения боковой хвостовую вену с помощью хирургического ножа. Позвольте крови капать свободно в Microtainer сыворотки трубы сепаратор.
- Применить мягкое давление на ник с абсорбирующим материалом, таким как марлю или полотенце, чтобы остановить поток крови.
- Дайте крови свернуться в Microtainers в течение 30 минут, затем центрифуги между 6-15 х 1000 г, по крайней мере 90 секунд.
- Передача отделить сыворотку от Microtainer в чистую пробирку Eppendorf дляхранение при температуре -80 ° C.
4,2 Слюна
- Держите под наркозом мыши вертикально, а пипетки 20-30 мкл стерильного фосфатного буфера (PBS) между щекой и десной. Соберите разбавленной слюной, направляя пипетки между щекой и десной.
- Передача разбавленной слюной в новую пробирку, содержащую 10 мкл 2x ингибитор протеазы и хранить при температуре -20 ° C.
4,3 носа
- Эвтаназии мышь перед сбором носа, с использованием утвержденных руководством IACUC. Избегайте использования ингаляционных анестетиков, которые могут повлиять NALT.
- Проведение мыши вертикально, аккуратно пипеткой 30 мкл стерильной PBS в одну ноздрю и собирать полоскание из другой ноздри.
- Передача промыть в новую пробирку, содержащую 10 мкл 2x ингибитор протеазы и хранить при температуре -20 ° C.
4,4 влагалищных выделениях
- Вставьте кончик пипетки в открытии йэлектронной вульву эвтаназии мыши, промыть влагалище с 50 мкл стерильной PBS и собрать все жидкости микропипетки.
- Передача промыть в новую пробирку, содержащую 10 мкл 2x ингибитор протеазы и хранить при температуре -20 ° C.
5. Антиген-специфические антитела или цитокинов в собранных образцах могут быть измерены с помощью ИФА или иной количественный метод.
6. Представитель Результаты
На рисунке 1 представлена общая схема действия, связанные с обработкой NALT содержащие ткани для бывших анализ естественных условиях. На рисунке 2 (А, В), размер неба показано, а также место разреза во время операции удаления (А), как показано пунктирной линией. Расположение NALT указаны стрелками в области премоляра на вырезали окрашенных гематоксилином неба на рисунке 2 (C), с указанием параллельно тканей.
Рисунок 3представлены этапы NALT хирургии нарушений, показывая воздействие на верхнее небо для доступа к NALT (A, B), удаления (С), и окончательный прижигание разреза (D). Типичный H & E сечение носовой области синуса окружающих NALT до операции показана на рисунке 3E, а образ NALT срыва microcurette непосредственно после операции показан на рисунке 3F. Учитывая достаточно времени для восстановления после операции, разрезы должны быть закрыты и носовой полости лишенный NALT (рис. 3G).
Типичные экспериментальные результаты, полученные с помощью этих методов показано на рисунке 4, сравнивая ткани культуральной жидкости и биологических образцов из исследования стафилококковой вакциной субъединицы (STEBVax). Мыши вводили интраназально по STEBVax (IN) или внутрибрюшинно (IP) маршруты. Вакцина была разработана с адъювантной который активирует Toll-подобный рецептор 4 пути 3,1 4 и контроля были даны только физиологическим раствором или вакцина без адъюванта. Искусственный NALT получена из экспериментальных групп выделяется антиген-специфические иммуноглобулины в среду, что было измерить с помощью ИФА. В данном примере (рис. 4а), результаты показывают, что наибольшее количество IgA были освобождены NALT, полученных от мышей, вакцинированных в с субъединицей вакцины в сочетании с адъювантной.
Биологические образцы (например, сыворотка, слюна, носовые выделения, выделения из влагалища), приобретенных от контроля или NALT без мыши можно использовать для профилирования в естественных условиях иммунный ответ на антигены носовой для сравнения с результатами тканевой культуры. На рисунке 4В, IgA и IgG В ответ на вакцинацию были значительно снизилась без функциональных NALT. Уровни антиген-специфических IgA, как правило, больше, чем IgG в слизистой секрет (слюна, носовые мойки) привитых мышей.
upload/3960/3960fig1.jpg "/>
Рисунок 1. Схема NALT сбора и бывший культивирование естественных условиях.
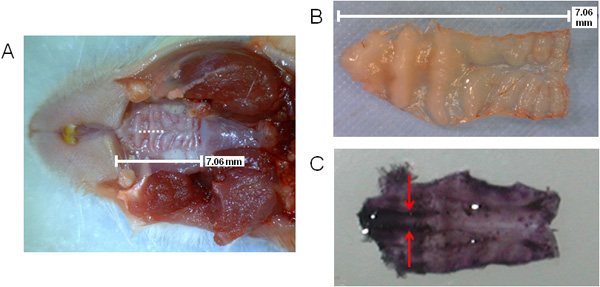
Рисунок 2. Визуализация мыши неба с указанием должности разреза NALT и хирургии. Размер и расположение верхнего неба с операции разрез обозначается пунктирной линией (А), верхнего неба вырезана (B) или окрашивают в гематоксилин (C), чтобы просмотреть параллельно NALT в премоляра области неба (пятна темно-фиолетового на передней стороне неба ). NALT указано стрелками.
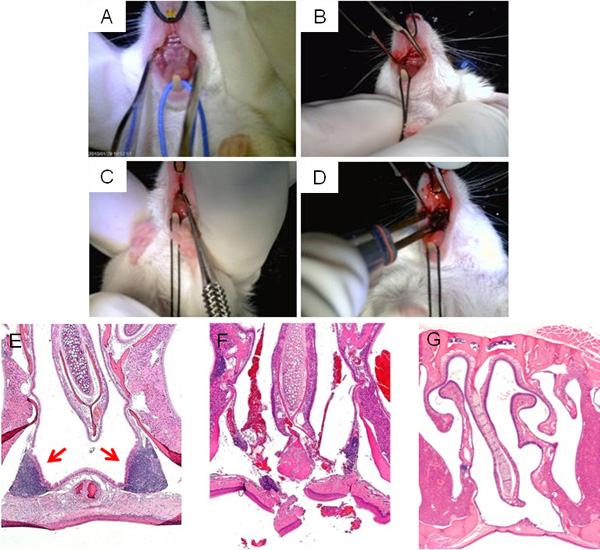
Рисунок 3. Хирургическое нарушение NALT. Основные этапы операции NALT нарушения: лежа вид мышей верхнего неба до операции (А); срединный разрез, сделанный на верхнем небе для доступа к NALT (B); microcurette зонд вводится через срединный разрез сорвать NALT структурыЦелостность (C), прижигание разреза при заключении хирургии (D). Микроскопическое изображение полости носа, H & E пятнами, до операции (E), сразу после операции (F), а также успешно исцелил, NALT без мыши (G).
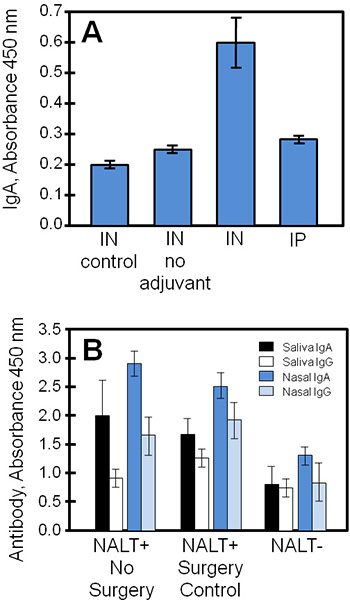
Рисунок 4. Вакцин, специфических антител из культивируемых NALT, слюна, носовые выделения и собраны из вакцинированных мышей. NALT свободного или нормальных мышей контроль были вакцинированы или IP с STEBVax и биологические образцы были собраны. Уровень антител в трех образцов были измерены с помощью иммуноферментного анализа. (A) NALT были исключены из контрольных мышей (не хирургическим путем манипуляций) и культивировали для изучения антител. Вакцина конкретных IgA ответ в культуре у вакцинированных мышей статистически отличается от контроля (Стьюдента-тест, р ≤ 0,01, по сравнению с отсутствием адъювантной вакцины или нет). (B) NALT нарушения существенно сократить конкретных антителВ к вакцинации. Существовали значительные различия между отдельными уровнями антител NALT и NALT + группы (без хирургического вмешательства или контроля операции) для всех сравнений, кроме слюны результаты IgG (Стьюдента-тест, р ≤ 0,05).
Обсуждение
Мы представили коллективные методы разработки модели животных, получения биологических образцов и анализов для изучения NALT связанных иммунных реакций 1-4. Есть и другие факторы, чтобы рассмотреть в ходе выполнения этих методов. Стандартные стерильные методы хирургии и культуры тканей должны быть соблюдены. Сочетание антибактериальные и противогрибковые средства, используемые при выделении и культуры, а также поддержание стерилизовать инструменты, рабочая зона, и дезинфицировать вкус позволит снизить риск заражения. Слюна, носовые моет и аналогичные образцы слизистой секрецией должны быть проверены на предмет возможного загрязнения кровью, как сывороточные антитела, как правило, содержится в высоких концентрациях. Кроме того, слизистые выделения должны быть слегка разбавленный для анализа, поскольку более низкие концентрации антител, присутствующих в этих образцах по сравнению с сывороткой.
Мыши должны быть теплыми непосредственно после операции, предварительновыход потенциал анестезии вызванной гипотермией. Альтернативные отдыха мыши на боку в течение послеоперационного восстановления, чтобы минимизировать нерегулярные дыхания. Хирургическая процедура является более эффективным с трех человек, работающих вместе для выполнения этих задач: одна выполняет операции, одна для оказания помощи в проведении открытым ртом, и одной обеспечить послеоперационный уход, мышей оправиться от наркоза.
Необходимо использовать H & E окрашивания черепной сечения в конце всех экспериментальных процедур или исследований для проверки успешности операции для каждой мыши. Возможные результаты операции являются: полное и двусторонним NALT абляции, неполное удаление или NALT нетронутыми. Потому что не все операции приведет к полной потере NALT, животных с остаточной или нетронутыми NALT может быть использован в качестве внутреннего контроля. Другим потенциальным результатом является то, что небо не удается полностью излечить, оставляя отверстие подключения носа и полости рта. Неполныйзаживление неба приведет к малому весу и нарушения развития, и эти люди должны быть исключены из исследования.
Изучение вакцины ответы сначала с мышиной модели послужит созданию роль NALT в предполагаемый результат исследования (иммунного ответа, выживаемости и т.д.). Хирургическим удалением NALT облегчает определение носовой вклад в местных и системного иммунитета. Хирургический подход, описанный здесь, является наиболее прямой способ получения модели мыши лишенные NALT. Выберите нокаут мышах, как сообщается, отсутствие NALT, но эти животные также являются дефицит цитокинов и хемокинов важное значение для развития других вторичных лимфоидных тканей, и может питать дополнительные дефекты 12,13. Кроме того, методы, описанные здесь, были разработаны для изучения некоторых аспектов иммунных реакций, происходящих в носовые ходы. Наши экспериментальные результаты основаны на исследованиях с использованием всей верхней Палатоме от мыши на культуре ткани, хотя не исключено, что участки могут быть использованы. И, наконец, культурные модели NALT полезна для проведения экспериментов полностью в культуре ткани.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Поддержка была оказана Becton Dickinson технологий. Мнения, высказанные в настоящем документе, являются мнениями авторов и не претендует на отражать официальную политику правительства США. Исследование было проведено в соответствии с Законом животных и других федеральных законов и правил, относящихся к животным и экспериментов с участием животных и придерживаться принципов, изложенных в руководстве по уходу и использованию лабораторных животных, Национальный исследовательский совет, 1996 год. Учреждении, в котором это исследование было проведено полностью аккредитована Ассоциацией по оценке и аккредитации лаборатории Animal Care International.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| Нержавеющая сталь стерильные хирургические лезвия, № 11 | MILTEX | 4-311 | |
| Рукоять ножа, № 3 | MILTEX | 4-7 | |
| 48-луночных культуре клеток | Costar | 3548 | |
| RPMI 1640 | Invitrogen | 11875-093 | |
| Эмбриональной телячьей сыворотки, тепло инактивированная | Гибко / Invitrogen | 16000-044 | Окончательный Конц: 10% по объему в культуре средств массовой информации |
| Стрептомицина сульфата | Сигма | S9137 | Окончательный Конц: 100 мкг / мл |
| Пенициллин | Сигма | P7794 | Окончательный Конц: 100 UI / мл |
| Гентамицин | Sigma-Aldrich | G1397-10ML | Окончательный Конц: 50 мкг / мл |
| Fungizone | Гибко / Invitrogen | 15290-018 | Окончательный Конц: 1 мкг / мл |
| HEPES | Sigma-Aldrich | H0887 | Окончательный Конц: 10 мМ |
| Трубы Эппендорф Микроцентрифуга | Эппендорф | 022364111 | |
| Nutra-гель Черри ароматизированные мыши влажный корм | Био-Подавайте | S4798-TRAY | |
| Metacam | Boehringer Ingelheim | 601531000 | Одна капля 1,5 мг / мл Устная Приостановка |
| Кетамин | Pfizer | 00856440301 | Окончательный Coпс: 6.06 мг / мл |
| Acepromazine | Vedco | VEDC207 | Окончательный Конц: 0,061 мг / мл |
| Ксилазин | Ллойд | 4811 | Окончательный Конц: 0,667 мг / мл |
| Puralube Vet мазь | Pharmaderm здоровья животных | 1621 | |
| 0,9% раствор хлорида натрия инъекций USP | Бакстер | 2B1302 | |
| 0,5 мм Microcurette | Roboz | RS-6350 | |
| Тепловая единица Прижигание | Счетчик Гейгера | 150-S/150A-S | |
| Жало ГТС, прямой изобразительных Loop | Счетчик Гейгера | 214 | |
| Хирургические ножницы | |||
| 10% нейтральный буферный формалин | Сигма | HT501128 | |
| Муравьиная кислота | Рыбак | A119P-4 | Смешайте 426 мл муравьиной кислоты в 1047 мл водопроводной воды, затем добавляют 45 мл Rexyn 101 (H) |
| Rexyn 101 (H) | Рыбак | R231-500 | |
| Ткань-Tek VIP E150/E300 | Сакура | ||
| Ротари Микротом | Leica | RM2255 | |
| Гематоксилин Майера | Сигма | MHS16-500ML | |
| Гилл № 1 гематоксилин | Сигма | GHS116 | |
| Eosin B | Сигма | 2853 | |
| Microtainer сыворотки сепаратор | BD Medical | 365956 | |
| Фосфатного буфера | 100 мМ NaH 2 PO 4, 140 мМ NaCl, рН 7,4 | ||
| Ингибитор протеазы коктейль, ЭДТА бесплатно | Thermo Scientific | 78415 |
Ссылки
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены