Method Article
Examen du rôle du tissu lymphoréticulaire nasopharynx associée (NALT) dans les réponses de la souris pour les vaccins
Dans cet article
Résumé
Méthodes pour examiner les contributions des tissus du nasopharynx-lymphoréticulaire associé (NALT) à nasaux et des réponses immunitaires aux vaccins de souris par voie intranasale sont décrits. Nous démontrons une intervention chirurgicale pour mettre en place un modèle de souris NALT-dépendante et Ex vivo Cultures de NALT extrait.
Résumé
Les tissus du nasopharynx-lymphoréticulaire associé (NALT) trouvées chez l'homme, les rongeurs et autres mammifères, de contribuer à l'immunité dans les sinus nasaux 1-3. Le NALT sont deux parallèles en forme de cloche structures situées dans les voies nasales au-dessus du palais dur, et sont généralement considérés comme des composants secondaires du système lymphoïde associé muqueuse 4-6. Situé dans le NALT sont des compartiments distincts de lymphocytes B et T entrecoupés de cellules présentatrices d'antigène dendritiques 4,7,8. Ces cellules sont entourées par une couche de cellules épithéliales intercalées avec M-cellules qui sont responsables de la récupération d'antigène de la surface des muqueuses des voies aériennes 9,10. Lymphocytes naïfs circulant à travers le NALT sont prêts à répondre à des premières rencontres avec des agents pathogènes respiratoires 7. Alors que NALT disparaissent chez l'homme à l'âge de deux ans, les organes de l'anneau de Waldeyer lymphatiques et même structuré persistent eroughout la vie 6. En revanche pour les humains, les souris de conserver NALT long de la vie, fournissant ainsi un modèle animal idéal pour l'étude des réponses immunitaires ayant leur origine dans les sinus nasaux 11.
Les cultures de suspensions unicellulaires de NALT ne sont pas pratiques en raison de la faiblesse des rendements de cellules mononucléées. Toutefois, la biologie NALT peut être examiné par la culture ex vivo de l'organe intact, et cette méthode présente l'avantage supplémentaire de maintenir la structure du tissu naturel. Pour les études in vivo, les modèles knockout génétiques présentant des défauts limités à NALT ne sont pas actuellement disponibles en raison d'une mauvaise compréhension de la voie de développement. Par exemple, alors que la lymphotoxine-alpha souris knock-out sont atrophiés NALT, les plaques de Peyer, les ganglions lymphatiques périphériques, les cellules dendritiques folliculaires et d'autres tissus lymphoïdes sont également modifiées dans ces souris génétiquement manipulées 12,13. Comme une alternative à la souris knock-out de gènes, p ablation chirurgicaleélimine ermanente NALT du passage nasal sans affecter d'autres tissus. Le modèle de souris qui en résulte a été utilisé pour établir des relations entre les réponses NALT et immunitaire aux vaccins 1,3. La collecte de série de sérum, la salive, les lavages nasaux et les sécrétions vaginales est nécessaire pour établir la base de réponses de l'hôte à la vaccination, tandis que les réponses immunitaires provenant directement NALT peut être confirmé par culture de tissus. Les procédures suivantes décrivent les interventions chirurgicales, la culture de tissus et d'échantillons nécessaires pour examiner locales et systémiques des réponses immunitaires humorales à intranasale (IN) la vaccination.
Protocole
1. Collection NALT et la culture
- Euthanasier des souris en utilisant approuvé des directives IACUC. Évitez d'utiliser des anesthésiques inhalés qui peuvent affecter NALT. Transfert des souris à un espace de travail ou aseptique enceinte de sécurité biologique. Retirer la mâchoire inférieure de la souris et nettoyer la zone palais supérieur avec des lingettes d'alcool et de l'iode.
- Utilisez un n ° 11 lame chirurgicale dans la poignée bistouri à couper soigneusement et de l'accise de la bouche supérieure en suivant le contour intérieur des incisives de souris et les dents molaires.
- Peler délicatement le dos du palais avec une pince, en prenant soin de ne pas déchirer le palais.
- Cette étape est nécessaire pour réduire la contamination des cultures et est conçu pour le traitement des palais multiples. Placer les palais dans des puits individuels dans la première colonne d'une stérile de 48 puits de plaque pré-rempli avec 250 ul de milieu de culture complet (37 ° C) constitué de RPMI 1640 supplémenté avec 10% de sérum de veau foetal, 100 ug / mL de streptomycine, 100 UI / ml de pénicilline, 50 pg / ml de gentamicineet 1 ug / ml fungizone / amphotéricine. Les médias devraient être du carbonate de tampon si palais sont cultivées dans un 5% de CO 2/95% humidité de l'air incubateur (37 ° C), ou encore l'utilisation de 10 mM HEPES pH 7,4, pour les non-CO 2 de la culture.
- Pour laver les palais, utiliser une pince pour déplacer palais dans chaque puits successifs dans une rangée, soigneusement frappant la plaque entre les lavages, jusqu'à ce que le palais a subi un total de huit lavages.
- Transfert des palais dans un nouveau stérile à 48 puits plaque contenant 250 pi de frais, milieu de culture complet (37 ° C) dans les puits.
- Placez les plaques contenant les palais dans un incubateur à 37 ° C pour la culture pendant toute la durée de l'étude.
- Prélever des échantillons pour analyse par transfert aseptique 100 ul de milieu de puits de culture dans des tubes Eppendorf toutes les 24 heures, la remplacer par 100 ul de 37 ° milieu de culture frais C.
- Centrifuger les échantillons de milieux de culture à 380 xg pendant 10 minutes, 4 ° C, pour les débris de granules.
- Transférer le surnageant de l'échantillon centrifugé à frais tubes Eppendorf et conserver à -20 ° C jusqu'au moment de l'analyse.
- Antigène spécifique IgG, IgM, et IgA, ou cytokines sécrétées sont mesurées dans les tissus de culture surnageants par la norme enzyme-linked immunosorbent (ELISA).
2. Ablation chirurgicale de NALT
- Femme souris BALB / c, 7 à 9 semaines d'âge, sont des sujets convenables, mais d'autres souches sont également acceptables. Fournir un gel comme la nourriture humide trois jours avant la chirurgie pour s'acclimater à la souris substitut alimentaire et de l'eau qui sera administrée en post-opération.
- Administrer une goutte de médicament Metacam soulagement de la douleur (1,5 mg / ml ou 0,05 mg / goutte) dans la cavité buccale avant la chirurgie.
- Anesthésier souris en utilisant approuvé des directives IACUC, par exemple, avec un kétamine, l'acépromazine, et le mélange de xylazine (KAX) et appliquer la pommade sur les yeux Vet Puralube pour prévenir l'assèchement. Évitez d'utiliser des anesthésiques inhalés qui peuvent affecter NALT. Unenesthesia peut être confirmé par l'absence de réponse réflexe à un pincement douce des orteils.
- Administrer une mL de solution saline (0,9% de chlorure de sodium USP) entre les omoplates voie sous-cutanée à l'aide d'une aiguille de calibre 22 à 28 et la seringue pour empêcher la déshydratation potentiel de la souris après la chirurgie. En outre administrer 0,1 ml de Respiram voie sous-cutanée entre les omoplates en utilisant une aiguille de calibre 22-28 et une seringue pour promouvoir la respiration saine pendant et après la chirurgie.
- Fournir un soutien thermique à la souris pendant toutes les manipulations ultérieures.
- Placez la souris anesthésiée en position couchée, et d'utiliser deux boucles distinctes de suture chirurgicale autour des incisives supérieures et inférieures pour détacher délicatement la bouche ouverte, exposant le palais supérieur.
- Utiliser un n ° 11 lame chirurgicale pour pratiquer une incision à environ 3 mm de longueur en bas de la ligne médiane de la bouche supérieure dans le site de la NALT.
- Insérez un microcurette 0,5 mm dans l'incision et grattez délicatement sous les bords deperturber le NALT.
- Cauterize l'incision pour arrêter le saignement avec une boucle de droite bien sur une unité thermique cautérisation.
- Continuer à soutenir la souris thermique tout en récupère à la pleine conscience et d'activité.
- Fournir la souris avec du sérum physiologique sous-cutanée jusqu'à trois fois par jour, 1 ml par injection entre les omoplates, pour prévenir la déshydratation comme médicament contre la douleur nécessaire et orale une fois par jour pendant 3 jours après la chirurgie. Déterminer la déshydratation en effectuant un test tente de peau pour vérifier élasticité de la peau. Saisir la peau et du pelage entre les lames épaules de sorte qu'il est tented vers le haut. Si la peau revient rapidement à la normale, la position précédente, la souris n'est pas déshydraté. Si la peau reste élevée et se déplace lentement, la souris est dans un état de déshydratation et nécessite une solution saline. Fournir de la nourriture humide pendant au moins trois jours après la chirurgie afin de permettre suffisamment de temps pour la récupération.
- Avant toute procédure expérimentale, d'observer des souris pendant 8-10 jours en suivant le gain de poids. Reprise de poids Pauvreindique généralement la cicatrisation des palais incomplète, et ces souris devraient être retirés de nouvelles études.
3. Préparation NALT pour l'histologie et l'évaluation du succès de la chirurgie NALT
- Le succès de la chirurgie NALT doit être vérifiée par l'histologie comme décrit ci-dessous. Après avoir terminé toutes les études expérimentales, de préparer des souris pour les collections du crâne par euthanasie à l'aide a approuvé des directives IACUC. Évitez d'utiliser des anesthésiques inhalés qui peuvent affecter NALT.
- Saisir la nuque de la souris euthanasié. Retirez la mandibule inférieure du reste du crâne en les coupant à travers les processus condyliennes avec des ciseaux, des deux côtés.
- À partir de la nuque du cou, enlever la peau et la fourrure du crâne par éplucher et couper lentement vers la face ventrale du crâne.
- Retirez délicatement la peau autour de la région nasale et coupez la peau hors de la pointe du museau à la retirer complètement.
- Détachez le crâne de l'esprit vertèbressnip ha de la paire de ciseaux.
- Insérer des ciseaux dans le foramen magnum et couper à mi-chemin du crâne le long de la ligne médiane pour permettre la perméation de formol dans les tissus mous lors de la fixation.
- Fixer le crâne dans 10% du formol tamponné neutre (FBN) pendant 24 heures à température ambiante.
- Pour détartrer, placer l'échantillon et la cassette séparée, enveloppé dans de la gaze pour éviter de toucher Rexyn l'os, en bouteille avec le mélange acide formique. Incuber pendant 12 heures à température ambiante, puis rincer en permanence sous l'eau du robinet pendant environ 20 minutes.
- Couper l'échantillon à la cloison et dernières orbites de l'oeil avec une lame de rasoir.
- L'échantillon et la cassette peuvent être stockées à court terme dans FBN 10%.
- Placez l'échantillon sur un processeur de tissus pour le traitement de nuit. Ceci est fait pour enlever l'eau de l'échantillon en cours de préparation pour inclusion dans la paraffine.
- Éliminer les tissus traités, incorporer dans un bloc de paraffine avec le museau vers le bas, et le laisser refroidir.
- Coupez rough 15 um sections du bloc avec un microtome automatisé, s'approchant de la localisation approximative de la NALT, puis continuer à réduire en 5 sections um pour le montage sur lames de verre dans un bain d'eau 44.3 ° C.
- Hématoxyline et éosine (H & E) coloration histologique devrait être utilisée pour évaluer l'ablation NALT.
4. Collecte d'échantillons biologiques provenant de souris
4,1 sérum
- Soigneusement élever la température du corps avec une lampe de chaleur va augmenter le flux sanguin. Prélever le sang en entaillant la veine latérale de la queue avec une lame chirurgicale. Laisser le sang couler librement dans un tube de séparation Microtainer sérum.
- Appliquez une légère pression vers le pseudo avec un matériau absorbant, comme de la gaze ou une serviette, pour arrêter l'écoulement du sang.
- Laisser le sang coaguler dans les Microtainers pendant 30 minutes, puis centrifuger entre 6-15 x 1,000 g pendant au moins 90 secondes.
- Cession séparées du sérum provenant Microtainer dans un tube propre Eppendorf pourstockage à -80 ° C.
4,2 salive
- Maintenez la souris anesthésiée verticalement pendant le pipetage 20-30 phosphate ul stérile tamponnée (PBS) entre la joue et la gencive. Recueillir la salive diluée en dirigeant la pointe de pipette entre la joue et la gencive.
- Transférer la salive diluée dans un nouveau tube contenant 10 uL d'inhibiteur de la protéase 2x et conserver à -20 ° C.
4.3 sécrétions nasales
- Euthanasier la souris avant de recueillir les sécrétions nasales, l'aide a approuvé des directives IACUC. Évitez d'utiliser des anesthésiques inhalés qui peuvent affecter NALT.
- En tenant la souris verticalement, soigneusement pipette 30 ul de PBS stérile dans une narine et de recueillir de rinçage de l'autre narine.
- Transfert de rinçage pour un nouveau tube contenant 10 uL d'inhibiteur de la protéase 2x et conserver à -20 ° C.
4.4 Les sécrétions vaginales
- Insérer la pointe d'une micropipette dans l'ouverture de ee la vulve d'une souris euthanasiés, rincer le vagin avec 50 ul de PBS stérile et recueillir tous les fluides par micropipette.
- Transfert de rinçage pour un nouveau tube contenant 10 uL d'inhibiteur de la protéase 2x et conserver à -20 ° C.
5. Spécifiques de l'antigène d'anticorps ou de cytokines dans les échantillons recueillis peuvent être mesurée par la méthode ELISA ou une autre méthode quantitative.
6. Les résultats représentatifs
La figure 1 présente un schéma général d'étapes avec traitement du tissu NALT contenant pour l'analyse ex vivo. La figure 2 (A, B), la taille de la bouche est représenté, ainsi que l'emplacement de l'incision pendant l'opération d'ablation (A), comme indiqué par la ligne pointillée. L'emplacement de NALT sont indiquées par des flèches dans la région prémolaire sur une excisée à l'hématoxyline-teinté palais dans la figure 2 (C), montrant les tissus parallèles.
Figure 3présente étapes consistant à perturber l'opération NALT, affichant l'exposition de la bouche supérieure pour l'accès à NALT (A, B), d'ablation (C), et la cautérisation finale de l'incision (D). Un type H et E section transversale de la zone entourant le sinus nasal NALT avant l'opération est représenté sur la figure 3E, alors qu'une image de la perturbation par le NALT microcurette directement après l'opération apparaît dans 3F Figure. Laissant suffisamment de temps pour la récupération de la chirurgie, les incisions doivent être fermés et la cavité nasale sans NALT (Figure 3G).
Typiques des résultats expérimentaux obtenus en utilisant ces techniques sont présentés dans la figure 4, comparant surnageants de culture de tissus et d'échantillons biologiques à partir d'une étude d'un vaccin sous-unité staphylococcique (STEBVax). Les souris ont été administrés par voie intranasale STEBVax (IN) ou intrapéritonéale (IP) des routes. Le vaccin a été formulé avec un adjuvant qui active le récepteur Toll-like 4 voie 3,1 4, et les contrôles ont été donnés uniquement une solution saline ou d'un vaccin sans adjuvant. NALT de culture obtenu à partir de groupes expérimentaux sécrétée spécifiques de l'antigène immunoglobulines dans le milieu qui était mesurable par la méthode ELISA. Dans cet exemple (figure 4A), les résultats indiquent que les plus grandes quantités d'IgA ont été libérés par NALT obtenu à partir de souris vaccinées avec un vaccin DANS sous-unité combinée avec de l'adjuvant.
Les échantillons biologiques (tel que le sérum, la salive, les sécrétions nasales, les sécrétions vaginales) acquis auprès de commande ou NALT sans souris peuvent être utilisées pour dresser le profil du in vivo la réponse immunitaire à des antigènes nasales pour la comparaison avec les résultats de culture de tissus. Dans la figure 4B, IgA et IgG réponses à dans les vaccinations étaient significativement diminué, sans NALT fonctionnelle. Les niveaux de l'antigène spécifique IgA étaient généralement supérieure à IgG dans les sécrétions des muqueuses (salive, les lavages nasaux) des souris vaccinées.
upload/3960/3960fig1.jpg "/>
Figure 1. Schéma de la collecte et la culture NALT ex vivo.
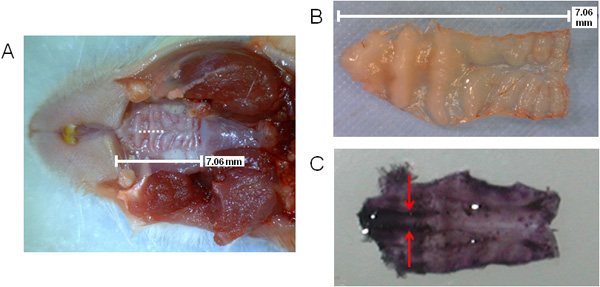
Figure 2. Visualisation du palais de la souris indiquant la position d'incision et la chirurgie NALT. Taille et l'emplacement du palais supérieure avec incision chirurgicale notée par la ligne pointillée (A); palais supérieur excisée (B) ou teints en hématoxyline (C) pour voir le NALT parallèle dans le domaine de la prémolaire du palais (tachés de pourpre foncé sur le côté antérieur du voile du palais ). NALT indiqué par les flèches.
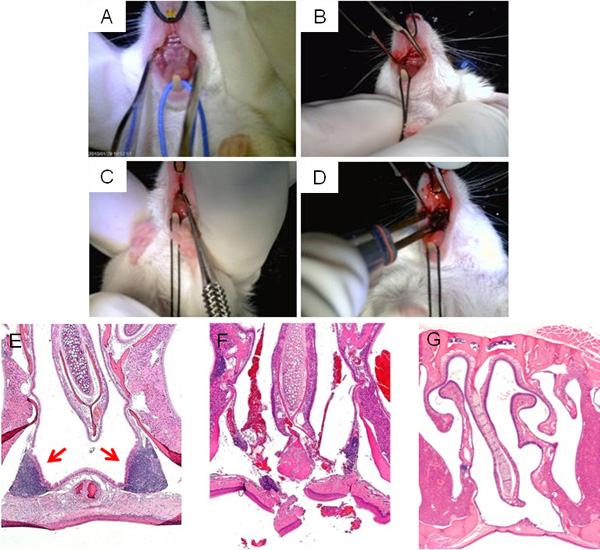
Figure 3. Perturbations NALT chirurgicale. Les principales étapes de la chirurgie des perturbations NALT: vue en décubitus dorsal du palais de la souris supérieure avant la chirurgie (A); incision médiane faite en bouche supérieure pour accéder à la NALT (B); sonde insérée à travers microcurette incision médiane de perturber la structure NALT dansintégrité (C); la cautérisation de l'incision à la conclusion de la chirurgie (D). Les images microscopiques des cavités nasales, tachés H & E, avant la chirurgie (E); immédiatement après la chirurgie (F), et un succès guéri, NALT sans souris (G).
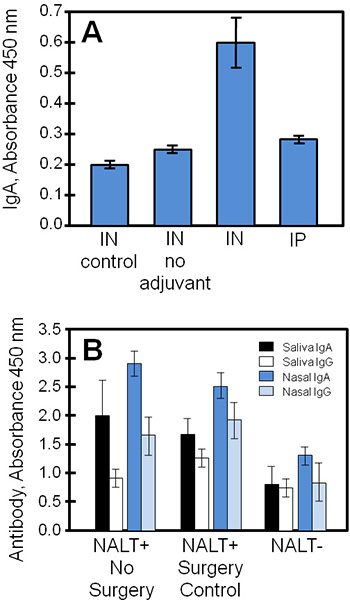
Figure 4. La vaccination des anticorps spécifiques de NALT culture, de la salive, les sécrétions nasales et recueillies auprès de souris vaccinées. Souris témoins NALT-libres ou normal ont été vaccinés IN ou IP avec STEBVax, et des échantillons biologiques ont été recueillis. Les niveaux d'anticorps de trois échantillons ont été mesurés par ELISA. (A) NALT ont été retirés de souris témoins (pas chirurgicalement manipulé) et cultivées pour examiner les réponses d'anticorps. La réponse au vaccin spécifique IgA dans la culture pour chez les souris vaccinées était statistiquement différente de contrôles (t de Student-test, p ≤ 0,01, comparativement à aucun adjuvant ou pas de vaccin). (B) la perturbation NALT sensiblement réduit les réponses en anticorps spécifiquesà la vaccination. Il y avait des différences significatives entre les niveaux d'anticorps spécifiques de NALT et NALT + groupes (pas de Chirurgie ou de contrôle) pour toutes les comparaisons à l'exception des résultats IgG salivaires (t de Student-test, p ≤ 0,05).
Discussion
Nous avons présenté des méthodes collectives pour développer un modèle animal, l'obtention d'échantillons biologiques et des tests pour l'examen des NALT associés réponses immunitaires 1-4. Il ya d'autres facteurs à considérer lors de l'exécution de ces méthodes. Les techniques standard stériles pour la chirurgie et de la culture de tissus doivent être suivies. Une combinaison d'agents antibactériens et antifongiques utilisés lors de l'isolement et la culture, ainsi que le maintien des instruments stérilisés, espace de travail, et le palais désinfectés permettra de réduire le risque de contamination. La salive, les lavages nasaux et des échantillons similaires sécrétion muqueuse doit être inspecté pour une contamination potentielle par le sang, que les anticorps sériques sont généralement trouvés dans des concentrations plus élevées. En outre, les sécrétions muqueuses ne devrait être légèrement diluée pour l'analyse en raison des concentrations plus faibles d'anticorps sont présents dans ces échantillons par rapport au sérum.
Souris doivent être gardés au chaud directement après la chirurgie pour préévacuer le potentiel anesthésie induite par l'hypothermie. Autres souris de repos sur leurs côtés lors de récupération post-chirurgicale afin de minimiser une respiration irrégulière. La procédure chirurgicale est plus efficace avec trois personnes qui travaillent ensemble pour accomplir ces tâches: l'un effectuant la chirurgie, l'un pour aider à la tenue de la bouche ouverte, et l'autre pour fournir des soins post-chirurgicaux que les souris de récupérer de l'anesthésie.
Il est nécessaire d'utiliser une coloration H & E de crâniens des sections transversales à la fin de toutes les procédures expérimentales ou des études pour vérifier le succès de la chirurgie pour chaque souris. Résultats de la chirurgie sont possibles: l'ablation totale et bilatérale NALT, l'ablation incomplète, ou NALT intacte. Parce que tous les chirurgies se traduira par la perte complète de la NALT, les animaux avec NALT résiduelle ou intacte peut être utilisé comme contrôles internes. Un autre résultat potentiel est que la bouche échoue pour guérir complètement, en laissant une ouverture reliant l'nasale et les cavités buccale. Incompletla guérison du palais se traduira par un faible poids et retard staturo-pondéral, et ces personnes doivent être retirés à partir d'études.
L'examen des réponses du premier vaccin avec le modèle de la souris servent à établir un rôle à jouer dans la NALT résultats de l'étude prévue (réponse en anticorps, à la survie, etc.) L'ablation chirurgicale du NALT facilite la détermination des contributions nasales à l'immunité locale et systémique. L'approche chirurgicale décrite ici est la méthode la plus directe pour l'obtention d'un modèle de souris dépourvues de NALT. Sélectionnez knock-out des modèles de souris ont été signalés à NALT absence, mais ces animaux sont aussi déficientes en cytokines ou chimiokines essentiels pour le développement d'autres tissus lymphoïdes secondaires, et peut héberger des défauts supplémentaires 12,13. En outre, les méthodes décrites ici ont été élaborés pour examiner plusieurs aspects de la réponse immunitaire au sein originaires des fosses nasales. Nos résultats expérimentaux sont basées sur des études utilisant le Palat toute la partie supérieuree de la souris pour la culture de tissus, mais il est possible que les articles peuvent être utilisés. Enfin, le modèle NALT culture est utile pour réaliser des expériences complètement dans la culture de tissus.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Un appui a été fourni par Becton Dickinson Technologies. Les opinions exprimées dans cette présentation sont celles des auteurs et ne prétendent pas refléter la politique officielle du gouvernement des États-Unis. Des recherches ont été menées en conformité avec la Loi sur la protection des animaux et d'autres lois et règlements fédéraux relatifs aux animaux et aux expériences impliquant des animaux et adhère à des principes énoncés dans le Guide pour le soin et l'utilisation des animaux de laboratoire, Conseil national de recherches, 1996. L'établissement où cette recherche a été menée est entièrement accrédité par l'Association pour l'évaluation et l'accréditation des animaux de laboratoire Care International.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Le numéro de catalogue | Commentaires |
| En acier inoxydable stériles lames chirurgicales, n ° 11 | Miltex | 4-311 | |
| Manche du couteau, n ° 3 | Miltex | 4-7 | |
| Plaques de 48 puits de culture cellulaire | Costar | 3548 | |
| RPMI 1640 | Invitrogen | 11875-093 | |
| Sérum fœtal bovin, inactivé par la chaleur | Gibco / Invitrogen | 16000-044 | Final Conc: 10% en volume dans les milieux de culture |
| Sulfate de streptomycine | Sigma | S9137 | Final Conc: 100 pg / mL |
| Pénicilline | Sigma | P7794 | Conc final: 100 UI / ml |
| La gentamicine | Sigma-Aldrich | G1397-10ML | Final Conc: 50 pg / ml |
| Fungizone | Gibco / Invitrogen | 15290-018 | Final Conc: 1 ug / ml |
| HEPES | Sigma-Aldrich | H0887 | Conc final: 10 mM |
| Tubes à centrifuger Eppendorf | Eppendorf | 022364111 | |
| Nutra-gel alimentaire cerise souris aromatisé Wet | Bio-Serve | S4798-PLATEAU | |
| Metacam | Boehringer Ingelheim | 601531000 | Une goutte de 1,5 mg / ml suspension orale |
| La kétamine | Pfizer | 00856440301 | Co finalnc: 6,06 mg / ml |
| Acépromazine | Vedco | VEDC207 | Conc final: 0,061 mg / ml |
| La xylazine | Lloyd | 4811 | Final Conc: 0,667 mg / ml |
| Pommade Vétérinaire Puralube | De la santé animale Pharmaderm | 1621 | |
| 0,9% USP pour injection de chlorure de sodium | Baxter | 2B1302 | |
| 0,5 mm Microcurette | Roboz | RS-6350 | |
| Unité cautérisation thermique | Geiger | 150-S/150A-S | |
| Embout de remplacement TCU, Droit boucle fine | Geiger | 214 | |
| Ciseaux chirurgicaux | |||
| 10% formol neutre tamponné | Sigma | HT501128 | |
| L'acide formique | Pêcheur | A119P-4 | Mélanger 426 ml d'acide formique dans l'eau du robinet 1047 ml, puis ajouter 45 ml Rexyn 101 (H) |
| Rexyn 101 (H) | Pêcheur | R231-500 | |
| Tissue-Tek VIP E150/E300 | Sakura | ||
| Microtome rotatif | Leica | RM2255 | |
| Hématoxyline de Mayer | Sigma | MHS16-500ML | |
| Gill N ° 1 hématoxyline | Sigma | GHS116 | |
| Éosine B | Sigma | 2853 | |
| Microtainer Sérum Separator | BD Médical | 365956 | |
| Phosphate Buffered Saline | 100 mM NaH 2 PO 4, NaCl 140 mM, pH 7,4 | ||
| Cocktail d'inhibiteur de protéase, de l'EDTA-libre | Thermo Scientific | 78415 |
Références
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon