Method Article
Esaminando il ruolo della rinofaringeo associata Tissue linforeticolare (NALT) nelle risposte mouse ai vaccini
In questo articolo
Riepilogo
I metodi per esaminare i contributi dei tessuti linforeticolari nasofaringeo associati (NALT) a risposte immunitarie nasali e sistemici di topi ai vaccini per via endonasale sono descritti. Abbiamo dimostrato una procedura chirurgica per stabilire una NALT-dipendente modello di topo e Ex vivo Culture di NALT estratti.
Abstract
I tessuti linforeticolari nasofaringeo-associati (NALT) che si trovano negli esseri umani, roditori ed altri mammiferi, contribuiscono a immunità nei seni nasali 1-3. Il NALT sono due parallele a forma di campana strutture localizzate nei passaggi nasali al di sopra del palato duro, e di solito sono considerati componenti secondari della mucosa-associato sistema linfatico 4-6. Situato all'interno del NALT sono compartimenti distinti di linfociti B e T intervallati da cellule presentanti l'antigene dendritiche 4,7,8. Queste cellule sono circondati da uno strato di cellule epiteliali intercalato con M-cellule che sono responsabili per il recupero antigene dalle superfici mucose delle vie respiratorie 9,10. Naive dei linfociti circolanti attraverso il NALT sono pronti a rispondere a primi incontri con agenti patogeni respiratori 7. Mentre NALT scompaiono negli esseri umani dall'età di due anni, gli organi linfatici del Waldeyer Anello e, analogamente strutturato continuano a persistere °roughout vita 6. In contrasto con gli esseri umani, topi NALT mantenere per tutta la vita, fornendo così un modello animale conveniente per lo studio di risposte immunitarie originari all'interno dei seni nasali 11.
Colture di unicellulari sospensioni di NALT non sono pratici a causa di basse rese di cellule mononucleate. Tuttavia, biologia NALT può essere esaminato coltura ex vivo dell'organo intatto, e questo metodo ha il vantaggio aggiuntivo di mantenere la struttura del tessuto naturale. Poiché in studi in vivo, i modelli che presentano difetti genetici knockout limitati a NALT non sono attualmente disponibili a causa di una scarsa comprensione del percorso di sviluppo. Per esempio, mentre linfotossina-a topi knockout sono atrofizzati NALT, placche di Peyer, linfonodi periferici, cellule follicolari dendritiche e di altri tessuti linfoidi sono alterati in questi topi geneticamente manipolati 12,13. In alternativa a topi knockout gene, p ablazione chirurgicaelimina ermanentemente NALT dal passaggio nasale senza influenzare altri tessuti. Il modello di topo risultante è stato utilizzato per stabilire relazioni tra le risposte NALT e immune ai vaccini 1,3. La raccolta di serie del siero, saliva, lavaggi nasali e secrezioni vaginali è necessario per stabilire la base delle risposte di accoglienza alla vaccinazione, mentre le risposte immunitarie provenienti direttamente dal NALT può essere confermata da coltura tissutale. Le procedure seguenti illustrano gli interventi chirurgici, la cultura dei tessuti e la raccolta dei campioni necessari per esaminare le risposte umorali locali e sistemici immunitarie a intranasale (IN) la vaccinazione.
Protocollo
1. Raccolta NALT e Culturing
- Euthanize topo, utilizzando approvato guida IACUC. Evitare l'uso di anestetici inalatori che possono influenzare NALT. Trasferimento topi ad un asettico spazio di lavoro o di biosicurezza cabinet. Rimuovere la mascella inferiore del mouse e pulire la zona superiore palato con batuffoli imbevuti d'alcol e iodio.
- Utilizzare una lama chirurgica No. 11 nel manico del coltello per tagliare con cura chirurgica e delle accise il palato superiore, seguendo il contorno interno degli incisivi del mouse e dei denti molari.
- Staccare delicatamente il palato con le pinze, facendo attenzione a non strappare il palato.
- Questo passaggio è necessario per ridurre la contaminazione di culture ed è progettato per l'elaborazione palati più. Inserire palati in pozzetti individuali nella prima colonna di una sterile 48-pozzetti pre-riempito con 250 pl di mezzo di coltura completo (37 ° C) costituito da RPMI 1640 integrato con 10% siero fetale bovino, 100 pg / ml streptomicina, 100 UI / ml penicillina, 50 ug / ml di gentamicinae 1 pg / ml fungizone / amfotericina. I media dovrebbero essere tamponata con carbonato di palati se vengono coltivate in una CO 5% 2/95% di aria umida incubatore (37 ° C), o in alternativa utilizzare HEPES 10 mM pH 7,4, per i non-CO 2 cultura.
- Per lavare i palati, usare una pinza per spostare palati in ogni pozzetto successivo in una fila, con attenzione toccando la piastra tra un lavaggio e, fino a quando il palato ha subito un totale di otto lavaggi.
- Trasferire il palato in una nuova sterile 48-pozzetti contenente 250 pl di fresco, mezzo di coltura completo (37 ° C) in pozzetti.
- Collocare le piastre contenenti le palati in un incubatore a 37 ° C per coltura per tutta la durata dello studio.
- Raccogliere campioni per analisi asetticamente trasferendo 100 pl di mezzo da pozzetti di coltura in provette Eppendorf ogni 24 ore, sostituendo con 100 pl di 37 ° coltura fresco C terreno.
- Centrifugare i campioni coltura mezzi a 380 xg per 10 minuti, 4 ° C, a detriti pellet.
- Trasferire il supernatante dal campione centrifugato a nuove provette Eppendorf e conservare a -20 ° C fino al momento analizzare.
- Antigene-specifica IgG, IgM e IgA, o citochine secrete sono misurate in tessuto-coltura surnatanti mediante le normali metodica immunoenzimatica (ELISA).
2. Ablazione chirurgica delle NALT
- Femmina BALB / c topi, da 7 a 9 settimane di età, sono soggetti idonei, ma altri ceppi sono anche accettabili. Fornire gel-like cibo umido tre giorni prima della chirurgia per acclimatarsi sostituto del mouse per cibo e acqua, che sarà gestito post-operatorio.
- Somministrare una goccia di sollievo dal dolore Metacam farmaco (1,5 mg / ml o 0,05 mg / drop) nella cavità orale prima dell'intervento.
- Anestetizzare topi usando approvato guida IACUC, per esempio, con ketamina, acepromazina, e miscela xilazina (KAX) e applicare una pomata Puralube Vet su occhi per prevenire l'essiccazione. Evitare l'uso di anestetici inalatori che possono influenzare NALT. Anesthesia può essere confermata l'assenza di risposta riflessa ad un pizzicotto dolce delle dita dei piedi.
- Somministrare 1 ml di soluzione fisiologica (0,9% di cloruro di sodio USP di iniezione) per via sottocutanea tra le scapole utilizzando un 22-28 gauge e la siringa per prevenire la disidratazione potenzialità del mouse dopo l'intervento. Anche amministrare 0,1 mL di Respiram per via sottocutanea tra le scapole utilizzando un 22-28 gauge e la siringa per promuovere la respirazione sana durante e dopo l'intervento chirurgico.
- Fornire supporto termico al mouse durante tutte le manipolazioni successive.
- Posizionate il mouse anestetizzato in posizione supina, e utilizzare due anelli separati di sutura chirurgica circa gli incisivi superiori e inferiori a sollevare delicatamente aperto la bocca, esponendo il palato superiore.
- Utilizzare un No. 11 lama chirurgica praticare un'incisione di circa 3 mm di lunghezza lungo la linea mediana del palato superiore nel sito del NALT.
- Inserire un microcurette 0,5 mm nel incisione e raschiare delicatamente sotto i bordi perinterrompere la NALT.
- Cauterizzare l'incisione per arrestare l'emorragia con un ciclo dritto bene su un gruppo termico cauterio.
- Continua supporto termico, mentre recupera il mouse verso la piena consapevolezza e l'attività.
- Fornire il mouse con soluzione salina per via sottocutanea fino a tre volte al giorno, 1 ml per iniezione tra le scapole, per prevenire la disidratazione, come farmaci per il dolore necessario, e per via orale una volta al giorno per 3 giorni post intervento chirurgico. Determinare la disidratazione eseguendo un test tenda di pelle per verificare turgore della pelle. Afferrare pelle e del pelo tra le lame spalle in modo che sia tented alto. Se la pelle ritorna rapidamente al normale, posizione precedente, il mouse non è disidratato. Se la pelle rimane elevata e si muove lentamente, il topo è in uno stato di disidratazione e richiede salina. Fornire cibo umido per almeno tre giorni dopo un intervento chirurgico per un tempo sufficiente per il recupero.
- Prima di tutte le procedure sperimentali, osservare i topi per 8-10 giorni, monitorando l'aumento di peso. Peso scarso recuperodi solito indica la guarigione incompleta palato, e questi topi dovrebbero essere ritirati dal ulteriori studi.
3. Preparazione NALT per l'istologia e valutare il successo di Chirurgia NALT
- Il successo della chirurgia NALT deve essere accertata da istologia come descritto di seguito. Dopo aver completato tutti gli studi sperimentali, preparare i topi per le collezioni cranici da eutanasia utilizzando approvato guida IACUC. Evitare l'uso di anestetici inalatori che possono influenzare NALT.
- Afferrare la nuca del mouse eutanasia. Rimuovere la mandibola inferiore dal resto del cranio tagliandoli attraverso i processi condilari con forbici su entrambi i lati.
- A partire dalla nuca, togliere la pelle e la pelliccia dal cranio lentamente pelatura e taglio verso il lato ventrale del cranio.
- Rimuovere con cura la pelle intorno alla zona nasale e tagliare la pelle al largo della punta del muso per rimuovere completamente.
- Staccare il cranio dalla wit vertebresnip ha delle forbici.
- Inserire le forbici nel forame magno e tagliare a metà il cranio lungo la linea mediana per consentire la permeazione di formalina nei tessuti molli durante la fissazione.
- Fissare cranio in 10% formalina tamponata neutra (NBF) per 24 ore a temperatura ambiente.
- Per decalcificazione, posizionare il campione e la cassetta separata, avvolto in una garza per impedire Rexyn di toccare l'osso, in bottiglia con la miscela di acido formico. Incubare per 12 ore a temperatura ambiente, poi lavare continuamente sotto acqua di rubinetto per circa 20 minuti.
- Tagliare il campione al setto nasale e passate orbite l'occhio con una lama di rasoio.
- Campione e cassette possono essere conservati a breve termine nel 10% NBF.
- Porre campione su un processore tessuto per l'elaborazione notte. Questo viene fatto per rimuovere l'acqua dal campione in preparazione per paraffina.
- Rimuovere il tessuto trasformati, incorporare in un blocco di paraffina con il muso verso il basso, e lasciarlo raffreddare.
- Trim rough 15 um sezioni trasversali del blocco con un microtomo automatizzato, avvicinando la posizione approssimativa del NALT, poi continuare il taglio in sezioni 5 micron per il montaggio su vetrini in un bagno di acqua 44,3 ° C.
- Ematossilina ed eosina (H & E) colorazione istologia dovrebbero essere utilizzati per valutare l'ablazione NALT.
4. Raccolta di campioni biologici provenienti da topi
4,1 Siero
- Con attenzione elevando la temperatura corporea con una lampada di calore aumenta il flusso sanguigno. Prelevare il sangue per intaccare la vena laterale della coda con una lama chirurgica. Lasciare che il sangue gocciolare liberamente in un tubo separatore di siero Microtainer.
- Applicare una leggera pressione al nick con materiale assorbente, come la garza o un asciugamano, per fermare il flusso di sangue.
- Lasciare che il sangue coaguli nelle Microtainers per 30 minuti, quindi centrifugare tra 6-15 x 1000 g per almeno 90 secondi.
- Commutazione separato dal siero Microtainer in una provetta pulita per Eppendorfconservazione a -80 ° C.
4,2 Saliva
- Tenete il mouse anestetizzato verticale durante il pipettaggio 20-30 fosfato ul sterile soluzione salina tamponata (PBS) tra la guancia e la gengiva. Raccogliere la saliva diluita dirigendo punta della pipetta tra la guancia e la gengiva.
- Trasferire la saliva diluito in una nuova provetta contenente 10 L di inibitori della proteasi 2x e conservare a -20 ° C.
4.3 secrezioni nasali
- Eutanasia del mouse prima di raccogliere le secrezioni nasali, utilizzando approvato guida IACUC. Evitare l'uso di anestetici inalatori che possono influenzare NALT.
- Tenendo il mouse verticalmente, con attenzione pipettare 30 microlitri di PBS sterile in una narice e raccogliere risciacquo da altra narice.
- Trasferimento risciacquo in una nuova provetta contenente 10 pl di inibitori della proteasi 2x e conservare a -20 ° C.
4.4 secrezioni vaginali
- Inserire la punta di una micropipetta nell'apertura di thvulva e del mouse eutanasia, lavare la vagina con 50 microlitri di PBS sterile e raccogliere tutto il liquido dalla micropipetta.
- Trasferimento risciacquo in una nuova provetta contenente 10 pl di inibitori della proteasi 2x e conservare a -20 ° C.
5. Anticorpi antigene-specifici o citochine nei campioni raccolti possono essere misurate mediante ELISA o un altro metodo quantitativo.
6. Risultati rappresentativi
La Figura 1 fornisce una vista schematica generale di fasi coinvolte con l'elaborazione del NALT contenente tessuto per l'analisi ex vivo. In Figura 2 (A, B), la dimensione del palato è mostrato, così come la posizione del incisione ablazione durante l'intervento chirurgico (A), come indicato dalla linea tratteggiata. La posizione di NALT sono indicati da frecce nella zona premolare su un asportato ematossilina-tinto palato in Figura 2 (C), mostra i tessuti paralleli.
Figura 3presenta passaggi della chirurgia interruzione NALT, mostrando l'esposizione del palato superiore per l'accesso a NALT (A, B), ablazione (C), e la cauterizzazione finale della incisione (D). Un tipico EE sezione trasversale della zona del seno nasale circostante il NALT prima dell'intervento chirurgico è mostrato in Figura 3E, mentre un'immagine di perturbazione NALT dal microcurette direttamente dopo l'intervento appare in figura 3F. Un tempo sufficiente per il recupero da un intervento chirurgico, le incisioni devono essere chiusi e la cavità nasale privo di NALT (Figura 3G).
Tipici risultati sperimentali ottenuti con queste tecniche sono mostrati nella Figura 4, confrontando supernatanti di coltura dei tessuti e campioni biologici da uno studio di un vaccino a subunità stafilococco (STEBVax). I topi sono stati somministrati STEBVax da intranasale (IN) o intraperitoneale (IP) rotte. Il vaccino è stato formulato con un adiuvante che attiva il recettore Toll-like 4 percorso di 3,1 4, e controlli sono stati dati solo soluzione salina o vaccino senza adiuvante. NALT Cultured ottenuti da gruppi sperimentali secreto antigene-specifiche immunoglobuline in mezzo che era misurabile con il metodo ELISA. In questo esempio (Figura 4A), i risultati indicano che le grandi quantità di IgA sono stati rilasciati dal NALT ottenuti da topi vaccinati con un vaccino a subunità combinato con adiuvante.
I campioni biologici (come siero, saliva, secrezioni nasali, secrezioni vaginali) acquisiti dal controllo o NALT-topi senza può essere utilizzato per analizzare la risposta in vivo immunitaria agli antigeni nasali per confronto con i risultati delle colture tissutali. In figura 4b, IgA e IgG risposte nella vaccinazione erano significativamente ridotta senza NALT funzionale. I livelli di antigene-specifica IgA erano generalmente superiori IgG nelle secrezioni mucose (saliva, lavaggi nasali) dei topi vaccinati.
upload/3960/3960fig1.jpg "/>
Figura 1. Schema di raccolta NALT e la coltura ex vivo.
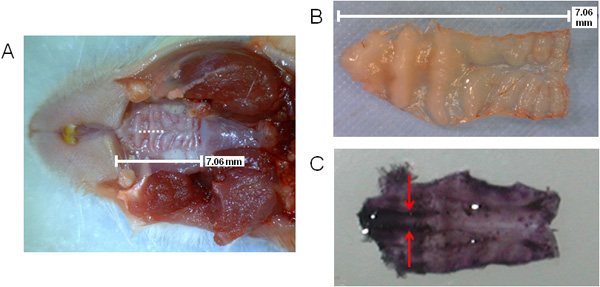
Figura 2. Visualizzazione del palato topo che indica la posizione di incisione NALT e chirurgia. Dimensioni e posizione del palato superiore con incisione chirurgica indicata con linea tratteggiata (A); palato superiore escluso (B) o colorate in ematossilina (C) per visualizzare il NALT parallelo nella zona premolare del palato (tinto viola scuro sul lato anteriore del palato ). NALT indicato dalle frecce.
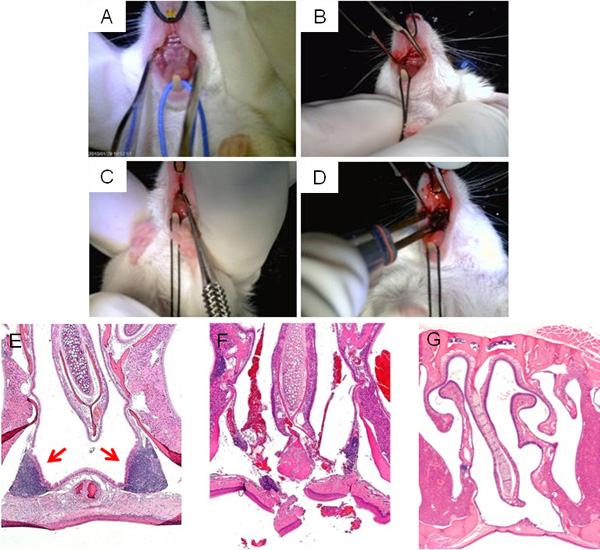
Figura 3. NALT interruzione chirurgica. Le fasi principali della chirurgia interruzione NALT: vista supina del palato superiore del mouse prima dell'intervento chirurgico (A); incisione sulla linea mediana fatta palato superiore per accedere al NALT (B); microcurette sonda inserita attraverso un'incisione mediana per interrompere struttura in NALTgrità (C); cauterizzazione di incisione a conclusione dell'intervento (D). Immagini al microscopio delle cavità nasali, colorati H & E, prima della chirurgia (E), subito dopo l'intervento chirurgico (F), e un successo guarito, NALT-free di topo (G).
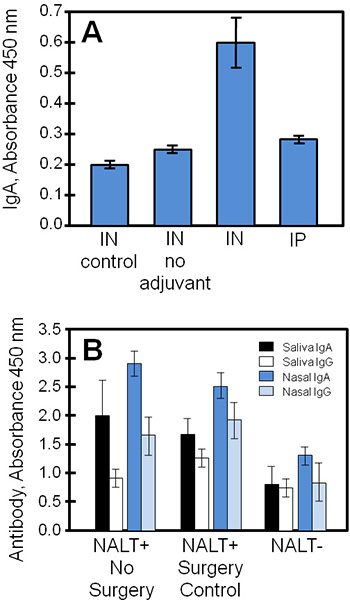
Figura 4. Vaccino anticorpi specifici da NALT colta, saliva e secrezioni nasali raccolti dai topi vaccinati. Topi di controllo NALT-free o normale sono stati vaccinati o IP con STEBVax e campioni biologici sono stati raccolti. I livelli anticorpali dei campioni in triplicato sono stati misurati usando ELISA. (A) NALT sono stati rimossi dai topi di controllo (non chirurgicamente manipolata) e messe in coltura per esaminare la risposta anticorpale. Il vaccino-specifica risposta di IgA in coltura per IN topi vaccinati era statisticamente differente da controlli (Student t-test, p ≤ 0,01, rispetto al non adiuvante o no vaccino). (B) interruzione NALT sostanzialmente ridotto risposte anticorpali specifichea IN vaccinazione. Ci sono state differenze significative tra i livelli di anticorpi specifici di NALT-and NALT + gruppi (non intervento chirurgico o di controllo) per tutti i confronti, tranne saliva risultati IgG (Student t-test, p ≤ 0,05).
Discussione
Abbiamo presentato metodi collettivi per lo sviluppo di un modello animale, per ottenere campioni biologici e saggi per l'esame delle risposte immunitarie NALT-associate 1-4. Ci sono altri fattori da considerare durante l'esecuzione di questi metodi. Tecniche standard di sterili per la chirurgia e la cultura del tessuto devono essere seguite. Una combinazione di agenti antibatterici e antifungini utilizzati durante isolamento e la coltura, oltre a mantenere strumenti sterilizzati, zona di lavoro, e palati disinfettati ridurrà il rischio di contaminazione. Saliva, lavaggi nasali e simili campioni di secrezione mucosa dovrebbe essere ispezionata potenziale contaminazione con il sangue, come gli anticorpi sierici si trovano generalmente in concentrazioni più elevate. Inoltre, secrezioni mucose deve essere leggermente diluito in analisi per basse concentrazioni di anticorpi sono presenti in questi campioni rispetto al siero.
I topi devono essere tenuti al caldo subito dopo l'intervento chirurgico per presfogare la potenziale anestesia indotta l'ipotermia. Alternate i topi riposano sul fianco durante il recupero post-intervento chirurgico per ridurre al minimo la respirazione irregolare. La procedura chirurgica è più efficiente con tre individui che lavorano insieme per completare questi compiti: uno di eseguire l'intervento chirurgico, uno per aiutare a tenere la bocca aperta, e uno per fornire assistenza post-chirurgica, come i topi riprendersi dall'anestesia.
È necessario utilizzare la colorazione H e E di cranici sezioni trasversali al termine di tutte le procedure sperimentali o studi per verificare il successo della chirurgia per ciascun topo. Esiti di chirurgia possibili sono: NALT ablazione completa e bilaterale, ablazione incompleta o NALT intatto. Poiché non tutti gli interventi chirurgici comporta la perdita completa del NALT, animali con NALT residuo o intatto può essere utilizzato come controllo interno. Un altro risultato potenziale è che il palato non riesce a guarire completamente, lasciando un'apertura che collega il naso e le cavità orali. Incompletoguarigione del palato si tradurrà in basso peso e ritardo della crescita, e questi individui dovrebbero essere rimossi dagli studi.
Esaminando le risposte primo vaccino con il modello di topo servirà a stabilire un ruolo per NALT nel risultato di studio previsto (risposta anticorpale, la sopravvivenza, ecc.) Chirurgicamente rimuovendo il NALT facilita la determinazione dei contributi nasali per l'immunità locale e sistemica. L'approccio chirurgico qui descritto è il metodo più diretto per ottenere un modello murino privo di NALT. Selezionare knock-out modelli murini sono stati segnalati NALT mancanza, ma questi animali sono anche carenti di citochine e chemochine essenziali per lo sviluppo di altri tessuti linfatici secondari, e possono ospitare ulteriori difetti 12,13. Inoltre, i metodi descritti qui sono stati sviluppati per esaminare diversi aspetti della risposta immunitaria originari all'interno dei passaggi nasali. I nostri risultati sperimentali si basano su studi che usano il palato tutta la parte superioree dal mouse per coltura tissutale, anche se è possibile che le sezioni possono essere utilizzati. Infine, il modello NALT coltivato è utile per eseguire esperimenti completamente in coltura tissutale.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Il sostegno è stato fornito da Becton Dickinson Technologies. Le opinioni espresse in questa presentazione sono quelle degli autori e non pretende di riflettere la politica ufficiale del governo degli Stati Uniti. La ricerca è stata condotta nel rispetto della legge sulla protezione degli animali e di altre leggi federali e regolamenti in materia di animali ed esperimenti che coinvolgono animali e aderisce ai principi stabiliti nella Guida per la cura e l'uso di animali da laboratorio, National Research Council, 1996. L'impianto in cui è stata condotta questa ricerca è pienamente accreditata dall'Associazione per la valutazione e accreditamento dei Laboratory Animal Care International.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Lame in acciaio inossidabile chirurgico sterile, N. 11 | Miltex | 4-311 | |
| Knife Handle, No. 3 | Miltex | 4-7 | |
| 48 e piastre di coltura cellulare | Costar | 3548 | |
| RPMI 1640 | Invitrogen | 11875-093 | |
| Siero fetale bovino, inattivato al calore | Gibco / Invitrogen | 16000-044 | Conc. finale: 10% in volume in terreni di coltura |
| Streptomicina solfato | Sigma | S9137 | Conc. finale: 100 pg / mL |
| Penicillina | Sigma | P7794 | Conc finale: 100 UI / mL |
| Gentamicina | Sigma-Aldrich | G1397-10ML | Conc. finale: 50 ug / mL |
| Fungizone | Gibco / Invitrogen | 15290-018 | Conc. finale: 1 ug / mL |
| HEPES | Sigma-Aldrich | H0887 | Conc. finale: 10 mM |
| Microcentrifuga Eppendorf Tubes | Eppendorf | 022364111 | |
| Nutra-gel Cherry alimentare mouse Flavored Wet | Bio-Serve | S4798-VASSOIO | |
| Metacam | Boehringer Ingelheim | 601531000 | Una goccia di 1,5 mg / ml sospensione orale |
| Ketamina | Pfizer | 00856440301 | Co finalenc: 6,06 mg / mL |
| Acepromazine | Vedco | VEDC207 | Conc. finale: 0,061 mg / mL |
| Xilazina | Lloyd | 4811 | Conc. finale: 0,667 mg / mL |
| Puralube Vet Pomata | Pharmaderm Animal Health | 1621 | |
| 0,9% cloruro di sodio USP di iniezione | Baxter | 2B1302 | |
| 0,5 millimetri Microcurette | Roboz | RS-6350 | |
| Cautery unità termica | Geiger | 150-S/150A-S | |
| TCU Tip Replacement, Straight Loop fine | Geiger | 214 | |
| Forbici chirurgiche | |||
| 10% di formalina tamponata neutra | Sigma | HT501128 | |
| Acido formico | Pescatore | A119P-4 | Mescolare 426 ml di acido formico in 1047 ml di acqua del rubinetto, quindi aggiungere 45 mL Rexyn 101 (H) |
| Rexyn 101 (H) | Pescatore | R231-500 | |
| Tissue-Tek VIP E150/E300 | Sakura | ||
| Microtomo Rotary | Leica | RM2255 | |
| Ematossilina di Mayer | Sigma | MHS16-500ML | |
| Ematossilina Gill No.1 | Sigma | GHS116 | |
| Eosina B | Sigma | 2853 | |
| Microtainer Serum Separator | BD Medico | 365956 | |
| Soluzione tampone fosfato | 100 mM NaH 2 PO 4, 140 mM NaCl, pH 7,4 | ||
| Cocktail inibitori della proteasi, EDTA-free | Thermo Scientific | 78415 |
Riferimenti
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon