Method Article
Análisis de la importancia del tejido linforreticular nasofaríngeo asociado (NALT) en las respuestas de ratón a las vacunas
En este artículo
Resumen
Métodos para examinar las contribuciones de los tejidos nasofaríngeos linforreticulares-asociados (NALT) a la respuesta inmune sistémica nasales y de los ratones a las vacunas intranasales se describen. Se demuestra un procedimiento quirúrgico para establecer un modelo de ratón NALT-dependiente y Ex vivo Culturas de NALT extraídos.
Resumen
Los tejidos de la nasofaringe linforreticulares-asociados (NALT) que se encuentran en los seres humanos, roedores y otros mamíferos, contribuyen a la inmunidad en los senos nasales 1-3. El NALT dos paralelas en forma de campana estructuras localizadas en las fosas nasales por encima del paladar duro, y generalmente se considera que los componentes secundarios del sistema linfoide asociado a las mucosas 4-6. Situado dentro del NALT son compartimentos discretos de linfocitos B y T intercaladas con células presentadoras de antígeno dendríticas 4,7,8. Estas células están rodeadas por una capa de células epiteliales intercaladas con M-células que son responsables de la recuperación de antígenos de las superficies mucosas de los conductos de aire 9,10. Naive linfocitos que circulan a través de la NALT están preparados para responder a los primeros encuentros con patógenos respiratorios 7. Mientras que NALT desaparecen en los seres humanos a la edad de dos años, los órganos del anillo de Waldeyer y estructurado de manera similar linfáticos persisten ºroughout la vida 6. En contraste con los humanos, ratones retener NALT durante toda la vida, proporcionando así un modelo animal conveniente para el estudio de las respuestas inmunes originarios dentro de los senos nasales 11.
Los cultivos de una sola célula de suspensiones de NALT no son prácticos debido a los bajos rendimientos de células mononucleares. Sin embargo, la biología NALT pueden ser examinadas mediante el cultivo ex vivo del órgano intacto, y este método tiene la ventaja adicional de mantener la estructura de tejido natural. Para los estudios in vivo, los modelos genéticos knock-out que presentan defectos limitados a NALT no están disponibles en la actualidad, debido a una mala comprensión de la vía de desarrollo. Por ejemplo, mientras que la linfotoxina-alfa ratones knock-out se han atrofiado NALT, las placas de Peyer, ganglios linfáticos periféricos, las células dendríticas foliculares y otros tejidos linfoides también se alteran en estos ratones genéticamente manipulados 12,13. Como una alternativa a los ratones knockout de genes, p ablación quirúrgicaermanently elimina NALT de la fosa nasal, sin afectar otros tejidos. El modelo de ratón resultante se ha utilizado para establecer relaciones entre las respuestas NALT e inmune a las vacunas 1,3. Recolección de serie del suero, saliva, lavados nasales y secreciones vaginales es necesaria para establecer la base de las respuestas del huésped a la vacunación, mientras que las respuestas inmunes procedentes directamente de NALT se puede confirmar mediante cultivo de tejidos. Los procedimientos siguientes se describen las intervenciones quirúrgicas, cultivo de tejidos y toma de muestras necesarias para examinar locales y sistémicos respuesta inmune humoral a intranasal (IN) la vacunación.
Protocolo
1. Colección NALT y el cultivo
- La eutanasia de los ratones con las orientaciones aprobadas IACUC. Evite el uso de anestésicos por inhalación que pueden afectar a NALT. Transferencia de los ratones a una aséptica área de trabajo o gabinete de bioseguridad. Retire la mandíbula inferior del ratón y limpiar la zona del paladar superior con toallitas con alcohol y yodo.
- Use una hoja de bisturí N º 11 en el mango de bisturí para cortar cuidadosamente y los impuestos especiales el paladar superior, siguiendo el contorno interior de los incisivos y molares de ratón.
- Con cuidado retire el paladar con unas pinzas, teniendo cuidado de no romper el paladar.
- Este paso es necesario para reducir la contaminación de los cultivos y está diseñado para procesar múltiples paladares. Paladares Colocar en pocillos individuales en la primera columna de una estéril 48-así placa pre-llenado con 250 l de medio de cultivo completo (37 ° C) consistente en RPMI 1640 suplementado con suero fetal bovino al 10%, 100 mg / mL de estreptomicina, 100 IU / ml de penicilina, 50 mg / ml gentamicinay 1 mg / ml fungizona / anfotericina. Medios de comunicación deben ser carbonato de buffer si paladares se cultivan en un 5% de CO 2/95% de humedad aire de la incubadora (37 ° C), o bien, utilizar 10 mM HEPES pH 7,4, por falta de cultura de CO 2.
- Para lavar los paladares, utilizar pinzas para mover los paladares en cada pocillo sucesiva en una fila, tocando con cuidado la placa entre los lavados, hasta que el paladar ha sido objeto de un total de ocho lavados.
- Transferir los paladares en una nueva estéril 48-así placa que contiene 250 l de medio fresco, cultivo completo (37 ° C) en los pocillos.
- Colocar las placas que contienen los paladares en una incubadora a 37 ° C para el cultivo de la duración del estudio.
- Recoger muestras para su análisis por transferencia asépticamente 100 l de medio de los pocillos de cultivo en tubos Eppendorf cada 24 horas, reemplazando con 100 l de fresco 37 ° C medio de cultivo.
- Centrifugar las muestras de medios de cultivo a 380 xg durante 10 minutos, 4 ° C, a los desechos de pellets.
- Transferir el sobrenadante de la muestra se centrifuga a nuevos tubos Eppendorf y almacenar a -20 ° C hasta que esté listo para analizar.
- Antígeno específico de IgG, IgM e IgA, o citocinas se midió en el sobrenadante de cultivo de tejidos por el estándar de ensayos ligados a enzimas (ELISA).
2. La ablación quirúrgica de NALT
- Hembra BALB / c ratones, 7 a 9 semanas de edad, son temas adecuados, pero otras cepas son también aceptables. Proveer de gel como la comida húmeda de tres días antes de la cirugía para aclimatarse ratón para sustituir los alimentos y el agua que va a ser administrado después de la operación.
- Administrar una gota de medicamento Metacam alivio del dolor (1,5 mg / ml o 0,05 mg / gota) en la cavidad oral antes de la cirugía.
- Anestesiar a ratones con las orientaciones aprobadas IACUC, por ejemplo, con la ketamina, acepromacina, y la mezcla de xilazina (KAX) y aplique una pomada en los ojos Puralube veterinario para prevenir el secado. Evite el uso de anestésicos por inhalación que pueden afectar a NALT. Anesthesia puede ser confirmada por la ausencia de respuesta refleja a un pellizco suave de los dedos de los pies.
- Administrar 1 ml de solución salina (0,9% de cloruro de sodio inyectable USP) por vía subcutánea entre los omoplatos utilizando una aguja de calibre 22-28 y una jeringa para evitar la deshidratación potencial del ratón después de la cirugía. También se administran 0,1 ml de Respiram por vía subcutánea entre los omoplatos utilizando una aguja de calibre 22-28 y una jeringa para promover la respiración saludable durante y después de la cirugía.
- Proporcionar apoyo térmico para el ratón en todas las manipulaciones posteriores.
- Coloque el ratón anestesiado en posición supina, y utilizan dos circuitos independientes de sutura quirúrgica alrededor de los incisivos superiores e inferiores para sacar suavemente la boca abierta, dejando al descubierto el paladar superior.
- Utilizar un N ° 11 cuchilla quirúrgica para hacer una incisión de aproximadamente 3 mm de longitud por la línea media del paladar superior en el sitio de la NALT.
- Insertar un microcurette de 0,5 mm en la incisión y raspe suavemente debajo de los bordes ainterrumpir el NALT.
- Cauterize la incisión para detener la hemorragia con un lazo directo bien en una unidad de cauterio térmico.
- Continuar con el apoyo térmica, mientras que el ratón se recupera a la plena conciencia y la actividad.
- Proporcionar al ratón con solución salina por vía subcutánea hasta tres veces al día, 1 ml por inyección entre los omóplatos, para prevenir la deshidratación, como medicamentos para el dolor necesario y por vía oral una vez al día durante 3 días después de la cirugía. Determinar la deshidratación mediante la realización de una prueba de tienda de la piel para verificar la turgencia de la piel. Sujetar la piel y el pelo entre las cuchillas hombros de modo que quede levantada. Si la piel vuelve rápidamente a la posición normal, anterior, el ratón no está deshidratado. Si la piel permanece elevada y se mueve lentamente, el ratón está en un estado de deshidratación y requiere solución salina. Proporcionar alimento húmedo durante al menos tres días después de la cirugía para permitir el tiempo suficiente para la recuperación.
- Antes de cualquier procedimiento experimental, observar los ratones durante 8-10 días mediante el seguimiento de la ganancia de peso. La recuperación del peso deficientepor lo general indica la curación paladar incompleto, y estos ratones deben ser retirados de estudios.
3. Preparación NALT de Histología y evaluar el éxito de la cirugía NALT
- El éxito de la cirugía NALT debe ser comprobada por histología como se describe a continuación. Después de completar todos los estudios experimentales, preparar los ratones de las colecciones del cráneo por la eutanasia con las orientaciones aprobadas IACUC. Evite el uso de anestésicos por inhalación que pueden afectar a NALT.
- Sujete la parte posterior del cuello del ratón sacrificado. Retire la mandíbula inferior del resto del cráneo cortando con tijeras a través de los procesos condilares con unas tijeras a ambos lados.
- Comenzando por la nuca del cuello, retirar la piel y el pelo de la cabeza lentamente pelar y cortar hacia el lado ventral del cráneo.
- Retire con cuidado la piel alrededor de la zona nasal y cortar la piel de la punta del hocico hasta eliminar por completo.
- Separe el cráneo del ingenio vértebrasha recorte de las tijeras.
- Inserte las tijeras dentro del foramen magno y cortar hasta la mitad del cráneo a lo largo de la línea media para permitir la penetración de formol en los tejidos blandos durante la fijación.
- Fijar cráneo en 10% formalina tamponada neutra (MNB) durante 24 horas a temperatura ambiente.
- Para descalcificar, ponga la muestra y el cassette independiente, envuelto en una gasa para evitar Rexyn de tocar el hueso, en la botella con la mezcla de ácido fórmico. Incubar durante 12 horas a temperatura ambiente, luego enjuague continuamente bajo agua del grifo durante aproximadamente 20 minutos.
- Recortar la muestra al tabique y órbitas pasadas del ojo con una cuchilla de afeitar.
- Muestra y el cassette se pueden almacenar a corto plazo en 10% MNB.
- Colocar la muestra en un procesador de tejidos para su procesamiento durante la noche. Esto se hace para eliminar el agua de la muestra en preparación para la inclusión en parafina.
- Quitar el tejido procesado, integrar en un bloque de parafina con el hocico hacia abajo, y deje que se enfríe.
- Recorte rough 15 micras, las secciones transversales del bloque con un microtomo automatizado, acercándose a la localización aproximada del NALT, entonces continuar cortando en 5 secciones micras para el montaje en portaobjetos de vidrio en un 44,3 ° C baño de agua.
- Hematoxilina y eosina (H & E) tinción histológica debe ser utilizado para evaluar la ablación NALT.
4. Recolección de muestras biológicas procedentes de ratones
4.1 Suero
- Con cuidado, elevando la temperatura del cuerpo con una lámpara de calor se incrementa el flujo sanguíneo. Recoger la sangre por cortes en la vena lateral de la cola con una cuchilla quirúrgica. Permitir que la sangre gotee libremente en un tubo Microtainer separador de suero.
- Aplique una leve presión con el nick con material absorbente, como una gasa o una toalla, para detener el flujo de sangre.
- Permita que la sangre se coagule en las Microtainers durante 30 minutos y después centrifugar entre 6.15 x 1000 g por lo menos 90 segundos.
- Transferencia separa el suero de Microtainer en un tubo Eppendorf limpio dealmacenamiento a -80 ° C.
4.2 La saliva
- Sostenga el ratón anestesiado verticalmente, mientras que pipeteo 20-30 l fosfato estéril (PBS) entre la mejilla y la encía. Recoger la saliva diluida dirigiendo punta de la pipeta entre la mejilla y la encía.
- Transferir la saliva diluida a un tubo fresco que contiene 10 l de inhibidor de la proteasa 2x y almacenar a -20 ° C.
4.3 Las secreciones nasales
- La eutanasia del ratón antes de recoger las secreciones nasales, utilizando aprobado de guiado IACUC. Evite el uso de anestésicos por inhalación que pueden afectar a NALT.
- Al pasar el cursor vertical, cuidadosamente pipetear 30 L de PBS estéril en una fosa nasal y recoger de enjuague de la otra fosa nasal.
- Transferir enjuague a un tubo fresco que contiene 10 l de inhibidor de la proteasa 2x y almacenar a -20 ° C.
4.4 Las secreciones vaginales
- Insertar la punta de una micropipeta en la abertura de ªe vulva de un ratón de la eutanasia, lavar la vagina con 50 l de PBS estéril y recoger todo el líquido por la micropipeta.
- Transferir enjuague a un tubo fresco que contiene 10 l de inhibidor de la proteasa 2x y almacenar a -20 ° C.
5. Antígenos específicos de anticuerpos o citoquinas en las muestras recogidas se puede medir por ELISA u otro método cuantitativo.
6. Los resultados representativos
La Figura 1 proporciona un esquema general de los pasos implicados en el procesamiento del tejido que contiene NALT para el análisis ex vivo. En la Figura 2 (A, B), el tamaño del paladar se muestra, así como la ubicación de la incisión durante la cirugía de ablación (A), como se indica por la línea punteada. La ubicación de NALT están indicadas por flechas en la zona premolar en un extirpados hematoxilina-manchado paladar en la Figura 2 (C), mostrando los tejidos paralelas.
Figura 3presenta pasos de la cirugía interrupción NALT, mostrando la exposición del paladar superior para el acceso a NALT (A, B), la ablación (C), y cauterización final de la incisión (D). Un típico H y E sección transversal de la zona que rodea el seno nasal NALT antes de la cirugía se muestra en la Figura 3E, mientras que una imagen de interrupción por el NALT microcurette directamente después de la cirugía aparece en la Figura 3F. Dar suficiente tiempo para la recuperación de la cirugía, las incisiones se cierran y la cavidad nasal carece de NALT (Figura 3G).
Típicos resultados experimentales obtenidos mediante el uso de estas técnicas se muestran en la Figura 4, comparando los sobrenadantes de cultivo de tejidos y muestras biológicas de un estudio de una vacuna subunidad estafilocócica (STEBVax). Los ratones se les administró por vía intranasal STEBVax (IN) o intraperitoneal (IP). La vacuna se formuló con un adyuvante que activa el receptor tipo Toll-4 vía de 3,1 4, y los controles se les dio sólo solución salina o una vacuna sin adyuvante. NALT cultivadas obtenidas de los grupos experimentales secretada antígenos específicos de inmunoglobulinas en el medio de que se podía medir por ELISA. En este ejemplo (Figura 4A), los resultados indican que las mayores cantidades de IgA fueron liberados por NALT obtenido a partir de ratones vacunados con una vacuna EN subunidad combinada con adyuvante.
Las muestras biológicas (tales como la saliva suero, secreciones nasales, secreciones vaginales) adquiridos a partir de ratones de control o NALT libres se puede utilizar para perfilar la in vivo la respuesta inmune a los antígenos nasales para la comparación con los resultados de cultivo de tejidos. En la Figura 4B, IgA e IgG respuestas en materia de vacunación se redujo significativamente, sin NALT funcional. Los niveles de antígeno específico de IgA fueron generalmente mayores que la IgG en las secreciones mucosas (saliva, lavados nasales) de los ratones vacunados.
upload/3960/3960fig1.jpg "/>
Figura 1. Esquema de recogida NALT y el cultivo ex vivo.
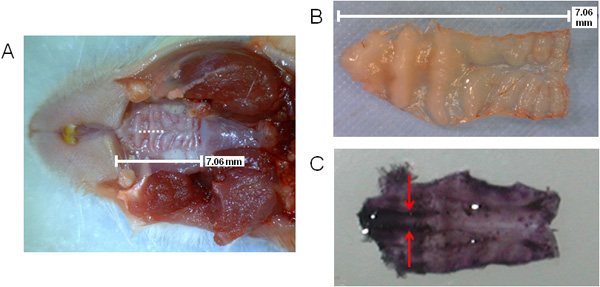
Figura 2. Visualización del paladar ratón que indica la posición de incisión NALT y cirugía. El tamaño y la ubicación de paladar superior con la incisión de la cirugía indicada por la línea de puntos (A); paladar superior eliminado (B) o teñidas en hematoxilina (C) para ver el NALT en paralelo en el área premolar de la boca (manchas de color púrpura oscuro en la parte anterior del paladar ). NALT indicado por las flechas.
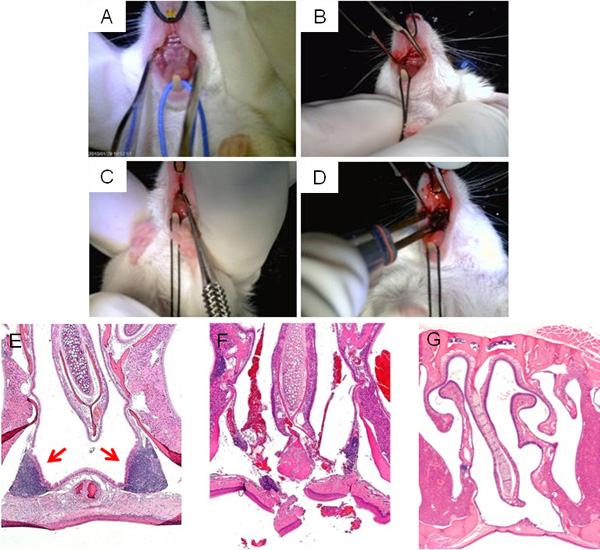
Figura 3. Interrupción NALT quirúrgica. Las etapas clave de la cirugía de interrupción NALT: vista en posición supina del paladar superior del ratón antes de la cirugía (A); incisión longitudinal realizado en el paladar superior para acceder a la NALT (B); sonda microcurette inserta a través de incisión mediana para romper la estructura de NALTtegridad (C); la cauterización de la incisión en la conclusión de la cirugía (D). Las imágenes microscópicas de las cavidades nasales, manchadas H & E, antes de la cirugía (E); inmediatamente después de la cirugía (F), y un éxito sanado, NALT sin ratón (G).
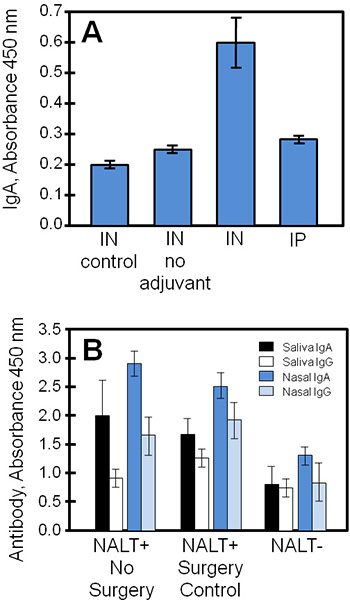
Figura 4. Vacunas de anticuerpos específicos de NALT culta, la saliva y las secreciones nasales recogidas de los ratones vacunados. El control de ratones libres de NALT o normal, o fueron vacunados en IP con STEBVax, y las muestras biológicas fueron recolectados. Los niveles de anticuerpos de muestras por triplicado fueron medidos mediante ELISA. (A) NALT fueron removidas de ratones de control (no manipulados quirúrgicamente) y se cultivan para examinar las respuestas de anticuerpos. La respuesta a la vacuna-IgA específica en la cultura de en los ratones vacunados fue estadísticamente diferente de los controles (Student t-test, p ≤ 0,01, en comparación con ningún adyuvante o la vacuna no). (B) La perturbación NALT reducido sustancialmente las respuestas de anticuerpos específicosque en la vacunación. Hubo diferencias significativas entre los niveles de anticuerpos específicos de NALT y NALT + grupos (sin cirugía, o cirugía de control) para todas las comparaciones excepto la saliva resultados de IgG (t de Student-test, p ≤ 0,05).
Discusión
Hemos presentado los métodos colectivos para el desarrollo de un modelo animal, la obtención de muestras biológicas, y los ensayos para el examen de NALT asociados a la respuesta inmune 1-4. Hay factores adicionales a tener en cuenta durante la realización de estos métodos. Norma técnicas estériles para cirugía y cultivo de tejidos deben ser seguidas. Una combinación de agentes antibacterianos y antifúngicos utilizados durante el aislamiento y cultivo, así como el mantenimiento de los instrumentos esterilizados, área de trabajo y paladares desinfectadas se reduce el riesgo de contaminación. La saliva, lavados nasales y similares muestras de la secreción de la mucosa debe ser inspeccionado por la posible contaminación con sangre, como los anticuerpos en suero se encuentran generalmente en concentraciones más altas. Además, las secreciones mucosas sólo debe ser ligeramente diluido para el análisis porque concentraciones más bajas de anticuerpos están presentes en estas muestras en comparación con el suero.
Los ratones deben mantenerse caliente directamente después de la cirugía previaventilar potencial de la anestesia inducida por la hipotermia. Alterne los ratones de descanso en sus caras durante la recuperación después de la cirugía para reducir al mínimo la respiración irregular. El procedimiento quirúrgico es más eficaz con tres individuos que trabajan juntos para completar estas tareas: una realización de la cirugía, uno para ayudar a mantener la boca abierta, y para proporcionar una atención postquirúrgica, como los ratones a recuperarse de la anestesia.
Es necesario el uso de la tinción H & E de las secciones transversales del cráneo al final de todos los procedimientos experimentales o estudios para verificar el éxito de la cirugía para cada ratón. Posibles resultados de cirugía son: la ablación completa NALT y bilaterales, la ablación incompleta, o NALT intacto. Debido a que no todas las cirugías se traducirá en una pérdida completa de la NALT, los animales con NALT residual o intacta puede ser utilizado como controles internos. Otro posible resultado es que el paladar no se cura por completo, dejando una abertura que conecta el nasal y la cavidad bucal. Incompletola curación del paladar dará lugar a su bajo peso y retraso del crecimiento, y que deberán ser retirados de los estudios.
Al examinar las respuestas de la vacuna en primer lugar con el modelo de ratón servirá para establecer el papel de NALT en el resultado del estudio previsto (respuesta de anticuerpos, la supervivencia, etc.) La extirpación quirúrgica de la NALT facilita la determinación de las contribuciones nasales a la inmunidad local y sistémica. El abordaje quirúrgico se describe aquí es el método más directo para la obtención de un modelo de ratón carente de NALT. Seleccione knock-out modelos de ratón han sido reportados a NALT la falta, pero estos animales también son deficientes en citocinas o quimiocinas esenciales para el desarrollo de otros tejidos linfoides secundarios, y pueden albergar otros defectos 12,13. Además, los métodos descritos aquí se han desarrollado para examinar varios aspectos de la respuesta inmune se originan dentro de los conductos nasales. Los resultados experimentales se basan en estudios que utilizan el Palat toda la parte superiore desde el ratón para cultivo de tejidos, aunque es posible que las secciones pueden ser utilizados. Finalmente, el modelo NALT cultivadas es útil para realizar experimentos completamente en cultivo de tejidos.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Se prestó apoyo por Becton Dickinson Tecnologías. Las opiniones expresadas en esta presentación son las de los autores y no pretenden reflejar la política oficial del Gobierno de los EE.UU.. La investigación fue realizada en cumplimiento de la Ley de Bienestar Animal y otras leyes federales y reglamentos relativos a los animales y los experimentos con animales y se adhiere a los principios establecidos en la Guía para el Cuidado y Uso de Animales de Laboratorio, Consejo Nacional de Investigación, 1996. La instalación donde se llevó a cabo esta investigación está totalmente acreditado por la Asociación para la Evaluación y Acreditación de Laboratorio Animal Care International.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| De acero inoxidable estériles hojas quirúrgicas, N º 11 | Miltex | 4-311 | |
| Mango del cuchillo, N º 3 | Miltex | 4-7 | |
| 48 y placas de cultivo celular | Costar | 3548 | |
| RPMI 1640 | Invitrogen | 11875-093 | |
| Suero bovino fetal, inactivado | Gibco / Invitrogen | 16000-044 | Conc. final: 10% en volumen en medios de cultivo |
| Sulfato de estreptomicina | Sigma | S9137 | Conc. final: 100 mg / mL |
| Penicilina | Sigma | P7794 | Concentración final: 100 UI / ml |
| Gentamicina | Sigma-Aldrich | G1397-10ML | Conc. final: 50 mg / mL |
| Fungizone | Gibco / Invitrogen | 15290-018 | Conc. final: 1 mg / mL |
| HEPES | Sigma-Aldrich | H0887 | Conc. final: 10 mM |
| Tubos Eppendorf Microcentrífuga | Eppendorf | 022364111 | |
| Nutra-gel de la cereza de Alimentos del Ratón Mojado Sabor | Bio-Serve | S4798-BANDEJA | |
| Metacam | Boehringer Ingelheim | 601531000 | Una gota de 1,5 mg / ml suspensión oral |
| La ketamina | Pfizer | 00856440301 | Co finalNC: 6,06 mg / ml |
| Acepromazina | Vedco | VEDC207 | Conc. final: 0,061 mg / ml |
| Xilacina | Lloyd | 4811 | Concentración final: 0,667 mg / ml |
| Puralube Ungüento Veterinario | Pharmaderm Sanidad Animal | 1621 | |
| 0,9% de cloruro sódico Inyección USP | Baxter | 2B1302 | |
| 0,5 mm Microcurette | Roboz | RS-6350 | |
| Unidad de cauterio térmico | Geiger | 150-S/150A-S | |
| TCU Punta de repuesto, lazo fino recto | Geiger | 214 | |
| Tijeras quirúrgicas | |||
| 10% de formalina neutra tamponada | Sigma | HT501128 | |
| Ácido fórmico | Pescador | A119P-4 | Mezclar 426 ml de ácido fórmico en 1047 mL de agua corriente, a continuación, añadir 45 ml Rexyn 101 (H) |
| Rexyn 101 (H) | Pescador | R231-500 | |
| Tissue-Tek VIP E150/E300 | Sakura | ||
| Micrótomo rotatorio | Leica | RM2255 | |
| Hematoxilina de Mayer | Sigma | MHS16-500ML | |
| Gill N º 1 hematoxilina | Sigma | GHS116 | |
| Eosina B | Sigma | 2853 | |
| Microtainer separadores de suero | BD Médico | 365956 | |
| Tampón fosfato salino | 100 mM de NaH 2 PO 4, 140 mM de NaCl, pH 7,4 | ||
| Cóctel de inhibidores de la proteasa, EDTA libre | Thermo Scientific | 78415 |
Referencias
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados