Method Article
Analisar o papel dos Nasopharyngeal-associado do tecido linforreticular (NALT) nas respostas do rato para Vacinas
Neste Artigo
Resumo
Métodos para examinar as contribuições dos tecidos da nasofaringe associados linforreticular (NALT) para nasais e sistêmicas respostas imunes de camundongos de vacinas intranasais são descritos. Nós demonstramos um procedimento cirúrgico para estabelecer um modelo de camundongo NALT-dependente e Ex vivo Culturas de NALT extraído.
Resumo
Os tecidos da nasofaringe-associados (linforreticular NALT) encontrados em seres humanos, roedores, e outros mamíferos, contribuir para a imunidade nos seios nasais 1-3. O NALT são duas paralelas em forma de sino estruturas localizadas nas passagens nasais acima do palato duro, e são geralmente considerados como componentes secundários do sistema da mucosa linfóide associado 4-6. Localizado dentro do NALT são compartimentos discretos de linfócitos B e T intercaladas com apresentadoras de antigénio de células dendríticas 4,7,8. Estas células estão rodeados por uma camada de células epiteliais, intercaladas com M-células que são responsáveis para a recuperação de antigénio a partir das superfícies das mucosas das passagens de ar 9,10. Linfócitos ingênuas que circulam através da NALT estão preparados para responder aos primeiros encontros com patógenos respiratórios 7. Enquanto NALT desaparecer em seres humanos até a idade de dois anos, os órgãos do anel linfático de Waldeyer e da mesma forma estruturada continuam a persistir ªroughout vida 6. Em contraste com os seres humanos, os ratinhos reter NALT durante toda a vida, proporcionando assim um modelo animal conveniente para o estudo das respostas imunitárias originários dentro dos seios nasais 11.
As culturas de célula única suspensões de NALT não são práticos devido a baixos rendimentos de células mononucleares. No entanto, a biologia NALT pode ser examinada por cultura ex vivo do órgão intacta, e este método tem a vantagem adicional de manter a estrutura de tecido natural. Para os estudos in vivo, os modelos de nocaute genético apresentando defeitos limitados a NALT não estão atualmente disponíveis devido a uma má compreensão da via de desenvolvimento. Por exemplo, enquanto linfotoxina-ct ratinhos knockout atrofiaram NALT, placas de Peyer, nódulos linfáticos periféricos, células dendríticas foliculares e outros tecidos linfóides também são alterados nestes ratos geneticamente manipulados 12,13. Como uma alternativa para ratinhos knockout de genes, p ablação cirúrgicaermanently elimina NALT da passagem nasal, sem afetar outros tecidos. O modelo de rato resultante foi usado para estabelecer relações entre as respostas de NALT e imune às vacinas 1,3. Colecção de série do soro, saliva, lavagens nasais e secreções vaginais é necessário para o estabelecimento da base da resposta do hospedeiro à vacinação, enquanto que as respostas imunitárias originários directamente a partir NALT pode ser confirmada por cultura de tecidos. Os procedimentos a seguir descrevem as cirurgias, cultura de tecidos e coleta de amostra necessários para examinar locais e sistêmicos resposta imune humoral a vacinação intranasal (IN).
Protocolo
1. Colecção NALT e cultura
- Euthanize ratos usando aprovado orientação IACUC. Evite o uso de anestésicos inalantes que possam afetar NALT. Transferência ratos para um espaço de trabalho asséptico ou cabine de segurança biológica. Retire o maxilar inferior do mouse e limpar a área palato superior com toalhetes com álcool e iodo.
- Use uma lâmina cirúrgica n º 11 no cabo da faca cirúrgica para cortar cuidadosamente e consumo do palato superior, seguindo o contorno interior dos dentes incisivos do rato e os dentes molares.
- Suavemente descole o paladar com uma pinça, tomando cuidado para não rasgar o paladar.
- Este passo é necessário para reduzir a contaminação das culturas e é desenhado para processar paladares múltiplas. Paladares lugar em poços individuais na primeira coluna de uma placa de 48 poços estéreis pré-cheias com 250 uL de meio de cultura completo (37 ° C) consistindo em RPMI 1640 suplementado com 10% de soro fetal de bovino, estreptomicina 100 ug / mL, 100 UI / mL de penicilina, 50 ug / mL de gentamicinae 1 mg / mL fungizona / anfotericina. Os meios devem ser tamponadas se carbonato de paladares são cultivadas em um 5% de CO2 / 95% húmido incubadora de ar (37 ° C), ou, alternativamente, utilizar HEPES 10 mM, pH 7,4, para não-CO cultura 2.
- Para lavar os paladares, utilize uma pinça para mover paladares em cada poço sucessiva em uma linha, cuidadosamente tocar no prato entre as lavagens, até o palato foi submetido a um total de oito lavagens.
- Transfira os paladares em uma nova placa de 48 poços estéril contendo 250 uL de meio de cultura fresco, completo (37 ° C) em poços.
- Colocar as placas contendo os paladares numa incubadora a 37 ° C para a cultura durante a duração do estudo.
- Recolher amostras para análise por transferência de assepticamente 100 uL de meio de cultura a partir de poços em tubos Eppendorf a cada 24 horas, substituindo com 100 uL de 37 ° fresco meio de cultura C.
- Centrifugar media das amostras de cultura a 380 xg durante 10 minutos, 4 ° C, para os detritos de ressuspensão.
- Transferir o sobrenadante a partir da amostra centrifugada para tubos frescos Eppendorf e armazenar a -20 ° C até estar pronto para analisar.
- Antigénio específico IgG, IgM e IgA, ou citocinas secretadas são medidos em sobrenadantes de cultura de tecidos por padrão enzyme-linked immunosorbent (ELISA).
2. Ablação cirúrgica da NALT
- Fêmeas BALB / c, de 7 a 9 semanas de idade, são sujeitos adequados, mas outras estirpes são também aceitáveis. Fornecer-gel como alimento molhado três dias antes da cirurgia para se aclimatarem rato a comida e água substituto que será administrado pós-operação.
- Administrar uma gota de medicamento Metacam alívio da dor (1,5 mg / ml ou 0,05 mg / gota) para a cavidade oral antes da cirurgia.
- Anestesiar ratos usando aprovado orientação IACUC, por exemplo, com uma cetamina, acepromazina, ea mistura de xilazina (KAX) e aplicar Pomada Vet Puralube para os olhos para evitar a secagem. Evite o uso de anestésicos inalantes que possam afetar NALT. Anesthesia pode ser confirmado pela ausência de resposta a um reflexo beliscadura suave dos dedos dos pés.
- Administrar 1 ml de solução salina (0,9% de sódio USP injecção de cloreto) por via subcutânea entre as omoplatas usando uma agulha de calibre 22-28 e seringa para evitar a desidratação potencial do rato após a cirurgia. Também administrar 0,1 mL de Respiram por via subcutânea entre as omoplatas usando uma agulha de calibre 22-28 e seringa para promover a respiração saudável durante e após a cirurgia.
- Fornecer suporte térmico para o mouse durante todas as manipulações posteriores.
- Posicione o mouse anestesiados em decúbito dorsal, e usar dois loops separados de sutura cirúrgica, em torno dos incisivos superiores e inferiores suavemente para forçar a abertura da boca, expondo o palato superior.
- Usar uma lâmina cirúrgica No. 11 para fazer uma incisão de aproximadamente 3 mm de comprimento para baixo da linha média do palato superior no local da NALT.
- Insira um microcurette 0,5 mm na incisão e raspe com as bordas paraperturbar o NALT.
- Cauterizar a incisão para parar o sangramento com um laço direto bem em uma unidade térmica cautério.
- Continuar a apoiar térmico enquanto se recupera do mouse para a plena consciência e atividade.
- Fornecer rato com uma solução salina por via subcutânea até três vezes por dia, 1 ml por injecção entre as omoplatas, para evitar a desidratação como medicação para a dor necessário e por via oral uma vez por dia durante 3 dias pós-cirurgia. Determinar a desidratação através da realização de um teste de pele tenda para verificar turgor da pele. Agarrar a pele e pelagem entre as lâminas de ombros de modo que é tenda para cima. Se a pele rapidamente retorna para a posição normal, anterior, o rato não é desidratado. Se a pele permanece elevada e move-se lentamente, o rato se encontra num estado de desidratação e requer salina. Fornecer alimento molhado por pelo menos três dias após a cirurgia para permitir tempo suficiente para a recuperação.
- Antes de quaisquer procedimentos experimentais, os ratos para observar 8-10 dias seguindo o ganho de peso. Recuperação do peso pobresgeralmente indica cura palato incompleta, e esses ratos devem ser retirados estudos posteriores.
3. Preparando NALT para Histologia e avaliar o sucesso de Cirurgia NALT
- O sucesso da cirurgia NALT deverá ser verificado por histologia, como descrito abaixo. Depois de completar todos os estudos experimentais, preparar ratos para coleções cranianos por eutanásia utilizando aprovado orientação IACUC. Evite o uso de anestésicos inalantes que possam afetar NALT.
- Segure a nuca do mouse sacrificados. Remover o mandíbula inferior do resto do crânio cortando através dos processos condilares com uma tesoura de ambos os lados.
- Começando pela nuca, retire a pele e pêlo do crânio por lentamente descascar e cortar para o lado ventral do crânio.
- Cuidadosamente remover a pele em torno da área nasal e cortar a pele fora da ponta do focinho para remover completamente.
- Retire o crânio da sagacidade vértebrasha recorte da tesoura.
- Insira uma tesoura no forame magno e cortar na metade do crânio ao longo da linha média para permitir a permeação de formol para os tecidos moles durante a fixação.
- Corrigir crânio em 10% formalina tamponada neutra (NBF) durante 24 horas à temperatura ambiente.
- Para descalcificar, colocar a amostra e cassete separada, envolta em gaze para evitar Rexyn de tocar no osso, em garrafa com a mistura de ácido fórmico. Incubar durante 12 horas à temperatura ambiente, em seguida, lavar continuamente sob água da torneira durante cerca de 20 minutos.
- Apare a amostra para o septo e órbitas passado o olho com uma lâmina de barbear.
- Amostra e cassete pode ser armazenado por curto prazo em NBF 10%.
- Coloque amostra para um processador de tecidos para o processamento durante a noite. Isto é feito para remover a água a partir da amostra, em preparação para inclusão em parafina.
- Remover o tecido processado, incorporar em um bloco de parafina com o focinho para baixo, e deixe-a arrefecer.
- Apare rOUGH 15 uM secções transversais do bloco com um micrótomo automatizado, aproximando-se a localização aproximada da NALT, em seguida, continuar o corte em 5 secções iM para a montagem em lâminas de vidro em um banho de água 44,3 ° C.
- Hematoxilina e eosina (H e E) de coloração histológica deve ser usado para avaliar a ablação NALT.
4. Coleta de amostras biológicas de ratos
4,1 Soro
- Cuidadosamente elevando a temperatura do corpo com uma lâmpada de calor irá aumentar o fluxo sanguíneo. Colher sangue por cortando a veia lateral da cauda com uma lâmina cirúrgica. Permitir que o sangue a escorrer livremente dentro de um tubo separador Microtainer soro.
- Aplique uma pressão suave para nick com material absorvente, como gaze ou toalha, para parar o fluxo de sangue.
- Permitir que a coagulação do sangue nas Microtainers durante 30 minutos, em seguida, centrifuga entre 6-15 x 1000 g durante pelo menos 90 segundos.
- Transferência separados soro de Microtainer para um tubo de Eppendorf limpo paraarmazenamento a -80 ° C.
4,2 Saliva
- Segurar o rato anestesiado verticalmente enquanto pipetagem 20-30 fosfato uL estéril tamponada (PBS) entre a bochecha ea gengiva. Coletar a saliva diluída dirigindo ponta da pipeta entre a bochecha ea gengiva.
- Transferir a saliva diluída a um tubo fresco contendo 10 ul de inibidor de protease 2x e armazenar a -20 ° C.
4.3 As secreções nasais
- Euthanize do mouse antes de recolher secreções nasais, usando a orientação IACUC aprovado. Evite o uso de anestésicos inalantes que possam afetar NALT.
- Segurando o mouse verticalmente, com cuidado pipetar 30 uL de PBS estéril em uma narina e recolher lavar de outra narina.
- Transferir lavagem para um tubo fresco contendo 10 ul de inibidor de protease 2x e armazenar a -20 ° C.
4.4 As secreções vaginais
- Introduzir a ponta de uma micropipeta para dentro da abertura de the vulva de um mouse eutanásia, lavar a vagina com 50 mL de PBS estéril e recolher todo o fluido por micropipeta.
- Transferir lavagem para um tubo fresco contendo 10 ul de inibidor de protease 2x e armazenar a -20 ° C.
5. Antigénio de anticorpos específicos ou citocinas nas amostras recolhidas podem ser medidos por ELISA ou outro método quantitativo.
6. Os resultados representativos
A Figura 1 fornece uma representação esquemática geral de passos envolvidos com o processamento do tecido NALT contendo para análise ex vivo. Na Figura 2 (A, B), o tamanho do palato é mostrado, bem como o local da incisão durante a cirurgia de ablação (A), como indicado pela linha pontilhada. A localização do NALT são indicadas por setas na área pré-molares em um excisado palato hematoxilina-corados na Figura 2 (C), mostrando os tecidos paralelas.
A Figura 3apresenta passos da cirurgia ruptura NALT, mostrando a exposição do palato superior para o acesso a NALT (A, B), a ablação (C), e cauterização final da incisão (D). Um típico H e E secção transversal da área do seio nasal em torno do NALT antes da cirurgia é mostrado na Figura 3E, enquanto uma imagem de ruptura NALT pelo microcurette directamente após a cirurgia aparece na Figura 3F. Permitindo tempo suficiente para a recuperação de uma cirurgia, as incisões deve ser fechado ea cavidade nasal desprovido de NALT (Figura 3G).
Típicos resultados experimentais obtidos usando estas técnicas são mostradas na Figura 4, comparando os sobrenadantes de cultura de tecidos e as amostras biológicas a partir de um estudo de uma vacina de subunidade estafilocócica (STEBVax). Os ratinhos foram administrados por STEBVax intranasal (IN) ou intraperitoneal (ip) rotas. A vacina foi formulada com um adjuvante que ativa o receptor Toll-like 4 vias 3,1 4, e os controlos foram dadas apenas a solução salina ou vacina sem adjuvante. NALT Cultured obtido a partir de grupos experimentais secretada específicas de antigénio imunoglobulinas em meio que era mensurável por ELISA. Neste exemplo (Figura 4A), os resultados indicam que as maiores quantidades de IgA foram libertados por NALT obtido a partir de ratinhos vacinados com uma vacina de subunidade combinado com adjuvante.
As amostras biológicas (tais como saliva, soro, secreções nasais, secreções vaginais) adquiridos a partir de controlo ou NALT livres de ratinhos pode ser usado para determinar o perfil da in vivo a resposta imune a antigénios nasais para comparação com os resultados de cultura de tecidos. Na Figura 4B, IgA e IgG respostas na vacinação foram significativamente reduzida sem NALT funcional. Os níveis de antigénio específico IgA foram geralmente maior do que a IgG em secreções mucosas (saliva, lavagens nasais) de ratinhos vacinados.
upload/3960/3960fig1.jpg "/>
Figura 1. Esquemático de NALT recolha e cultura ex vivo.
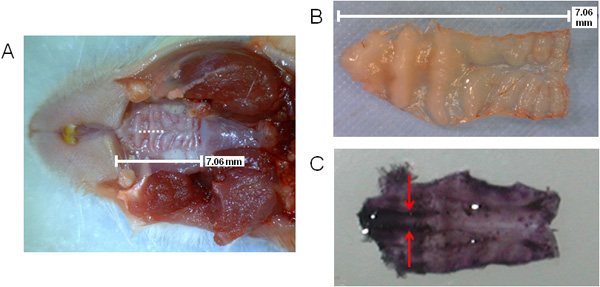
Figura 2. Visualização do palato rato que indica a posição de incisão NALT e cirurgia. Tamanho e localização do palato superior, com incisão da cirurgia indicada pela linha pontilhada (A); palato superior cortado (B) ou corados em hematoxilina (C) para ver o NALT paralelo na área pré-molar do palato (manchas roxas escuras na face anterior do palato ). NALT indicado pelas setas.
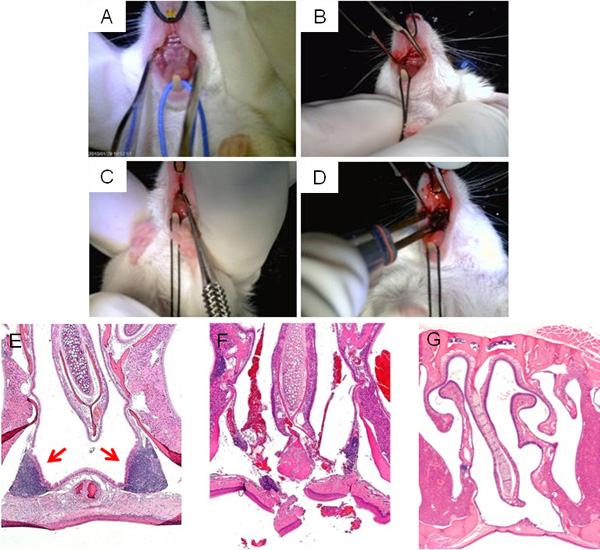
Figura 3. Ruptura NALT cirúrgica. As principais fases da cirurgia interrupção NALT: vista supina do palato superior do mouse antes da cirurgia (A); incisão mediana feita em palato superior para acessar o NALT (B); microcurette sonda inserida através de uma incisão na linha média para interromper estrutura NALT emTegrity (C); cauterização de incisão na conclusão da operação (D). As imagens microscópicas das cavidades nasais e coradas H & E, antes da cirurgia (E), imediatamente após a cirurgia (F), e um sucesso curado, rato NALT-livre (G).
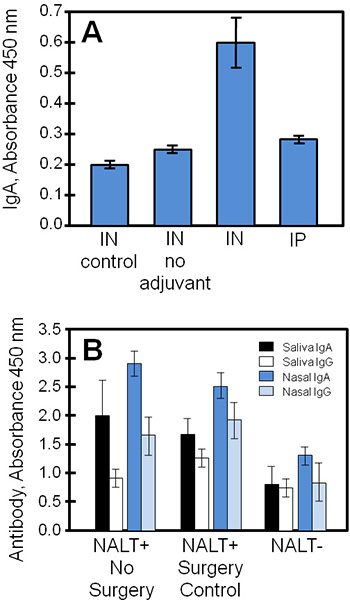
Figura 4. Vacinas específicas de anticorpos de NALT cultivadas, saliva e secreções nasais recolhidos a partir de ratinhos vacinados. Camundongos de controle NALT livres ou normal ou foram vacinadas em IP com STEBVax, e amostras biológicas foram coletadas. Os níveis de anticorpos de amostras em triplicado foram medidos através de ELISA. (A) NALT foram removidos a partir de ratos de controlo (não manipulada cirurgicamente) e cultivadas para examinar as respostas de anticorpos. A vacina específica resposta de IgA em cultura durante Em ratinhos vacinados foi estatisticamente diferente dos controlos de (teste t de Student-, p ≤ 0,01, em comparação com nenhuma adjuvante ou nenhuma vacina). (B) uma ruptura NALT substancialmente reduzida respostas de anticorpos específicosa IN vacinação. Houve diferenças significativas entre os níveis de anticorpos específicos de NALT e NALT + grupos (sem cirurgia cirurgia ou controle) para todas as comparações, exceto resultados saliva IgG (teste t de Student, p ≤ 0,05).
Discussão
Apresentamos métodos colectivos para o desenvolvimento de um modelo animal, a obtenção de amostras biológicas, e ensaios de análise dos NALT-associados respostas imunes 1-4. Há fatores adicionais a serem considerados durante a execução destes métodos. Padrão técnicas estéreis para cirurgia e cultura de tecidos devem ser seguidas. Uma combinação de agentes antibacterianos e antifúngicos utilizados durante o isolamento e cultura, assim como a manutenção dos instrumentos esterilizados, área de trabalho e paladares desinfectadas irá reduzir o risco de contaminação. Saliva, lavagens nasais e semelhantes amostras de secreção mucosa devem ser inspecionados para potencial contaminação com sangue, como de anticorpos séricos são geralmente encontrados em concentrações mais elevadas. Além disso, as secreções mucosas só deve ser ligeiramente diluída para análise, porque as concentrações mais baixas de anticorpos estão presentes nessas amostras em comparação com soro.
Ratos deve ser mantido quente directamente após a cirurgia para prédesabafar Hipotermia decorrente de anestesia potencial. Alternativas ratos em repouso em seus lados durante a recuperação pós-cirurgia para minimizar a respiração irregular. O procedimento cirúrgico é mais eficiente, com três indivíduos que trabalham juntos para completar estas tarefas: uma realização da cirurgia, uma para ajudar a segurar a boca aberta, e um para fornecer o cuidado pós-cirúrgico, como os ratos recuperar da anestesia.
É necessário utilizar H e E coloração de cranianos secções transversais na extremidade de todos os procedimentos experimentais ou em estudos para verificar o sucesso da operação para cada rato. Os resultados da cirurgia são possíveis: a ablação NALT completa e bilateral, a ablação incompleta ou NALT intacta. Uma vez que nem todas as cirurgias irá resultar na perda completa da NALT, os animais com NALT residual ou intactos podem ser utilizados como controlos internos. Outro resultado potencial é que o paladar não curar completamente, deixando uma abertura de ligação da nasal e as cavidades orais. Incompletocura do palato irá resultar em baixo peso e falha de crescimento, e estes indivíduos devem ser removidos a partir de estudos.
Examinando as respostas primeira vacina com o modelo de rato irá servir para estabelecer um papel para NALT no resultado do estudo pretendido (resposta de anticorpos, a sobrevivência, etc.) A remoção cirúrgica do NALT facilita a determinação das contribuições nasais a imunidade local e sistêmica. A abordagem cirúrgica descrita aqui é o método mais direto para a obtenção de um modelo de mouse sem NALT. Seleccione knock-out modelos de ratos foram relatados para NALT falta, mas estes animais também são deficientes em citocinas ou quimiocinas essenciais para o desenvolvimento de outros tecidos linfóides secundários, e pode conter defeitos adicionais 12,13. Além disso, os métodos descritos aqui foram desenvolvidos para análise de vários aspectos de respostas imunes que originam dentro das passagens nasais. Os resultados experimentais são baseados em estudos utilizando o palat toda a parte superiore do rato para cultura de tecidos, embora seja possível que as secções podem ser utilizados. Finalmente, o modelo NALT cultivadas é útil para a realização de experiências completamente em cultura de tecidos.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
O apoio foi prestado por Becton Dickinson Technologies. As opiniões expressas nesta apresentação são de responsabilidade dos autores e não pretendem refletir a política oficial do governo dos EUA. A pesquisa foi realizada em conformidade com o Animal Welfare Act e outras leis federais e regulamentos relativos aos animais e experimentos envolvendo animais e adere a princípios estabelecidos no Guia para o Cuidado e Uso de Animais de Laboratório, National Research Council, 1996. O local onde foi realizada esta pesquisa está totalmente credenciada pela Associação de Avaliação e Acreditação do Animal de Laboratório Care International.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentários |
| De aço inoxidável esterilizadas lâminas cirúrgicas, No. 11 | Miltex | 4-311 | |
| Cabo da faca, No. 3 | Miltex | 4-7 | |
| 48-poços de cultura placas da célula | Costar | 3548 | |
| RPMI 1640 | Invitrogen | 11875-093 | |
| Soro de bovino fetal, inactivado pelo calor | Gibco / Invitrogen | 16000-044 | Concentração final: 10% em volume em meios de cultura |
| Sulfato de estreptomicina | Sigma | S9137 | Concentração final: 100 mcg / ml |
| Penicilina | Sigma | P7794 | Final Conc: 100 UI / mL |
| Gentamicina | Sigma-Aldrich | G1397-10ML | Concentração final: 50 ug / mL |
| Fungizone | Gibco / Invitrogen | 15290-018 | Concentração final: 1 ug / mL |
| HEPES | Sigma-Aldrich | H0887 | Concentração final: 10 mM |
| Microcentrífuga Eppendorf Tubes | Eppendorf | 022364111 | |
| Nutra-gel de cerejeira Comida Rato Molhado Flavored | Bio-Servir | S4798 TRAY- | |
| Metacam | Boehringer Ingelheim | 601531000 | Uma gota de 1,5 mg / ml suspensão oral |
| Ketamina | Pfizer | 00856440301 | Co finalnc: 6,06 mg / mL |
| Acepromazina | Vedco | VEDC207 | Final Conc: 0,061 mg / mL |
| Xilazina | Lloyd | 4811 | Final Conc: 0,667 mg / mL |
| Puralube Pomada Vet | Pharmaderm Saúde Animal | 1621 | |
| 0,9% de sódio USP Injecção de Cloreto | Baxter | 2B1302 | |
| 0,5 milímetros Microcurette | Roboz | RS-6350 | |
| Unidade Cauterização Térmica | Geiger | 150-S/150A-S | |
| TCU Dica substituição, Loop Fino Direto | Geiger | 214 | |
| Tesoura cirúrgica | |||
| 10% formalina tamponada neutra | Sigma | HT501128 | |
| Ácido fórmico | Pescador | A119P-4 | Misturar 426 mL de ácido fórmico em 1047 mL de água da torneira, em seguida, adicionar 45 mL Rexyn 101 (H) |
| Rexyn 101 (H) | Pescador | R231-500 | |
| Tissue-Tek VIP E150/E300 | Sakura | ||
| Micrótomo rotativo | Leica | RM2255 | |
| Hematoxilina de Mayer | Sigma | MHS16-500ML | |
| Gill No.1 Hematoxilina | Sigma | GHS116 | |
| Eosina B | Sigma | 2853 | |
| Microtainer separador de soro | BD Médico | 365956 | |
| Tampão fosfato salino | 100 mM NaH 2 PO 4, 140 mM de NaCl, pH 7,4 | ||
| Cocktail de inibidores da protease, EDTA-livre | Thermo Scientific | 78415 |
Referências
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados