A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزلة البروتينية ريبوسوم الوليدة منضم
In This Article
Summary
وصفت وهناك تقنية لتحديد المواقع وقفة متعدية على مرنا. ويستند هذا الإجراء على عزل البروتينية وليدة تراكم على ريبوسوم في المختبر خلال ترجمة لمرنا هدف، يليه تحليل حجم السلاسل الوليدة باستخدام هلام إستشراد يبدل طبيعة المكونات.
Abstract
معدل استطالة متعدية هي غير موحدة. مرنا هيكل الثانوي، واستخدام كودون ومرنا البروتينات المرتبطة بها قد تغير حركة الريبوسوم على رسالة للمراجعة انظر 1. ومع ذلك، وانه الآن من المتفق عليه على نطاق واسع أن استخدام مرادف كودون هو السبب الرئيسي للمنظمات غير موحدة معدلات استطالة متعدية 1. لا تستخدم الكودونات المترادفة مع تردد متطابقة. والتحيز موجود في استخدام الكودونات المترادفة مع بعض الكودونات المستخدمة بشكل متكرر أكثر من غيرها 2. كودون التحيز هو كائن حي، وكذلك الأنسجة محددة 2،3. وعلاوة على ذلك، وتواتر استخدام كودون يتناسب طرديا مع تركيزات tRNAs وما شابه ذلك 4. وبالتالي، فإن كودون المستخدمة بشكل متكرر وارتفاع عدد وافر من tRNAs المقابلة، وهو ما يعني كذلك أن ترجم كودون متكررة بشكل أسرع من واحد نادر. وبالتالي، سيكون مرنا في المناطق ثراء في كودونات نادر (مواقع وقفة المحتملة) كقاعدة تبطئ حركة الريبوسوم في المساءجنرال الكتريك وسبب تراكم الببتيد الوليدة من أحجام كل منها 5-8. هذه المواقع يمكن أن يكون لها تأثير وقفة وظيفي على تعبير البروتين، واستقرار مرنا وقابلة للطي البروتين للمراجعة انظر 9. في الواقع، تبين أن التخفيف من هذه المواقع وقفة يمكن أن يغير حركة الريبوسوم على مرنا، وبعد ذلك قد يؤثر على كفاءة المشارك متعدية طي البروتين (في الحي) 1،7،10،11. لفهم عملية طي البروتين في الجسم الحي، في الخلية، ويقترن ذلك في نهاية المطاف إلى عملية تخليق البروتين من الضروري أن تحصل على معلومات شاملة عن تأثير استخدام محتوى / الحمض الريبي النووي النقال كودون على حركة ريبوسوم على طول مرنا أثناء استطالة متعدية .
نحن هنا وصف تقنية بسيطة والتي يمكن استخدامها لتحديد المواقع الرئيسية وقفة ترجمة لمرنا نظرا تترجم في نظم خالية من الخلايا المختلفة 6-8. ويستند هذا الإجراء على العزلة من accumulati البروتينية الوليدةنانوغرام في ريبوسوم خلال الترجمة في المختبر لمرنا الهدف. الأساس المنطقي هو أن في التردد المنخفض كودونات، الزيادة في وقت الإقامة للنتائج ريبوسوم في زيادة كميات الببتيدات الوليدة من أحجام المقابلة. في المختبر مرنا المحولة يستخدم لردود الفعل في المختبر متعدية في وجود الأحماض الأمينية المسمى بالإشعاع للسماح للكشف عن السلاسل الوليدة. من أجل عزل متجهة الوليدة الريبوسوم المجمعات ببتيد والطبقات رد فعل الترجمة على رأس حل الجلسرين بنسبة 30٪ تليها الطرد المركزي. يتم التعامل مع مزيد من البروتينية الوليدة في بيليه polysomal مع ريبونوكلياز ألف وحلها بواسطة SDS PAGE. ويمكن هذه التقنية المستخدمة المحتمل لأي بروتين ويسمح تحليل حركة الريبوسوم على طول مرنا والكشف عن مواقع وقفة كبيرة. وبالإضافة إلى ذلك، يمكن تكييف هذا البروتوكول لدراسة العوامل والظروف التي يمكن أن تغير حركة الريبوسوم، وبالتالي يحتمل أن يغير أيضا عشره وظيفة / التشكل من البروتين.
Protocol
1. الحمض النووي تحضير قالب والنسخ في المختبر
- يتم استنساخ الجينات التي تهم تحت / و T7 أو على سبيل المثال SP6 المروج النسخي.
- لفي المختبر والنسخ الخطي الحمض النووي قالب مع انزيم تقييد المناسبة قطع المصب من كودون وقف ORF و / أو مرنا نهاية 3 '. يحتاج المرء للتحقق من الخطية كاملة من الحمض النووي البلازميد عن طريق تشغيل المنتج الهضم قيود على الكهربائي للهلام الاغاروز.
- يتم استخدام البلازميد خطي لفي رد فعل النسخ المختبر. ويمكن اختبار تركيز مختلفة من الحمض النووي لتحديد قالب الأمثل تركيز الحمض النووي المطلوب لنسخ في المختبر. عموما، مع Ambion في MEGAscript عالية الغلة كيت النسخ (Ambion / الحياة تكنولوجيز، وغراند ايلاند، نيويورك)، 1 ميكروغرام الحمض النووي الخطي ينتج 40-60 ميكروغرام من مرنا. في النسخ المختبر ويتم ذلك بعد تعليمات الشركة الصانعة (Ambion / الحياة تكنولوجيز، وغراند الجزيرد، نيويورك).
- بعد النسخ في المختبر يتم تنقيته من مرنا من قبل هطول الأمطار كلوريد الليثيوم وفقا لتعليمات الشركة الصانعة (Ambion في MEGAscript النسخ عالية الغلة كيت).
- يتم التحقق من سلامة مزيد مرنا بواسطة الكهربائي عن المواد الهلامية أو الاغاروز الأكريلاميد.
2. ترجمة الخلايا في المختبر الحرة
للترجمة في المختبر باستخدام R abbit R eticulocyte المحللة، RRL (Promega، ماديسون، ويسكونسن) اتبع الخطوات التالية:
- إعداد 100 ميكروليتر في تعليم المختبر التالية رد فعل الشركة المصنعة للترجمة. لفترة وجيزة، في المياه nuclease مجانا إضافة 2 ميكرولتر خليط من الأحماض الأمينية الميثيونين ناقص (1 ملم)، 10 وحدات من المانع ريبونوكلياز (إينفيتروجن / الحياة تكنولوجيز، وغراند ايلاند، نيويورك)، و 20 μCi المشعة [S 35]، الميثيونين (Biomedicals النائب، سولون، أوهايو)، و 70 ميكرولتر من الأرنب بالشبكيات المحللة (Promega، ماديسون، ويسكونسن).
- احتضان عشررد فعل ه في درجة حرارة 30 مئوية لمدة 5 دقائق إلى ما قبل دافئ رد فعل الترجمة. إضافة 2 ميكروغرام من مرنا إلى رد فعل الترجمة واحتضان في درجة حرارة 30 مئوية لمدة 5 دقائق.
- وقف رد فعل عن طريق وضع رد فعل الترجمة على الجليد.
3. عزلة البروتينية الوليدة من رد الفعل في ترجمة المختبر
- لعزل ببتيد الوليدة ملزمة لريبوسوم (polysome)، والطبقات رد فعل الترجمة على أعلى من 4.5 مل من الجلسرين 30٪ في 10 ملي درجة الحموضة عازلة تريس، حمض الهيدروكلوريك 7.6، يحتوي على 100 بوكل ملم، 10 ملم MgCI 2، وطرد في ز X 100000 في الدوار-110 TLA (بيكمان كولتر، المؤتمر الوطني العراقي، بريا، كاليفورنيا) لمدة 1 ساعة على درجة مئوية 4
- وكذلك طاف إزالة بعناية.
- وبيليه معلق polysomal البروتينية التي تحتوي على الوليدة في حجم صغير (10-15 ميكرولتر) من 1 ملم درجة الحموضة عازلة تريس، حمض الهيدروكلوريك 7،6، التي تحتوي على 0.5 ملغ / مل ريبونوكلياز، (إينفيتروجن / الحياة تكنولوجيز، وغراند ايلاند، نيويورك)، والمحتضنة لل 30 دقيقة عند 37 درجة مئوية. في النظاملتعزيز التحلل من الرابطة استر ببتيديل-الحمض الريبي النووي النقال، يضاف هيدروكسيد الصوديوم إلى تركيز النهائي من 10 مم، واصلت الحضانة ل30 دقيقة إضافية.
سيكون رد فعل في المختبر ترجمة تجميعها دون مرنا، وأجرى في ظل نفس الظروف (تليها العزلة من الببتيدات الوليدة كما وصفت) بمثابة رقابية كبرى. قد تكون المعالجة من رد فعل الترجمة (s) مع بوروميسين قبل إخضاع استخراج إلى الطرد المركزي المتدرج الكثافة بمثابة رقابة إضافية.
4. حل ببتيد الوليدة على صفحة SDS تريس-tricine
- يتم حل البروتينية معزولة الوليدة وتحليلها في تريس، tricine SDS-PAGE. يرجى ملاحظة أن كمية المواد المحملة على هلام سوف يعتمد على كفاءة من وضع العلامات من البروتين، والكفاءة في ترجمة البروتين والعديد من المعالم الأخرى. وينبغي تعديل كمية المواد المحملة تجريبيا للسماح للبيزتي التصور وفصل السلاسل الفردية ببتيد الوليدة.
- بعد يتم إصلاح المواد الهلامية الكهربائي، تجفف باستخدام هلام فراغ صباغ ويتعرضون للتصوير الإشعاع الذاتي. ويلاحظ توزيع البروتينية الوليدة باستخدام phosphoimaging.
5. ممثل النتائج
وقد ترجم البقري غاما-B غلوبولين العدسة في المحللة بالشبكيات الأرنب، وكذلك في E. يتبع القولونية S30 استخراج نظم (Promega، ماديسون، ويسكونسن) من العزلة من سلاسل ببتيد الوليدة. الشكل 1 يصور الخطوات المتبعة في عزلة من السلاسل الريبوسوم الوليدة منضم. في هذه الدراسة كان الهدف هو اختبار، إذا تغيير البيئة من أي مرجع ترجمة tRNAs (المعروف في أن تكون مختلفة إلى حد كبير في الثدييات (RRL) وبروكاريوتيك الأنظمة (كولاي) وذلك بسبب الاختلافات في انحياز كودون بين الكائنات الحية) يمكن تغير حركة الريبوسوم على طول مرنا وتؤثر على توزيع المواقع وقفة ترجمة.يجب أن تتغير حركة الريبوسوم تؤدي إلى تغييرات في توزيع أحجام البروتينية وليدة تراكم خلال الترجمة، فضلا عن كثافة النسبية. الشدة النسبية للفرق تعكس فترة توقف. تم عزل والبروتينية الوليدة وحلها على 16.5٪ T، و 6٪ C-تريس tricine SDS PAGE (الشكل 2). غاما-B غلوبولين العدسة هو بروتين 20 كيلو دالتون. مراقبة البروتينية الناشئة من عدم مطابقة الأطوال وشدة في RRL وهاء. نظم القولونية يشير إلى أن حركة ريبوسوم على طول مرنا في هذين النظامين يلي ترجمة حركية مختلفة. على سبيل المثال، لاحظنا الفرقة بارز من 17.7 كيلو دالتون في E. كولاي المحللة وليس في نظام RRL، مما يوحي بأن هناك وقفة إضافية موقع متعدية في المنطقة 3'نهاية من مرنا (ترميز C-محطة منطقة غاما غلوبولين العدسة B)، عندما يتم ترجمته في E. كولاي نظام. نلاحظ أن غاما-B غلوبولين العدسة المرافئ جنبا إلى جنب الارجنتين كودونات (AGG 153 و 154 AGA) التي هي متكررة في نظم الثدييات، ولكن من المعروف أن نادر للغاية، وترجم ببطء في E. القولونية. الببتيد رواية الوليدة تتراكم في E. فغالبا ما يكون السبب نظام القولونية (~ الشكل 17.7 كيلو دالتون 2.2) بواسطة الريبوسوم التوقف عند هذه الكودونات جنبا إلى جنب نادر. يرجى ملاحظة أنه يمكن ملاحظة وجود فرق في ظل غياب مرنا (الشكل 2.3)، وأنه علاج بوروميسين يزيل معظم السلاسل الوليدة من polysomes (الشكل 2.3). علاج لفترات طويلة مع بوروميسين (> 15 دقيقة) يزيل كل السلاسل الوليدة (لا تظهر البيانات). هذا يؤكد أن المنتجات المرصودة ببتيد هي الريبوسوم السلاسل الناشئة المرتبطة بها، بدلا من mRNPs cosedimenting مع polysomes.
كما ذكر أعلاه، كودون التحيز هو كائن حي، وكذلك الأنسجة محددة. على سبيل المثال ممثل وصفها هنا، يشير بوضوح إلى أن تغيير البيئة من أي مرجع ترجمة tRNAs / كودونويمكن أن تؤدي إلى انحياز الحركة غيرت من الريبوسوم على طول مرنا. من الواضح، أن هذه التقنية بسيطة لا تسمح سوى تحديد المواقع وقفة متعدية على طول مرنا، ولكن تسمح أيضا مقارنة السريع للمواقع وقفة الترجمة بين النظم المختلفة.
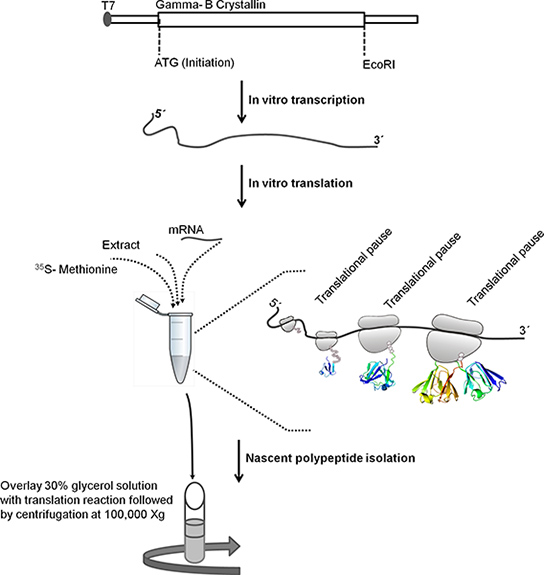
الشكل 1. التخطيطي لشرح الخطوات المتبعة في عزل الريبوسوم البروتينية متجهة الوليدة. البقري غاما-B غلوبولين العدسة ORF تسلسل (أزواج قاعدة 528) تم استنساخ المصب من T7 المروج في pBSKS +. لنسخ في المختبر والخطي قالب الحمض النووي عن طريق التعامل مع EcoRI. وقد استخدم قالب خطي لفي النسخ المختبر. ومن المسلم به T7 المروج في قالب الحمض النووي بواسطة بوليميريز الحمض النووي الريبي T7 أن المحاضر المصب الجينات غلوبولين العدسة غاما-B. يتم تنقيته مرنا باستخدام طريقة ترسيب كلوريد الليثيوم. يتم استخدام تنقية مرنا للترجمة في المختبر. بعدحضانة، والطبقات رد فعل الترجمة على رأس حل الجلسرين 30٪ وطرد لمدة 1 ساعة على 4 درجات مئوية في ز X 100،000 إلى عزل الريبوسوم البروتينية متجهة الوليدة.
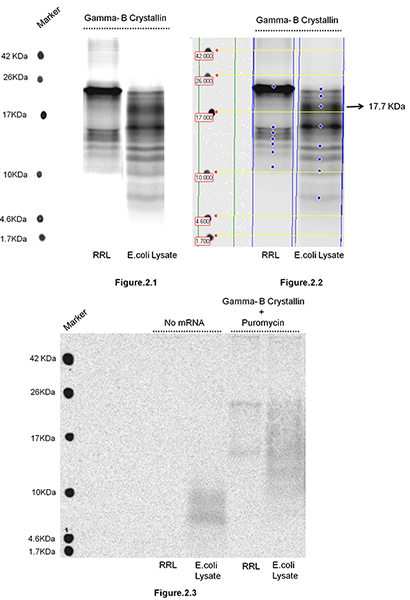
الشكل 2. العزلة من الأبقار البروتينية غلوبولين العدسة غاما-B الوليدة في ترجمتها الأرنب بالشبكيات المحللة (RRL) وهاء. كولاي المحللة. كانت مختلطة 2 مرنا ميكروغرام في 100 ميكروليتر التي تحتوي على رد فعل RRL أو E. كولاي S30 استخراج نظام (Promega، ماديسون، ويسكونسن) وفقا لتعليمات الشركة الصانعة مع 20 μCi [S 35]، الميثيونين وحضنت في درجة حرارة 30 مئوية لمدة 5 دقائق. حضانة التالي تم الطبقات رد فعل الترجمة على أعلى من 4.5 مل من الجلسرين 30٪ في 10 ملي درجة الحموضة عازلة تريس، حمض الهيدروكلوريك 7.6، يحتوي على 100 بوكل ملم، 10 ملم MgCI 2، وطرد لمدة 1 ساعة على درجة مئوية 4 و 100000 ز X في 1-110 TLA الدوار (بيكمان كولتر، المؤتمر الوطني العراقي، بريا، كاليفورنيا). كانت معزولة polyribosome بيليه دورة الفتشوبspended في 20 ميكرولتر من 1 درجة الحموضة تريس، حمض الهيدروكلوريك 7،6 ملم، تحتوي على 0.5 ملغ / مل ريبونوكلياز (إينفيتروجن / الحياة تكنولوجيز، وغراند ايلاند، نيويورك)، يليه العلاج مع هيدروكسيد الصوديوم (كما هو موضح في قسم البروتوكول). تم حل البروتينية الوليدة على 16.5٪ T، و 6٪ C-تريس Tricine هلام SDS PAGE. تم تجفيفها الجل ومعرضة للتصوير الإشعاع الذاتي. بعد التعرض تم مسحها ضوئيا باستخدام الماسح الضوئي الجل شركة جنرال الكتريك للرعاية الصحية في التصوير الاعصار. الشكل 2.1 يبين هلام مع البروتينية الوليدة عزل وحلها بعد ردود الفعل ترجمة ذلك في نظامين مختلفين (RRL وكولاي). الشكل 2.2 تم تحليل صورة هلام بواسطة كوانت TL .، v2005 البرمجيات وتستخدم هنا كمثال لاظهار أنه لا يمكن الوزن الجزيئي وشدة الوليدة البروتينية تتراكم في واحدة ونظامان تحليلها بسهولة ومقارنة الشكل 2.3 يبين مجموعتين من الضوابط: البروتينية الوليدة عزل وحلها على صفحة SDS بعد الترجمة تم تجميع ردود الفعلبدون / ومرنا أو بعد أن تم التعامل مع ردود الفعل مع ترجمة بوروميسين (5 دقائق، اضرب نهائي. 1 ملم) قبل أن تعرض له رد فعل على الطرد المركزي.
Discussion
من أجل تحقيق النتائج استنساخه، ونوعية وتركيز المكونات المستخدمة في النسخ المختبر، وردود الفعل ترجمة حاسمة. في الدراسة الحالية فقد استخدمنا مجموعات المتاحة تجاريا والمقتطفات التي تقدم بيانات استنساخه للغاية، إذا ما تم تناوله بعناية. ومع ذلك، يمكن أن تكون ?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا العمل من قبل الإنسان الحدود برنامج منح العلوم RGP0024.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف / كيت | شركة | فهرس العدد | |
| MEGAscript T7 السامية كيت النسخ العائد | Ambion | AM1333 | |
| ريبونوكلياز المانع | إينفيتروجن | 15518012 | |
| عبر [35 S] التسمية | النائب Biomedicals | 0151006 | |
| ريبونوكلياز-A | إينفيتروجن | 12091 | |
| أرنب نظام المحللة الخلايا الشبكية، وتعامل Nuclease | Promega | L4960 | |
| E. القولونية نظام استخراج S30 لقوالب الخطي | Promega | L1030 | |
| الطرد المركزي | بيكمان كولتر | أوبتيما تلكس منبذة فائقة | |
| تخزين الفوسفور صورة الإشعاع الذاتيذ | جنرال إلكتريك للرعاية الصحية | اعصار 9410 تصوير الوضع المتغير | |
| برنامج لتحليل ببتيد الوليدة | جنرال إلكتريك للرعاية الصحية | صورة كوانت TL، v2005 |
References
- Komar, A. A. A pause for thought along the co-translational folding pathway. Trends Biochem. Sci. 34, 16-24 (2009).
- Sharp, P. M., Cowe, E., Higgins, D. G., Shields, D. C. Codon usage patterns in Escherichia coli, Bacillus subtilis, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Drosophila melanogaster and Homo sapiens; a review of the considerable within-species diversity. Nucleic Acids Res. 16, 8207-8210 (1988).
- Dittmar, K. A., Goodenbour, J. M., Pan, T. Tissue-specific differences in human transfer RNA expression. PLoS Genet. 2, e221 (2006).
- Ikemura, T. Codon usage and tRNA content in unicellular and multicellular organisms. Mol. Biol. Evol. 2, 13-34 (1985).
- Wolin, S. L., Walter, P. Ribosome pausing and stacking during translation of a eukaryotic mRNA. EMBO J. 7, 3559-3569 (1998).
- Krasheninnikov, I. A., Komar, A. A., Adzhubei, I. A. Nonuniform size distribution of nascent globin peptides, evidence for pause localization sites, and a cotranslational protein-folding model. J. Protein Chem. 10, 445-454 (1991).
- Komar, A. A., Lesnik, T., Reiss, C. Synonymous codon substitutions affect ribosome traffic and protein folding during in vitro translation. FEBS Lett. 462, 387-391 (1999).
- Komar, A. A., Jaenicke, R. Kinetics of translation of γ B crystallin and its circularly permutated variant in an in vitro cell-free system: possible relations to codon distribution and protein folding. FEBS Lett. 376, 195-198 (1995).
- Jha, S., Komar, A. A. Birth, life and death of nascent polypeptide chains. Biotechnol. J. 6, 623-640 (2011).
- Thanaraj, T. A., Argos, P. Ribosome-mediated translational pause and protein domain organization. Protein Sci. 5, 1594-1612 (1996).
- Kimchi-Sarfaty, C., Oh, J. M., Kim, I. W., Sauna, Z. E. A "silent" polymorphism in the MDR1 gene changes substrate specificity. Science. 315, 525-528 (2007).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal. Biochem. 166, 368-379 (1987).
- Shirole, N., Balasubramanian, S., Yanofsky, C., Cruz-Vera, L. Isolation of Translating Ribosomes Containing Peptidyl-tRNAs for Functional and Structural Analyses. J. Vis. Exp. (48), e2498 (2011).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324, 218-223 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved