需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
核糖体束缚新生多肽的分离
摘要
描述的一种技术,以确定mRNA的翻译暂停网站。本程序是基于对新生多肽在体外培养的靶mRNA的翻译,其次是使用变性凝胶电泳新生链的大小分析核糖体积累的隔离。
摘要
翻译伸长率非均匀。 mRNA的二级结构,密码子的使用和mRNA的相关蛋白可能会改变核糖体的运动上的信息进行审查,见1。然而,它现在被广泛接受的同义密码子使用的非均匀平移伸长率的主要原因。同义密码子使用相同的频率。比其他2更频繁使用一些密码子的同义密码子的使用存在的偏见。密码子偏性是有机体以及组织特异性2,3。此外,密码子的使用频率是4同源tRNA的浓度成正比。因此,经常使用的密码子,将有相应的tRNA高出许多,这进一步意味着,频繁的密码子将被翻译速度比不经常。因此,将减缓地区稀有密码子(潜在暂停网站)丰富的mRNA作为一项规则上的信息核糖体运动GE和事业积累的新生肽5-8各自的大小。这些暂停的网站可以有功能的蛋白表达的影响, 审查的 mRNA稳定性和蛋白质折叠9。事实上,它表明,扶贫等暂停网站,可以改变的mRNA上的核糖体运动和随后可能会影响效率的翻译共同体内蛋白质折叠1,7,10,11。为了了解在体内的蛋白质折叠的过程中,在细胞中,蛋白质的合成过程,它必须获得全面的见解,在翻译延伸到沿mRNA的核糖体运动的影响密码子使用/ tRNA的内容最终加上。
在这里,我们描述一个简单的方法可以用来定位主要翻译为一个给定的mRNA翻译各种无细胞系统6-8暂停网站。这个程序是基于隔离accumulati新生多肽在体外的靶mRNA的翻译过程中核糖体纳克。理由是,在低频率的密码子,增加停留时间的增加相应大小的新生肽的核糖体结果。 在体外转录的mRNA存在放射性标记的氨基酸在体外翻译反应让新生链的检测。以孤立核糖体结合的新生多肽复合物的翻译反应顶端30%的甘油溶液离心分层。 polysomal颗粒新生多肽进一步用核糖核酸酶A和SDS-PAGE解决。这种技术可能可以被用于任何蛋白质,并允许沿mRNA的核糖体运动和检测的主要暂停网站分析。此外,该协议可以适应学习的因素和条件,可以改变核糖体的运动,从而可能还可以改变日é功能/蛋白质的构象。
研究方案
1。 DNA模板制备及体外转录
- 感兴趣的基因被克隆在T7和/或如SP6的转录子。
- 在体外转录模板DNA线性适当的限制酶切割的ORF终止密码子和/或mRNA的3'端下游。一个需要验证完整的线性质粒DNA的琼脂糖凝胶电泳上运行酶切产品。
- 线性质粒用于体外转录反应。不同浓度的DNA模板可以进行测试,以确定最佳的DNA浓度在体外转录。一般来说,Ambion公司的MEGAscript高产转录试剂盒(Ambion公司/生命科技,大岛,NY),1微克的线性的DNA产生mRNA的40-60微克。 在体外转录完成后,制造商的指令(Ambion公司/生命科技,大IslanD,NY)。
- 继在体外转录的mRNA氯化锂沉淀纯化,根据制造商的指示(Ambion公司的MEGAscript高产转录试剂盒)。
- 丙烯酰胺或琼脂糖凝胶电泳进一步证实mRNA的完整性。
2, 在体外无细胞翻译
在体外翻译使用ŕabbitŕeticulocyte裂解物,RRL(Promega公司,麦迪逊,威斯康星州)按照以下步骤:
- 准备在体外翻译反应以下制造商的指示100微升。简单地说,加入2μL氨基酸混合物减蛋氨酸(1毫米),10个单位,20微居里放射性核糖核酸酶抑制剂(Invitrogen公司/生命科技,大岛,NY)[35 S的 -蛋氨酸(MP Biomedicals核酸自由水,梭伦,俄亥俄州),70μL兔网织红细胞裂解液(Promega公司,麦迪逊,威斯康星州)。
- 孵育日ê反应在30°C 5分钟预先热烈的翻译反应。新增2微克的mRNA的翻译反应,并在30°C孵育5分钟。
- 停止反应,放置在冰的翻译反应。
3。分离新生多肽在体外翻译反应
- 要隔离新生多肽势必核糖体(多聚核糖体),翻译反应分层4.5毫升30%甘油的顶部在10毫米的Tris-HCl缓冲液pH值7.6,含有氯化钾,100毫米10毫米MGCI 2,100,000 XĞ离心1 TLA-110转子为1小时(贝克曼公司,布雷亚,CA)在4°C
- 进一步仔细去除上清。
- 新生多肽polysomal颗粒悬浮在一个小体积(10-15微升)1毫米的Tris-HCl缓冲液pH值7.6,含0.5毫克/毫升核糖核酸酶A(Invitrogen公司/生命科技,大岛,NY),孵育30分钟,在37°C。为了提高的肽酰-tRNA酯键的水解,氢氧化钠加入到终浓度为10毫米,和额外的30分钟继续孵化。
体外翻译反应mRNA和组装不相同的条件下新生肽隔离已完成,将作为一个重要的控制。翻译反应嘌呤(S)前的密度梯度离心提取物治疗,可以作为一个额外的控制。
4。解决新生多肽的Tris-甘氨酸SDS-PAGE
- 解决孤立的新生多肽的Tris-甘氨酸SDS-PAGE电泳分析。请注意材料的数量,加载在凝胶上蛋白标记的效率,对蛋白质的翻译和许多其他参数的效率依赖。装材料的数量应调整的经验,以便在BES牛逼的可视化和个别新生肽链的分离。
- 干凝胶电泳后是固定的,采用真空凝胶代尔受到显影。新生多肽的分布观察使用phosphoimaging。
5。代表结果
牛γ-B晶体在兔网织红细胞裂解以及在大肠杆菌中被翻译大肠杆菌 S30的提取系统(Promega公司,麦迪逊,威斯康星州),其次是新生肽链的隔离。 图1描述了参与隔离核糖体结合的新兴链的步骤。在本研究的目的是测试,如果改变tRNA基因(称为是本质的不同,在哺乳动物(RRL)和原核系统( 大肠杆菌 )因密码子的生物体之间的偏差的差异),即翻译剧目的环境改变沿mRNA的核糖体运动和对翻译暂停站点分布。改变核糖体的运动导致的翻译,以及其相对强度过程中积累的新生多肽的大小分配的变化。乐队的相对强度反映的暂停时间。新生的多肽的分离和16.5%T的6%C处的Tris-甘氨酸SDS-PAGE(图2)解决。 γ-B晶体是一个20 kDa蛋白。 RRL和E.非相同的长度和强度的新生多肽的观察大肠杆菌系统表明,在这两个系统中沿mRNA的核糖体的运动遵循不同的翻译动力学。例如,我们观察到在大肠杆菌中的17.7 kDa的突出带大肠杆菌裂解,而不是在RRL系统,这意味着有一个额外的mRNA的3'-端区域(编码C-端区域γ-B晶体),平移暂停网站,当它在大肠杆菌中翻译大肠杆菌系统。我们注意到,γ-B晶体港口串联精氨酸密码子(AGG的153和AGA 154)频繁在哺乳动物系统,但被称为是极其罕见的,并在大肠杆菌中慢慢翻译一种新型的新生肽在大肠杆菌中积累大肠杆菌。大肠杆菌系统(〜17.7 kDa的图2.2),可能造成在这些串联的稀有密码子的核糖体暂停。请注意没有带可以观察到的mRNA( 图2.3)的情况下,和,嘌呤治疗消除大部分新生链从核糖体( 图2.3)。长期治疗与嘌呤(15分钟),删除所有新生链(数据未显示)。这证实了观测到的多肽产品,而不是与核糖体cosedimenting mRNPs核糖体相关的新兴连锁。
如上所述,密码子偏好以及组织特定的有机体。这里描述的有代表性的例子,清楚地表明,改变环境/密码子的tRNA的翻译,即剧目偏见可能导致改变的核糖体沿mRNA的运动。显然,这个简单的技术,不仅可以使沿mRNA的翻译暂停网站的识别,而且还允许快速比较不同系统之间的翻译暂停网站。
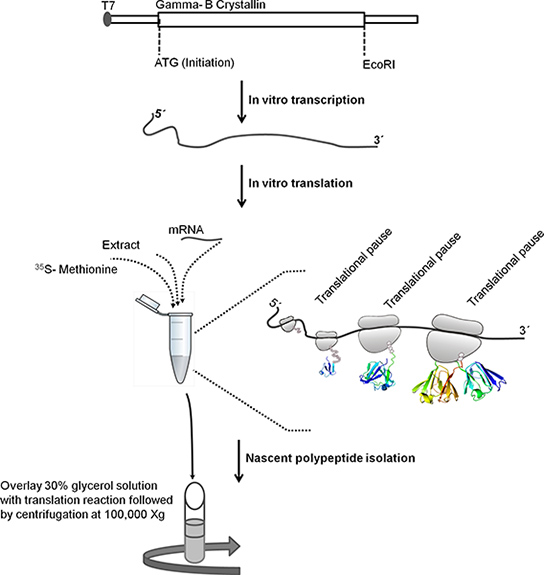
图1。原理解释隔离核糖体结合新生多肽所涉及的步骤。牛伽玛-B的晶状体(528个碱基对)的ORF序列克隆在pBSKS T7启动子下游+。 在体外转录线性模板DNA,用EcoRI治疗。线性模板,用于在体外转录。 T7 RNA聚合酶的转录下游的伽马 - B晶体蛋白基因的T7启动子在DNA模板是公认的。使用氯化锂沉淀法纯化表达。用于纯化的mRNA 在体外翻译。以下孵化,翻译反应1小时30%的甘油溶液的顶部和分层离心4°100,000 XĞC至隔离核糖体结合新生多肽。
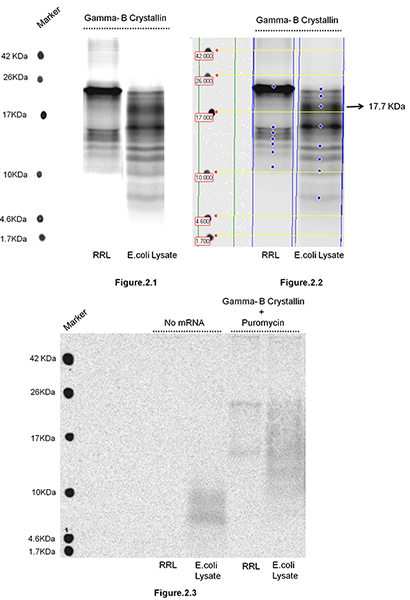
图2。牛伽马在兔网织红细胞裂解液(RRL) 和 E-B的翻译晶状体新生多肽的分离大肠杆菌裂解液 100μL反应RRL 或 E。2微克的mRNA混合大肠杆菌 S30的提取系统(Promega公司,麦迪逊,威斯康星州)根据制造商的指令为5分钟与20微居里[35]-蛋氨酸和培养在30°C间。 4.5毫升30%甘油的顶部在10毫米的Tris-HCl缓冲液pH值7.6以下孵化翻译反应呈层状,含100毫米氯化钾,10毫米MGCI 2,在4℃和100,000 XĞ离心1小时1 TLA-110转子(Beckman Coulter公司,股份有限公司,布雷亚,CA)的。孤立polyribosome颗粒是resuspended在20μL1毫米的Tris-HCl pH值7.6,含0.5毫克/毫升核糖核酸(Invitrogen公司/生命科技,大岛,NY)的治疗与NaOH(如在协议部分所述)。新生多肽ţ16.5%,6%C处的Tris-甘氨酸SDS-PAGE凝胶上解决。凝胶干燥和为显影暴露。暴露后凝胶使用GE Healthcare的台风成像扫描仪扫描。 图2.1显示了隔离和解决翻译后的反应做了两个不同的系统(RRL和大肠杆菌 )的新生多肽的凝胶。 图2.2凝胶图像定量TL分析V2005软件,这里作为一个例子,说明在两个系统中积累的新生多肽的分子量和强度,可以很容易地分析和比较图2.3显示了两套控制:SDS-PAGE分离和解决翻译后的新生多肽反应组装没有mRNA和/或之后的翻译反应治疗嘌呤(5分钟,终浓度。1毫米),反应前离心。
讨论
对于重复性的结果, 体外转录和翻译反应中使用的组件的质量和浓度是关键。在目前的研究中,我们已经使用市售的包和提取物,提供高度可重复性的数据,如果小心处理。然而,翻译能力的提取物可准备从细胞的选择,如果需要的话。质量可以影响mRNA的翻译,所以它是最重要的测试之前使用它在体外翻译的mRNA的完整性。
此外, 在体外翻译反应的时间?...
披露声明
没有利益冲突的声明。
致谢
这项工作是由人类前沿科学计划授予RGP0024。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称/盒 | 公司 | 目录编号 | |
| MEGAscript T7高产转录试剂盒 | Ambion公司 | AM1333 | |
| 核糖核酸酶抑制剂 | Invitrogen公司 | 15518012 | |
| 反式[35]标签 | MP的Biomedicals | 0151006 | |
| 核糖核酸酶- | Invitrogen公司 | 12091 | |
| 兔网织红细胞裂解系统,核酸治疗 | Promega公司 | L4960 | |
| 大肠杆菌 S30提取物系统的线性模板 | Promega公司 | L1030 | |
| 离心 | 贝克曼 | 舰TLX超速离心机 | |
| 存储磷放射自显影Ÿ | GE医疗集团 | 台风9410可变模式成像 | |
| 新生多肽分析软件 | GE医疗集团 | 图像定量TL,V2005 |
参考文献
- Komar, A. A. A pause for thought along the co-translational folding pathway. Trends Biochem. Sci. 34, 16-24 (2009).
- Sharp, P. M., Cowe, E., Higgins, D. G., Shields, D. C. Codon usage patterns in Escherichia coli, Bacillus subtilis, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Drosophila melanogaster and Homo sapiens; a review of the considerable within-species diversity. Nucleic Acids Res. 16, 8207-8210 (1988).
- Dittmar, K. A., Goodenbour, J. M., Pan, T. Tissue-specific differences in human transfer RNA expression. PLoS Genet. 2, e221 (2006).
- Ikemura, T. Codon usage and tRNA content in unicellular and multicellular organisms. Mol. Biol. Evol. 2, 13-34 (1985).
- Wolin, S. L., Walter, P. Ribosome pausing and stacking during translation of a eukaryotic mRNA. EMBO J. 7, 3559-3569 (1998).
- Krasheninnikov, I. A., Komar, A. A., Adzhubei, I. A. Nonuniform size distribution of nascent globin peptides, evidence for pause localization sites, and a cotranslational protein-folding model. J. Protein Chem. 10, 445-454 (1991).
- Komar, A. A., Lesnik, T., Reiss, C. Synonymous codon substitutions affect ribosome traffic and protein folding during in vitro translation. FEBS Lett. 462, 387-391 (1999).
- Komar, A. A., Jaenicke, R. Kinetics of translation of γ B crystallin and its circularly permutated variant in an in vitro cell-free system: possible relations to codon distribution and protein folding. FEBS Lett. 376, 195-198 (1995).
- Jha, S., Komar, A. A. Birth, life and death of nascent polypeptide chains. Biotechnol. J. 6, 623-640 (2011).
- Thanaraj, T. A., Argos, P. Ribosome-mediated translational pause and protein domain organization. Protein Sci. 5, 1594-1612 (1996).
- Kimchi-Sarfaty, C., Oh, J. M., Kim, I. W., Sauna, Z. E. A "silent" polymorphism in the MDR1 gene changes substrate specificity. Science. 315, 525-528 (2007).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Anal. Biochem. 166, 368-379 (1987).
- Shirole, N., Balasubramanian, S., Yanofsky, C., Cruz-Vera, L. Isolation of Translating Ribosomes Containing Peptidyl-tRNAs for Functional and Structural Analyses. J. Vis. Exp. (48), e2498 (2011).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324, 218-223 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。