A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وهو الإجراء الأمثل لالإسفار تنشيط عزل الخلية (نظام مراقبة الأصول الميدانية) فرز الأسلاف العصبية الاستقلال الذاتي من الجهاز التنفسي والهضمي من الفئران الجنينية
In This Article
Erratum Notice
Summary
يوصف إجراء الأمثل لتنقية العرف العصبي المستمدة من الأسلاف من الأنسجة العصبية الماوس الجنين. هذا الأسلوب يستفيد من التعبير من الأليلات مراسل فلوري لعزل السكان منفصلة عن طريق الفرز الخلية مضان تنشيط (FACS). ويمكن تطبيق هذه التقنية لعزل القطعان الخلايا العصبية في جميع أنحاء تطوير أو من أنسجة البالغين.
Abstract
خلال تطوير العرف العصبي (NC) المستمدة من الأسلاف العصبية تهاجر بعيدا عن الأنبوب العصبي اللاإرادي لتشكيل العقد في الجهاز التنفسي والهضمي مثل الأمعاء والمسالك البولية السفلية. على حد سواء خلال تطوير والأنسجة الناضجة غالبا ما تكون هذه الخلايا على نطاق واسع في جميع أنحاء متفرقة الأنسجة بحيث عزلة السكان منفصلة باستخدام أساليب مثل القبض على الليزر الدقيقة تشريح أمر صعب. يمكن أن تكون إلا تصور مباشرة من قبل التعبير عن صحفيين فلوري طردوا من المناطق التنظيمية من الخلايا العصبية جينات محددة مثل هيدروكسيلاز التيروسين (TH). نحن وصفا لطريقة الأمثل لعوائد عالية من TH قابلة للحياة + الأسلاف من الأنسجة العصبية الماوس الجنين الحشوية، بما في ذلك الأمعاء والجهاز البولي التناسلي السفلي (LUT)، استنادا إلى التفكك ومضان تنشيط الفرز الخلية (نظام مراقبة الأصول الميدانية).
الجين بترميز ث الحد من معدل انزيم لإنتاج الكاتيكولامينات. الأسلاف العصبية المعوية يبدأ في التعبير عن TH الدرجى هجرتهم في الأمعاء الجنين 1 و TH موجود أيضا في مجموعة فرعية من الخلايا العصبية للبالغين العقد الحوض 2-4. لم يكن أول ظهور لهذه السلالة، وتوزيع هذه الخلايا العصبية في الجوانب الأخرى من الطرفيات، وعزلتهم وصفها. ويمكن التعبير عن الأسلاف العصبية TH يمكن تصور بسهولة من قبل التعبير عن EGFP في الفئران التي تحمل التصور التحوير تيراغرام (TH-EGFP) DJ76Gsat/Mmnc 1. التقط لنا التعبير عن هذا التحوير في الفئران الجنينية لتوثيق توزيع TH + الخلايا في LUT النامية على 15،5 الجماع آخر أيام (DPC)، تعيين صباح الكشف عن المكونات إلى 0.5 DPC، وأشار إلى أن مجموعة فرعية من أسلاف الخلايا العصبية في ائتلافه العقد الحوضية صريحة EGFP.
لعزل TH LUT + أسلاف الخلايا العصبية، إلى أقصى حد نحن الأساليب التي استخدمت في البداية لتنقية الخلايا الجذعية العصبية قمة من الأمعاء الماوس الجنين 2-6. قبل جهودا لعزل NC المستمدة من السكان يعتمد عليهاالهضم مع مزيج من كولاجيناز والتربسين للحصول على تعليق خلية لالتدفق الخلوي. في أيدينا تنتج هذه الأساليب تعليق خلية من LUT مع بقاء منخفض نسبيا. نظرا للمعدلات المتدنية أصلا من أسلاف الخلايا العصبية في أنسجة الجنين LUT، شرعنا في تحسين أساليب تفارق تلك التي من شأنها أن تكون زيادة بقاء الخلايا في تنأى النهائي. نحن مصممون على أن تفكك لطيف في Accumax (تقنيات خلية المبتكرة، المؤتمر الوطني العراقي)، والترشيح اليدوي، وتدفق الفرز في ضغط منخفض سمحت لنا لتحقيق قدر أكبر من البقاء على قيد الحياة على الدوام (> 70٪ من مجموع الخلايا) مع الغلة لاحق من الأسلاف العصبية كافية لتحليل اتجاه مجرى النهر. ويمكن لأسلوب وصفنا تطبيقها على نطاق واسع لعزل مجموعة متنوعة من السكان من الأنسجة العصبية إما الفئران الجنينية أو الكبار.
Protocol
1. إعداد وسائل الاعلام (جميع الخطوات أجريت في غطاء محرك السيارة زراعة الأنسجة)
- الجمع بين ما يلي: 44 مل L-15 متوسطة، و 0.5 مل 100X البنسلين / الستربتومايسين عقار (P / S)، و 0.5 مل 100 ملغ / مل الأبقار مصل (BSA)، و 0.5 مل HEPES 1M، 5 زراعة الأنسجة مل ماء الصف. تأكد من خلط جيش صرب البوسنة وP / S بدقة قبل ان يضيف. وهذا ينبغي أن تكون كافية لحجم التفكك لمدة تصل إلى خمسة أنواع الأنسجة المختلفة. وسوف تستخدم وسائل الاعلام في هذه الخطوة 3.4 لإعداد حلول تسقيه للاستخدام بعد تفكك الأنزيمية من الأنسجة.
- فلتر وسائل الإعلام على الرغم من 0.22 ميكرون Polyethersulfone (PES) مرشح.
- التخزين المؤقت يعد الحل 1X هانك في سولت المتوازن (HBSS)، والفوسفات 1X المالحة (PBS) من أسهم 10X استخدام المياه الأنسجة درجة الثقافة. من خلال تصفية 0.22 ميكرون مرشح الدائرة العامة. يمكن تحضير كميات كبيرة من هذه المواد الكاشفة في وقت سابق وتخزينها في درجة مئوية 4، aliquoting أصغر وحدات التخزين في نسيج الثقافة غطاء محرك السيارة حسب الحاجة.
- ملء 15 مل متعددة أنابيب مخروطية الشكل مع 1X HBSS، (عدد من الأنابيب لتساوي عدد من الأنسجة كنت تخطط لتشريح الفرعية) حفظ الأنابيب على الجليد.
2. تشريح
- الموت ببطء توقيت فأر حامل وفقا لرعاية الحيوان والمؤسسية وبروتوكولات لجنة استخدام المعتمدة ونقل إلى الرحم لمدة 60 أو 100 ملم تحتوي على طبق بيتري PBS الجليد 1X الباردة.
- إزالة الأجنة من الرحم والموت ببطء بواسطة قطع الرأس في برنامج تلفزيوني 1X المثلج. الشاشة بشكل فردي تحت الإضاءة الفلورية، وتقسيمها الى ايجابية حمامات (WT) المعدلة وراثيا والبرية من نوع nontransgenic. الحفاظ على الأجنة في برنامج تلفزيوني 1X الجليد الباردة طوال تشريح.
- تحت المجهر تشريح ودون تشريح الجهاز البولي التناسلي. عقد في جنين في مكان على مستوى forelimb بالملقط غرامة. إزالة الأحشاء من الكبد وصولا الى الحديبة التناسلية عن طريق إدراج ملقط على مستوى الحجاب الحاجز ثم سحب بخفة الأعضاء الداخلية لأسفل وبعيدا عن جدار الجسم الظهرية.
- مزيد من دون تشريح الأنسجةالاهتمام بعيدا عن الأنسجة المحيطة بها (الشكل 1). وضع كل على حدة دون تشريح نوع النسيج في أنبوب مخروطي 15 مل تحتوي على الجليد HBSS 1X الباردة. تجمع كل نوع من أنواع الأنسجة معا وفق النمط الظاهري جنين (أي جميع GFP + يتم تجميع عينات من الأمعاء الجنين في أنبوب واحد 15 مل مخروطي).
- في موازاة ذلك، تشريح أنسجة قابلة للمقارنة من البرية من نوع الأجنة لاستخدامها لضوابط التعويض في التدفق الخلوي.
3. تفكك الأنسجة Subdissected
- بيليه شبه تشريح الأنسجة عن طريق الطرد المركزي في 210 قوة الطرد النسبية (RCF)، و 4 درجات مئوية لمدة 5 دقائق. بعد الطرد المركزي، ونضح قبالة كما HBSS أكبر قدر ممكن.
- Resuspend لبيليه في الأنسجة Accumax (تقنيات خلية المبتكرة، المؤتمر الوطني العراقي)، وتأكد من تغيير نصائح ماصة بين كل عينة لتجنب انتقال الملوثات من أنواع الأنسجة. يمكن زيادتها كمية المضافة Accumax لكميات أكبر أو أصغر من الأنسجة. عادة لمدة 1وسوف تستخدم -5 عينات الأمعاء الجنين، 1 مل من Accumax لكن حمامات أكبر الأنسجة سيتطلب أكبر حجم لتحقيق الانفصال.
- أنابيب مكان إلى 37 درجة مئوية حمام الماء ل20-45 دقيقة اعتمادا على مرحلة من النسيج الانعزال (مثل الأمعاء DPC 13.5 20 دقيقة، 15.5 DPC الأمعاء 35 دقيقة). في منتصف الطريق على الرغم من أن الوقت التفكك، كسر يدويا النسيج بواسطة طرق الأنبوب ضد الجانب من حمام الماء (أو أي سطح صلب)، وبواسطة "التحريك" الأنبوب (كما يمكن لأحد أن يهز أسفل مقياس حرارة الزئبق من الطراز القديم). في نهاية الوقت تفارق تكرار هزة أسفل مرات عدة إجراءات لفصل مزيد من العينة. لعينات أكثر هشاشة، والحد من vigorousness للاهتزاز لأسفل واستخدم بدلا من ذلك سحن ماصة خلال الخطوة 3.5 إلى تحقيق مستوى مناسب من التفكك. نموذجي مرات تفكك مقابل 14.5 و 15.5 DPC LUT DPC هي 35 و 45 دقيقة، على التوالي.
- بينما الأنسجة وتفرخ في Accumax، بحيث يشكلون تسقيهlutions، ووصف تطفئوا وتطفئوا 01:05. يتم تبريد وذلك بإضافة 45 ميكرولتر 5 ملغ / مل أنا الدناز إلى 6 وسائل الإعلام L-15 مل. يتم إرواء 01:05 بإضافة 45 ميكرولتر 5 ملغ / مل أنا الدناز وسائل الإعلام إلى 30 L-15 مل.
- في نهاية التفكك، نقل 15 مل أنابيب على الجليد وعلى الفور إضافة 1 مل إلى إخماد كل أنبوب. يسحن كل عينة صعودا وهبوطا حتى تكاد تنفصل الأنسجة تماما (الشكل 2). لن يكون هناك لا يزال بعض قطع صغيرة من الأنسجة موجودة في الحل. تحقيق عينة متجانسة تماما ليست قابلة للتحقيق بسهولة ولا مرغوب فيه لأنه يمكن أن يؤدي إلى بقاء الخلية الفقراء.
- الحفاظ على عينة على الجليد قدر الإمكان للفترة المتبقية من هذا البروتوكول. تأكد من استخدام معلومات سرية ماصة جديدة عندما يصل pipetting تطفئوا أو تطفئوا 01:05 لتجنب انتقال التلوث من العينات.
4. تعليق تصفية خلية
- باستخدام الملقط التي كانت غارقة في الايثانول 70٪، ضع 3 سم مربع من 38 ميكرومتر النايلون غشاء شبكة (Sefar أمريكا) على مدىالفم من أنبوب جديد 15 مل مخروطي. تصفية الخلايا من خلال شبكة من pipetting في وسط غشاء باستخدام نصائح تتحمل الضيقة. إذا كان غشاء تصبح مشبعة بينما الترشيح، وإزالته، يجف الفم من أنبوب مع kimwipe، واستخدام قطعة جديدة من شبكة من النايلون لتصفية ما تبقى من التعليق الخلية. مرة واحدة وقد تم ترشيح كل الخلايا، واستخدام 1 مل 01:05 تطفئوا لشطف خارج الأنبوب وتصفية أي الخلايا المتبقية.
- عند تصفية كاملة، أو عند استبدال غشاء المسدودة، واستخدام الملقط لنشمر عن الجانبين من شبكة والقضاء على غشاء عبر العلوي من أنبوب لإزالة أي قطرات معلق من الخلايا.
- بيليه التعليق الخلية عن طريق الطرد المركزي في 210rcf، 4 درجات مئوية لمدة 5 دقائق. نضح من طاف وبيليه resuspend في 1 مل 01:05 تبريد.
- مرشح تعليق الخلية من خلال شبكة من النايلون في 5 مل أنابيب البولي ستايرين. تغسل 15 مل مع أنبوب 1 مل 01:05 تطفئوا ومرشح لالتقاط أي الخلايا المتبقية.
5. إعداد عينات لنظام مراقبة الأصول الميدانية
- إذا باستخدام النسيج نفسه للفرز وضوابط التعويض، ونقل 1/10 عشر الى 1 / ال 20 من حجم العينة إلى 5 مل أنبوب جديد لاستخدام البوليسترين لعناصر التعويض. تقسيم عينة النسيج من النوع البري إلى جزئين. وسيتم غير ملوثين جزء واحد من النوع البري (WT فقط) في حين أن النصف الثاني سيكون لها 7-D Aminoactinomycin (7-AAD، وهو intercalator فلوري استبعادها من الخلايا الحية المستخدمة بأنها "وصمة عار جدوى") وأضاف إليها (7-AAD فقط ). وهناك حاجة إلى هذه الضوابط الفردية للسماح للحصول على تعويض من أي تداخل بين الأطياف انبعاث fluorophores منفصلة في فارز تدفق. على سبيل المثال، عن المراسل فلوري واحد مثل EGFP، والضوابط اللازمة ما يلي: EGFP فقط، خلايا وزن غير ملوثين، وأنبوب ملطخة AAD-7 فقط (الشكل 3).
- ملء جميع الأنابيب التي تحتوي على 5 مل تعليق خلية مع 1:05 إخماد والطرد المركزي في 210rcf، 4 درجات مئوية لمدة 5 دقائق. نضح طاف، وترك ما يقرب من 200 ميكرولتر من السائلفي أنبوب.
- تمييع 7-AAD 1:1000 في إخماد 01:05. إضافة 7-AAD تخفيف تلطيخ إلى 7-AAD سيطرة التعويض فقط وعينات ليتم فرزها. لا تضيف 7-عاد إلى EGFP فقط أو WT ضوابط التعويض فقط. حجم 7-عاد لتضاف سوف تختلف في كمية المواد بدءا من بيليه وحجم الخلية التي تم الحصول عليها. مرة واحدة تم إضافة 7-AAD إلى أنابيب المناسب، وعينات على استعداد ليتم فرزها.
الأنسجة عينة بركة الحجم حجم 7-عاد لتضاف إلى * أنبوب 15.5 DPC الأمعاء 1-5 200 ميكرولتر 15.5 DPC LUT 1-5 150 ميكرولتر
الجدول رقم 1. ستصل من AAD-7 تضاف إلى تنأى الأنسجة المختلفة * ومجموع المبلغ النهائي في كل أنبوب تختلف من مبلغ يتراوح 50-100 ميكرولتر منذ تطلع وسائل الإعلام هين عملية تقريبية، وأجرى لتجنب بيليه. لا تقاس الكميات النهائية وذلك للحد من التعامل مع الخلايا في حل. - إعداد أنابيب جمع لالتقاط الخلايا لعزل الحمض النووي الريبي من خلال إضافة 0.75 مل TRIzol ليرة سورية إلى 1.5 أنابيب microcentrifuge مل.
- إذا جمع الخلايا في المختبر، والثقافة، وبدلا من عزل الحمض النووي الريبي، وخلايا الفرز مباشرة في تجديد الذات وسائل الإعلام في 6 جيدا لوحات زراعة الأنسجة، والمغلفة مع فبرونيكتين وامتلأت وسائل الاعلام كما هو موضح سابقا. 2،6،7
6. تدفق الخلوي
- في عداد الكريات تدفق، وتقييم التعويض الضوابط الأولى، ويجري التأكد من استواء الظهر بين كل عينة لتجنب التلوث. استخدام لمحات من العينات لتحديد التعويض الفولتية / بوابات للفرز. لاحظ أنه إذا خلايا إيجابي في الأنسجة المطلوبة موجودة في الحد من أعداد، ويمكن استخدام منديل ورقي متميز لإنشاء إعدادات تعويض طالما كثافة مضان وحجم الخليةبين عينات قابلة للمقارنة.
- تعيين المعلمات التعويض والبوابات لتجنب الخلايا الميتة التي تستغرق 7-AAD صبغ وجمع الخلايا العارضة كثافة عالية من النسبية مضان GFP لضوابط غير ملوثين (الشكل 4).
- فرز الحد الأقصى 25000 الخلايا في كل أنبوب microcentrifuge. ينبغي أن يقوم الفرز في الضغط ادنى حد ممكن مع فوهة تتحمل واسعة، وانخفاض معدل تدفق (على سبيل المثال، 17psi، 100 فوهة ميكرون، 3000 أحداث / ثانية) للحفاظ على بقاء الخلايا العصبية سلف. لأنواع من عزل خلايا EGFP + نحن لدينا أداء العزلة على FACSAriaII العلوم البيولوجية دينار بحريني باستخدام الليزر 488nm 20mW لإثارة مراسل EGFP.
- إذا العينات تحتوي على تركيزات عالية الخلية، فإنه من المستحسن أن يخفف من التعليق الخلية باستخدام مزيد من 1:1000 7 AAD صمة عار لتحقيق مستويات أعلى من الكفاءة التقاط عند الفرز.
- دوامة كل أنبوب من الخلايا التي احتلتها في TRIzol ليرة سورية مباشرة بعد الفرز.
7. ممثل النتائج
تفكك النسيج لانتاج معلقات خلية للفرز تدفق هو التوازن الدقيق بين الهضم الأنزيمي الكافية، وتجنب الإفراط في الهضم التي يمكن أن تؤدي في viabilities الخلية منخفض. ويرد مثال على المستوى المطلوب من تفكك النسيج في الشكل 2. في الأنسجة هضمها بشكل مناسب قبل قطع سحن دليل الهيئات الفرعية تشريح لا تزال اضح (الشكل 2B، 2F). في الأنسجة التي يتم التعامل إنزيمي لفترة طويلة جدا من الزمن أو في تركيز 1 عالية جدا من انزيم، مما أدى إلى تعليق يفتقر إلى أي قطعة كبيرة من الأنسجة المتبقية (الشكل 2D، 2H).
تفكك المناسبة ودليل تصفية إنتاج ملامح الفرز في التدفق الخلوي التي تظهر عادة أكبر من 90٪ خلايا قابلة للحياة، وتبين وجود مستويات عالية من التعبير EGFP (الشكل 4). السكان الخلية التي تم الحصول عليها بواسطة هذه الطريقة جيدة لتوضيحيمكن التقاط جدوى وللثقافة لاحقة أو تحليل التعبير الجيني من قبل النابضة للقبض على EGFP + أسلاف الخلايا العصبية.
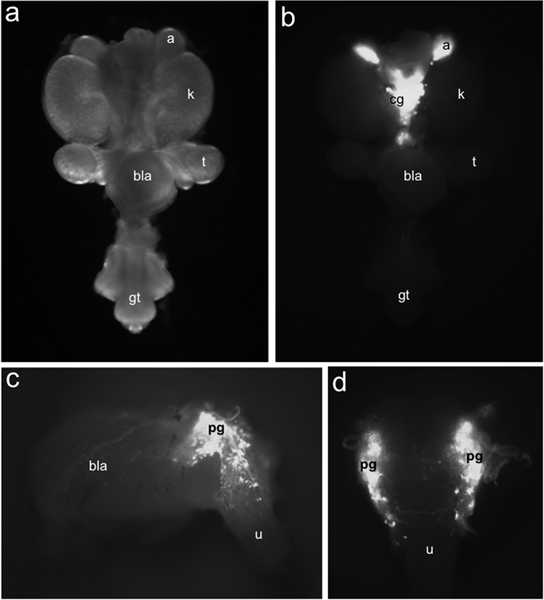
الشكل 1. توزيع TH-EGFP + العصبية الأسلاف في LUT الفأر الجنينية. كل جبل المسالك البولية التناسلية عند 15.5 DPC ينظر البطني تحت إضاءة ساطعة حقل (أ) مقارنة مع توزيع الخلايا + EGFP وصفت من قبل TH-EGFP التعبير التحوير التي تم تحديدها تحت إضاءة مضان (ب). TH-EGFP التعبير موجود في الغدة الكظرية (أ) وتقع بشكل إعلامي العقد الزلاقي (م). الجانبي (ج) نظرا ل15.5 DPC TH-EGFP الفرعية تشريح المعارض المثانة مضان من التحوير التعبير في العقد الحوض (ص)، وجدار المثانة (جيش تحرير بلوشستان) والإحليل (ش). في رأي ظهري (د) EGFP + الخلايا واضحة في مجرى البول الأمامي الظهري. تسميات أخرى: الكلى (ك)، الخصية (ر)، المثانة (جيش تحرير بلوشستان) والحديبة التناسلية (جي تي).

الشكل 2. الصور Brightfield لوط DPC 15 الجنين (أ) والأمعاء (ه)، على التوالي، تصوير في منتصف الطريق من خلال فترة الحضانة التفكك، في نهاية حضانة التفكك قبل انقطاع (ب، و)، بعد انقطاع الخط (ج، ز)، و في عينة كان أن تنفصل بشكل مفرط (د، ح).
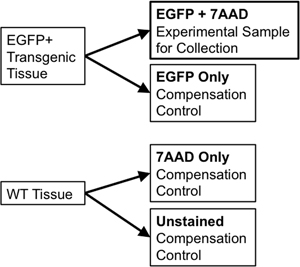
3 الشكل. الرسم التخطيطي يوضح تعويض الضوابط اللازمة لإنشاء صارم المعلمات النابضة نظام مراقبة الأصول الميدانية.
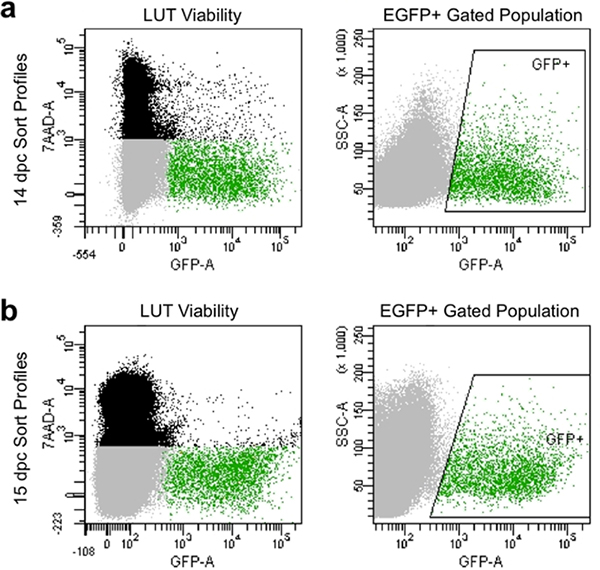
الشكل 4. صورة الممثل لمحات نوع تدفق 14،5 في شركة ظفار (أ) و 15.5 DPC (ب). ويتألف السكان السود من الخلايا واحدة تقوم على التشرذم إلى الأمام والجانب الذي لقوا حتفهم وصفت من قبل7-AAD مضان. ويتألف سكان الرمادي من خلايا القميص على أساس مبعثر إلى الأمام والجانب الذي لم يستبعد 7-عاد وقابلة للبقاء وهكذا. يشار إلى سكان بوابات الخضراء من قبل "GFP +" محاصر المنطقة، وتتألف من خلايا وحيدة أن استبعدت 7-AAD (قابلة للحياة)، ويحمل EGFP مضان.
Discussion
خطوط مراسل الماوس التعبير للصحفيين فلوري أصبحت متاحة على نطاق واسع من خلال جهود متعددة في المجتمع الوراثة الفئران 1،8،9. ويمكن نتيجة لذلك تكون الطريقة تفكك يتضح هنا يطبق على نطاق واسع لعزل الخلايا العصبية فرعية منفصلة على أساس عصبي أو أنماط التعبير مستقبلات إما...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
فإن الكتاب أود أن أشكر كاثرين الفورد للحصول على اقتراحات حول خلية تفكك الأساليب ويلر كيفين، فلاهيرتي ديفيد ماتلوك وبريتاني للحصول على الدعم في تدفق الموارد الخلوي المشتركة في مركز جامعة فاندربيلت الطبي، وميليسا مسر ألف للحصول على المساعدة الفنية مع الرسوم التوضيحية. نشكر الدكاترة. موشر جاك موريسون وشون لتقديم المشورة بشأن تنفيذ العزلة من أسلاف الخلايا العصبية. ويدعم هذا التدفق الخلوي VMC مورد مشترك من قبل مركز فاندربيلت السرطان انجرام (P30 CA68485) ومرض في الجهاز الهضمي فاندربيلت مركز أبحاث (P30 DK058404). وأيد هذا العمل بتمويل من المعاهد الوطنية الأميركية للصحة منح DK064251، DK086594، وDK070219.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | بائع | فهرس العدد | تعليقات |
| Accumax | سيغما (MFR: تقنيات مبتكرة خلية) | A7089-100ML | تخزين المجمدة في aliquots 1 مل |
| أنا الدناز | سيغما | D-4527 | المخزنة المجمدة في -20 درجة مئوية 5 ملغ / مل في 1xHBSS، (المستخدم في تبريد، تطفئوا 1:5) |
| 10X PBS درجة الحموضة 7.4 | Gibco | 70011-044 | جعل ما يصل الى 1X مع زراعة الأنسجة المياه الصف مرشح ثم عقيم |
| 10X HBSS ث / س الكالسيوم أو المغنيسيوم | Gibco | 14185-052 | جعل ما يصل الى 1X مع زراعة الأنسجة المياه الصف مرشح ثم عقيم |
| ليبوفيتز لL-15 متوسطة | Gibco | 21083027 | |
| البنسلين / الستربتومايسين عقار 100X | Gibco | 15140-133 | مخزن aliquoted في -20 درجة مئوية |
| جيش صرب البوسنة | سيغما | A3912-100G | تخزين aliquoted في -20 درجة مئوية، و 100 ملغم / لتر في المياه |
| Biowhittaker 1M HEPES في كلوريد الصوديوم 0.85٪ | Lonza | 17-737E | |
| 38 نايلون NITEX ميكرومتر شبكة غشاء | Sefar أمريكا | 3-38/22 | مقطعة إلى مربعات ~ سم 3. الأشعة فوق البنفسجية لتعقيم علاج بين عشية وضحاها في نسيج الثقافة غطاء محرك السيارة. |
| 7-AAD | إينفيتروجن | A1310 | 1 ملغ / مل |
| TRIzol LS | إينفيتروجن | 10296-028 | |
| 5 مل أنابيب البولي ستايرين | صقر | 352058 | |
| 15 مل أنابيب مخروطية | كورنينج | 430790 | |
| غرامة الملقط تشريح | آلات العلم غرامة | 11251-30 | دومون # 5 وorcep، Dumoxel، ومعيار رأس 0.1x0.06mm |
| تشريح ملعقة | آلات العلم غرامة | 10370-18 |
References
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved