このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
蛍光活性化細胞選別(FACS)胎児マウスの内臓からの自律神経前駆細胞の分離用に最適化された手順
Erratum Notice
要約
胎児のマウス組織からの神経堤由来の神経前駆細胞を精製する最適化された手順が記載されています。このメソッドは、蛍光活性化セルソーティング(FACS)によって離散的集団を分離するために蛍光レポーター遺伝子からの発現を利用しています。技術が開発を通して、大人の組織から神経細胞集団を単離するために適用することができます。
要約
開発神経堤(NC)に由来神経前駆細胞は、腸と下部尿路のような内臓器官に自律神経節を形成する神経管から移行します。レーザーキャプチャーマイクロダイセクションのようなメソッドを使用して、離散的集団のその分離は困難であるので、開発時には、成熟した組織の両方でこれらの細胞は、しばしば広く組織全体に分散されています。ただし、これらのチロシンヒドロキシラーゼ(TH)のようなニューロン特異的遺伝子の調節領域で駆動蛍光レポーターの発現によって直接可視化することができる。我々は可能なTHの高収率+腸解離と蛍光活性化セルソーティング(FACS)に基づいて、下の尿生殖路(LUT)を含む、胎児マウスの内臓組織から神経前駆細胞用に最適化する方法を説明します。
TH遺伝子は、カテコールアミンの生産のための律速酵素をコードしている。腸神経前駆細胞は、TH DURを表現し始める胎児の腸1とTHでの移行をることも大人の骨盤神経節ニューロンの2-4のサブセットに存在しています。この系統の最初の外観と、これらのLUTの他の側面のニューロン、およびその分離の分布が記載されていない。 THを発現する神経前駆細胞は、導入遺伝子コンストラクトのTg(TH-EGFP)DJ76Gsat/Mmnc 1を持つマウスにおけるEGFPの発現により容易に可視化することができる。我々は0.5 DPCとプラグ検出の朝を指定して、15.5日後に性交(DPC)で開発LUTにTHの分布+細胞を記録するために胎児のマウスでこの遺伝子の発現をイメージングし、観察された合体における神経前駆細胞のサブセット骨盤神経節急行EGFP。
LUT TH +神経前駆細胞を単離するために、我々は当初、胎児マウスの小腸2月6日から、神経堤幹細胞を精製するために使用された方法を最適化されています。依拠NC-から派生した集団を単離する前に努力フローサイトメトリー用細胞懸濁液を得るためのコラゲナーゼとトリプシンのカクテルで消化。私たちの手にこれらの方法は、比較的低い生存率LUTから細胞懸濁液を生成した。胎児のLUT組織における神経前駆細胞の既に低い発生率を考えると、我々は、最終的な解離の細胞生存率が増加されるような解離方法を最適化するために設定してください。我々は、私たちは下流の分析のために十分な神経前駆細胞のその後の収率で一貫してより大きな生存率(全細胞の> 70%)を達成することができ、低圧力での並べ替え、その穏やかなACCUMAXで解離(革新的なセルテクノロジーズ株式会社)、マニュアルフィルタリング、およびフローを決定した。我々が記述する方法が広く、胎児または成体マウス組織のいずれかからニューロン集団の様々な分離に適用することができます。
プロトコル
1。メディアの準備(組織培養フード内で行ったすべてのステップ)
- 次の手順を組み合わせる:44 mlのL-15培地、0.5ミリリットル100Xペニシリン/ストレプトマイシン(P / S)、0.5ミリリットルが100 mg / mlウシ血清アルブミン(BSA)、0.5ミリリットル1M HEPES、5 mlの組織培養グレードの水。追加する前に徹底的にBSAとP / Sを混在させるようにしてください。このボリュームは、最大の解離のための5つの異なる組織の種類に適切でなければなりません。このメディアは、組織の酵素的解離後に使用するために焼入れ溶液を調製するには、手順3.4で使用されます。
- フィルターメディア0.22μmのポリエーテルスルホン(PES)フィルタけど。
- 組織培養グレードの水を使用して、10倍株から緩衝生理食塩水(PBS)1Xハンクス平衡塩溶液(HBSS)と1Xリン酸塩を準備します。 0.22μmのPESフィルターを通してろ過する。これらの試薬の大ボリュームは前もって準備し、4℃で保存し、必要に応じて組織培養フードの小さいボリュームを分注することができます。
- 1X HBSS、(使用して複数の15 mlコニカルチューブを埋める氷の上で、サブ解剖を計画し、組織の数)を保持するチューブを等しくなるように管の数。
2。解剖
- 制度の動物のケアに応じてタイミング妊娠中のマウスを安楽死させる、氷冷1X PBSを含む60または100 mmペトリ皿に委員会が承認したプロトコルと転送子宮を使用しています。
- 子宮から胚を取り出して、氷冷1X PBSで斬首によって安楽死させる。蛍光照明の下で個々に画面には、正のトランスジェニックマウスおよび野生型(WT)非トランスジェニックプールに分割する。解剖を通して氷冷1X PBSで胚を保持します。
- 解剖顕微鏡下では、泌尿生殖器管をサブには、分析する。微細な鉗子と前肢レベルの場所に胚を保持します。その後活発にダウンして離れて背側体壁から内臓を引っ張ってダイアフラムのレベルで鉗子を挿入することによって、性器結核、肝臓から内臓を取り出します。
- さらに組織をサブ解剖離れて周囲の組織( 図1)からの関心。氷冷1X HBSSを含む15 mlのコニカルチューブにそれぞれ個別のサブ解剖組織型に配置します。プールの各組織型一緒に胚の表現型に基づいて( すなわち、すべてのGFP +胎児の腸のサンプルは、単一の15 mlコニカルチューブにプールされています)。
- 並行して、フローサイトメトリーで補償コントロールに使用する野生型胚から同等の組織を分析する。
3。 Subdissected組織の解離
- ペレットサブ解剖210相対遠心力(RCF)、4℃で5分間遠心分離による組織。遠心分離後、できるだけ多くのHBSSとしてオフに吸引除去する。
- 組織型の交差汚染を回避するために、各サンプル間のピペットチップを変更している、アキュマックス(革新的なセルテクノロジーズ株式会社)に組織ペレットを再懸濁します。アキュマックス付加価値の量は、組織を大きくしたり小さくしたり額に比例してスケールアップすることができます。通常は1-5胎児の腸のサンプルは、アキュマックスの1ミリリットルが使用されますが、大きな組織のプールは、解離を達成するために大きなボリュームが必要になります。
- 孤立している組織の段階( 例えば、13.5 DPCの小腸20分、15.5 DPCの小腸35分)に応じて20から45分間、37℃の水浴に場所は、チューブ。途中で解離時間も、手動で水浴(または任意の固体表面)の側面にチューブをノックして(1つは昔ながらの水銀体温計を振るように)チューブを "フリック"で組織を分割します。解離時間の終わりでさらに試料を解離させるプロシージャを複数回シェイクダウンを繰り返します。壊れやすいサンプルについては、シェイクダウンの活力にあふれていることを減らし、代わりに解離の適切なレベルを達成するために、ステップ3.5の間にピペット粉砕を使用しています。 14.5と15.5 DPC DPC LUTの典型的な解離時間はそれぞれ35と45分です。
- 組織はアキュでインキュベートされていますが、焼入れなどを作るlutionsは、と呼ばれるには、急冷し、1:5に急冷。クエンチを6ml L-15メディアに45μlの5 mg / mlのDNase Iを加えることによって行われます。消す1:05を30ml L-15メディアに45μlの5 mg / mlのDNase Iを加えることによって行われます。
- 解離の終わりには、氷の上に15 mlチューブを移動し、直ちに各チューブに1 mlのクエンチを追加します。組織( 図2)はほぼ完全に解離されるまで上下に各サンプルをひいて粉にする。まだ溶液中に存在する組織のいくつかの小さな塊があるでしょう。それは悪い細胞の生存をもたらすことができるように完全に均質なサンプルを達成することは容易に達成可能でも望ましいものでもありません。
- プロトコルの残りのためにできるだけ多くのサンプルを氷上に保持します。クエンチをピペッティングあるいはサンプルのクロスコンタミネーションを避けるために、1:5に急冷時に新鮮なピペットチップを使用してください。
4。細胞懸濁液をフィルタリング
- 70%エタノールに浸漬された鉗子を用いて、上に38μmのナイロンメッシュ膜の正方形3センチ(Sefarアメリカ)を配置新しい15 mlコニカルチューブの口。ナローボアのヒントを使用して、膜の中心にピペッティングによりメッシュを介してフィルタセル。膜はフィルタリングしながら飽和になった場合は、キムワイプでチューブの口を乾燥させ、それを削除し、細胞懸濁液の残りの部分をフィルタリングするためにナイロンメッシュの新しい部分を使用しています。すべてのセルがフィルタリングされたら、チューブをリンスし、残りの細胞をフィルタリングするために1:5クエンチ1ミリリットルを使用しています。
- フィルタリングが完了したときや、詰まった膜を交換する場合に、メッシュの側面をロールアップし、細胞のいずれかぶら下がった液滴を除去するためにチューブの上部に膜を拭くために鉗子を使用しています。
- 210rcf遠心分離によってペレットの細胞懸濁液を、4℃で5分間。 1ミリリットルクエンチ1:5の上清とペレットを再懸濁しをオフに吸引します。
- 5 mlのポリスチレンチューブにナイロンメッシュを介してフィルタ細胞懸濁液。 1ミリリットルで15 mlチューブを洗浄、1:5およびフィルタは、任意の残りの細胞をキャプチャするために急冷。
5。 FACSのサンプルを準備
- ソートのために、補償のコントロールで同じ組織を使用している場合は、1/10補正コントロールで使用する新しい5 mlのポリスチレンチューブにサンプル量の1/20日に転送されます。二つの部分に野生型の組織サンプルを分割します。後半は7 Aminoactinomycin D(7-AAD、 "染色可能性"として使用される生細胞から除外された蛍光インターカレーター)は7-AADのみ(それに追加されますうちの一方の部分は、(WTのみ)、野生型染色になります。)これらの個々のコントロールは、フローソーターで離散蛍光体の発光の間の任意のスペクトルの重なりの補正を可能にするために必要とされている。例えば、EGFPのような単一の蛍光レポーターのために、必要なコントロールが含まれます:、唯一の染色WT細胞、わずか7-AAD(図3)で染色したチューブをEGFP。
- 5分間210rcfでクエンチ1:5及び遠心、4°Cで細胞懸濁液を含む全5 mlチューブを埋める。液体の約200μlを残し、上清を吸引チューブインチ
- クエンチ1:5の7-AAD 1:1000に希釈します。 7-AADのみ補償制御とソートするサンプルに7-AAD染色希釈を追加します。 7-AAD EGFPのみ、またはWTのみ補償コントロールに追加しないでください。量得られた細胞ペレットの原料とサイズの量に基づいて異なります追加する7-AAD。 7-AADは、適切なチューブに追加されたら、サンプルでは、ソートする準備が整いました。
組織 サンプル·プール·サイズ ボリューム7-AADチューブ*に追加する 15.5 DPCの腸 1月5日 200μlの 15.5 DPC LUT 1月5日 150μlの
メディアの吸引であるため、 表1。異なる組織解離し、各チューブ内の*最終的な合計金額に追加された7-AAD量は50μLの範囲の量によって異なります。nプロセス近似し、ペレットを避けるために行った。最終的なボリュームは、溶液中の細胞の処理を最小限に抑えるように測定されていません。 - 1.5 mlのマイクロ遠心チューブに0.75ミリリットルTRIZOL-LSを追加することにより、RNA分離用の細胞をキャプチャするためにコレクションチューブを準備します。
- 前述のようにin vitro培養用の細胞ではなく、RNAの分離を収集し、直接、6ウェル組織培養プレートで自己複製メディアにソート細胞は、フィブロネクチンでコーティングし、メディアで満たされた場合。2,6,7
6。フローサイトメトリー
- フローサイトメーターで、戻って汚染を回避するために、各サンプルの間フラッシュしている、第1の補償を制御し評価する。ソートのために電圧/ゲートを設定するには、補正サンプルのプロファイルを使用します。所望の組織に陽性細胞が数を制限内に存在する場合、異なる組織が蛍光強度と細胞の大きさ限り、補正の設定を確立するために使用できることに注意してくださいサンプル間で同等である。
- 7-AAD染料を取ると染色コントロール( 図4)GFP蛍光の相対的な高強度を示す細胞を収集し、死細胞を回避するために、補正パラメータとゲートを設定します。
- それぞれのマイクロ遠心チューブに最大限に25,000細胞をソートします。ソートは、広い口径ノズルおよび神経前駆細胞の生存を維持するために低流量( 例えば 、17psi、100μmのノズル、3000イベント/秒)で可能な限り低い圧力で実行する必要があります。 EGFP +細胞を分離するためのソートのために我々は、EGFPレポーターを励起する488nmの20mWをレーザーを用いたBD Biosciences社FACSAriaIIに私たちのアイソレーションを実行します。
- サンプルは、高細胞濃度が含まれている場合、それがさらに7-AADは、ソートするときに、より高い捕捉効率を達成するために染色1:1000を使用して細胞懸濁液を希釈することをお勧めします。
- 渦すぐにソートされた後TRIZOL-LSに取り込まれた細胞のそれぞれのチューブ。
7。代表的な結果
フローソーティングのための細胞懸濁液を生成するために組織の解離は、適切な酵素消化と低細胞生存率になることが回避、過消化の間の微妙なバランスです。組織解離の所望のレベルの例を図2に示されています。適切に消化された組織でサブ解剖し臓器の手動粉砕片がまだはっきりと明らかになる前に( 図2b、2F)。酵素的に時間や酵素の高すぎる濃度でも長期間の治療をされる組織では、得られた懸濁液は、組織の残存大部分( 図2d、2H)を欠いている。
フィルタリング適切な解離とマニュアルは、通常、90%以上の生細胞を示し、EGFPの発現を高レベル( 図4)を示すフローサイトメトリーでソートプロファイルを生成します。この方法によって得られた細胞集団は良い説明する生存率とは、EGFPのキャプチャ+神経前駆細胞のゲーティングによる遺伝子発現のその後の文化や分析のためにキャプチャすることができます。
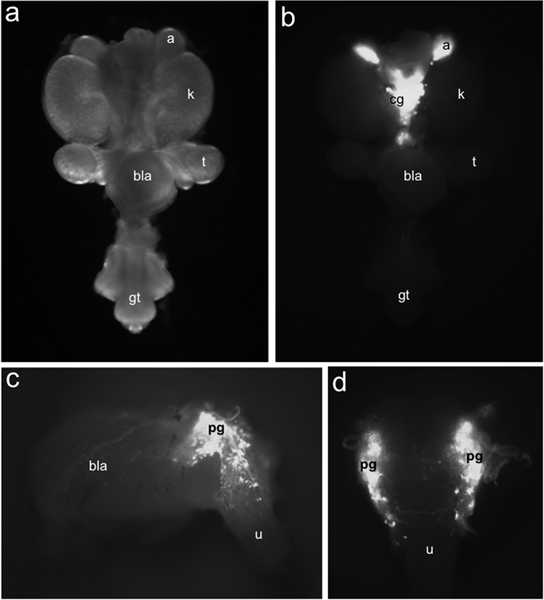
図1胎児マウスのLUTでTH-EGFP +神経前駆細胞の分布。 15.5 DPCで全体のマウント尿生殖路は蛍光照明(b)に基づき識別TH-EGFP導入遺伝子の発現で標識されたEGFP +細胞の分布と比較して()の明視野照明の下で腹見た。 TH-EGFPの発現は副腎(a)と内側に位置して腹腔神経節(CG)に存在しています。骨盤神経節(PG)、膀胱壁(BLA)と尿道(U)における導入遺伝子の発現からの蛍光15.5 DPC TH-EGFPサブ解剖膀胱の展示の横方向(c)のビュー。背ビュー(d)にEGFP +細胞は、前方背側尿道に明らかである。その他のラベル:腎臓(K)、精巣(t)は、膀胱(BLA)と性器結核(GT)。

図2 15 DPC胎児のLUT(a)と腸(e)の明視野画像は、それぞれ、解離のインキュベーションの終わりに、解離の潜伏期間の途中で撮像する前に、マニュアルの中断後の混乱(B、F)、(C、 G)、及び(d、h)を過度に解離されているサンプルインチ
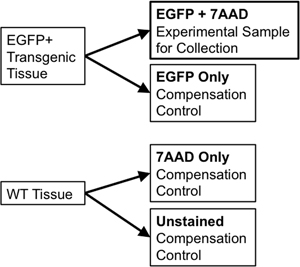
図3の回路図は、厳しいFACSゲーのパラメータを確立するために必要な補正制御を示しています。
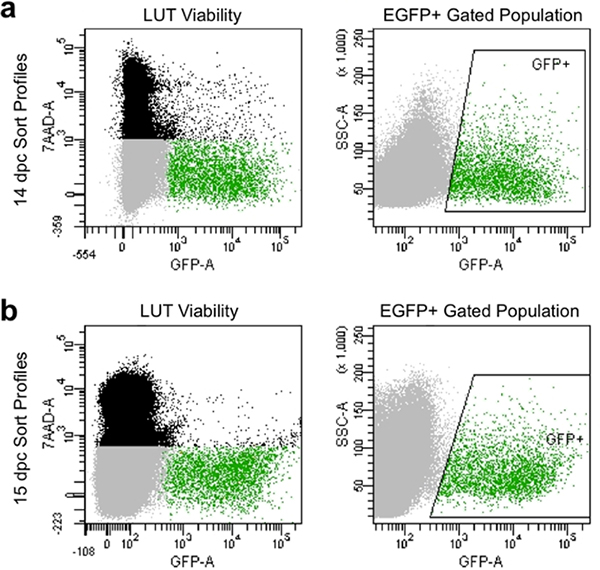
図4。14.5 DPC()と15.5 DPC(B)の流量のソートプロファイルの代表的なイメージ。黒の人口は死んだとによって表記されている前方と側方散乱に基づいて単一の細胞から構成されています7-AAD蛍光。灰色の人口は7-AADを除外したため、実行可能であるた前方及び側方散乱に基づいて一の細胞で構成されています。グリーンゲート人口は箱入りの "GFP +"領域で示されていると7-AADを(生)は除外とEGFP蛍光を示すしている単一の細胞から構成されています。
ディスカッション
蛍光レポーターを発現するマウスレポーター線は、マウス遺伝学コミュニティ1,8,9の複数の努力を通じて、広く利用可能になっています。結果として、ここで示した解離法が広く、胎児または成体組織のいずれかから神経伝達物質や受容体の発現パターンに基づいて、離散的なニューロンのサブタイプの分離に適用することができます。我々は、蛍光遺伝子レポーターの発現に基づい...
開示事項
利害の衝突が宣言されません。
謝辞
著者らは、イラストで芸術支援のためヴァンダービルト大学医療センターとメリッサA. Musserでフローサイトメトリーの共有リソースでサポートするために細胞解離の方法とケビン·ウェラー、デビッド·フラハティとブルターニュマトロックの提案のためにキャサリン·アルフォードに感謝します。我々は、博士に感謝します。神経前駆細胞の分離を実装する上でのアドバイスジャックモッシャーとショーンモリソン。 VMCフローサイトメトリーの共有リソースは、ヴァンダービルト·イングラムがんセンター(P30 CA68485)とヴァンダービルト消化器病研究センター(P30 DK058404)によってサポートされています。この作品は、健康補助DK064251、DK086594、とDK070219の米国国立研究所からの資金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 試薬名 | ベンダー | カタログ番号 | コメント |
| アキュマックス | シグマ(MFR:革新的なセルテクノロジーズ) | A7089-100ML | 1mlのアリコートで凍結保管してください |
| DNアーゼI | シグマ | D-4527 | 保存されている-20℃で凍結1xHBSSのC 5 mg / mlと、 (1:5をクエンチ、クエンチで使用) |
| 10×PBSのpHを7.4 | ギブコ | 70011-044 | その後、滅菌フィルター組織培養グレードの水で1xにメイクアップ |
| 10X HBSS W / OのCaやMg | ギブコ | 14185-052 | その後、滅菌フィルター組織培養グレードの水で1xにメイクアップ |
| リーボビッツのL-15培地 | ギブコ | 21083027 | |
| ペニシリン/ストレプトマイシン100X | ギブコ | 15140-133 | -20℃でアリコートを格納 |
| BSA | シグマ | A3912-100G | -20°C、水中では100 mg / mlになるように分注し、保管する |
| 0.85%NaClでのBiowhittaker 1MのHEPES | ロンザ | 17-737E | |
| 38μmのNITEXナイロンメッシュメンブレン | Sefarアメリカ | 3-38/22 | 〜3センチの正方形にカット。 UVは、組織培養フード内で殺菌するために一晩処理します。 |
| 7-AAD | インビトロジェン | A1310 | 1 mg / mlの |
| TRIZOL LS | インビトロジェン | 10296-028 | |
| 5 mlのポリスチレンチューブ | ファルコン | 352058 | |
| 15 mlコニカルチューブ | コーニング | 430790 | |
| 細かい解剖鉗子 | ファイン科学·インスツルメンツ | 11251から30 | デュモン#5 Forcep、Dumoxel、標準的なチップ0.1x0.06mm |
| 解剖スプーン | ファイン科学·インスツルメンツ | 10370から18 |
参考文献
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved