Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un procedimiento optimizado para el activado por fluorescencia de células de clasificación (FACS) El aislamiento de progenitores neurales autónomas de los órganos viscerales de los fetos de ratones
En este artículo
Erratum Notice
Resumen
Siguiendo un procedimiento optimizado para purificar la cresta neural, derivados progenitores neuronales a partir de tejidos fetales de ratón se ha descrito. Este método aprovecha de expresión de alelos reportero fluorescentes para aislar poblaciones discretas por clasificación de células activadas por fluorescencia (FACS). La técnica se puede aplicar para aislar las subpoblaciones neuronales en todo el desarrollo o de tejidos adultos.
Resumen
Durante el desarrollo de la cresta neural (NC) de los progenitores neuronales derivados de migrar fuera del tubo neural para formar los ganglios autonómicos en los órganos viscerales como el intestino y el tracto urinario inferior. Tanto durante el desarrollo y en los tejidos maduros estas células son a menudo muy dispersos a lo largo de los tejidos por lo que el aislamiento de las poblaciones discretas utilizando métodos como la captura de micro-disección con láser es difícil. Sin embargo, pueden ser vistas directamente por la expresión de los periodistas fluorescentes expulsados de las regiones reguladoras de genes específicos de neuronas, como tirosina hidroxilasa (TH). Se describe un método optimizado para altos rendimientos de TH + viables progenitoras neuronales de tejidos de ratón fetales viscerales, incluyendo intestino y tracto urogenital inferior (LUT), basado en la disociación y activado por fluorescencia de células de clasificación (FACS).
El gen codifica Th. la enzima limitante para la producción de catecolaminas. Entéricas progenitores neuronales empiezan a expresar TH duranteIng su migración en el intestino del feto 1 y TH también está presente en un subconjunto de neuronas de los ganglios pélvicos adultos 2-4. La primera aparición de este linaje y la distribución de estas neuronas en otros aspectos de la LUT, y su aislamiento no se ha descrito. Progenitores neuronales que expresan TH pueden ser fácilmente visualizados por la expresión de EGFP en ratones portadores del transgén construcción Tg (Th-EGFP) DJ76Gsat/Mmnc 1. Hemos fotografiado la expresión de este transgén en los ratones fetales para documentar la distribución de las células TH + en la LUT desarrollando a 15,5 días post coito (dpc), la designación de la mañana de detección de conexión de hasta 0,5 dpc, y observó que un subconjunto de células progenitoras neuronales en la coalescencia pélvica ganglios expresa EGFP.
Para aislar LUT TH + progenitores neuronales, hemos optimizado los métodos que se utilizaron inicialmente para purificar las células troncales de la cresta neural del intestino delgado de ratón fetal 2-6. Los esfuerzos anteriores para aislar a Carolina del Norte derivados de las poblaciones en que se basadigestión con un cóctel de la colagenasa y tripsina para obtener suspensiones de células de citometría de flujo. En nuestras manos estos métodos producen suspensiones de células de la LUT con la viabilidad relativamente bajo. Teniendo en cuenta la incidencia ya baja de los progenitores neuronales en los tejidos fetales TUS, nos propusimos optimizar los métodos de disociación de tal manera que la supervivencia celular en las finales se disocia se incrementaría. Se determinó que la gentil disociación en Accumax (Tecnologías Innovadoras celulares, Inc), el filtrado manual, y el flujo de la clasificación a bajas presiones, que nos permitió lograr una supervivencia constantemente mayor (> 70% del total de células), con rendimientos posteriores de progenitores neuronales suficientes para el análisis de aguas abajo. El método se describe pueden ser ampliamente aplicadas para aislar una variedad de poblaciones neuronales de cualquiera de los tejidos murinos fetales o un adulto.
Protocolo
1. Preparación de medios de comunicación (Todos los pasos a cabo en la campana de cultivo de tejidos)
- Combinar la siguiente: 44 L-15 ml de medio, 0,5 ml de 100X penicilina / estreptomicina (P / S), 0,5 ml de 100 mg / ml de albúmina sérica bovina (BSA), 0,5 ml de HEPES 1M, 5 ml de cultivo tisular de agua de grado. Asegúrese de mezclar la BSA y P / S bien antes de añadir. Este volumen debe ser adecuada para la disociación de hasta cinco tipos diferentes tejidos. Este medio se utilizará en el Paso 3,4 para preparar soluciones de Enfriamiento para su uso después de la disociación enzimática de tejido.
- Medio filtrante sin embargo 0,22 polietersulfona (PES) del filtro.
- Preparar la solución salina equilibrada de Hank 1X (HBSS) y el fosfato 1X solución salina tamponada (PBS) de 10 veces las poblaciones de cultivo de tejidos, agua de calidad. Filtrar a través de filtros de 0,22 micras de PSA. Los grandes volúmenes de estos reactivos se pueden preparar antes de tiempo y se almacenan a 4 ° C, alícuotas de volúmenes más pequeños en una campana de cultivo de tejidos como sea necesario.
- Rellene múltiples tubos cónicos de 15 ml con 1X HBSS, pornúmero de tubos para igualar el número de tejidos va en el sub-disección) el mantenimiento de los tubos en hielo.
2. Disección
- La eutanasia programada ratón embarazadas, de conformidad con el cuidado de animales institucional y protocolos de uso aprobados del comité y el útero de transferencia en un 60 o 100 mm placa de Petri que contiene el hielo frío PBS 1X.
- Eliminar embriones del útero y de la eutanasia por decapitación en el hielo frío PBS 1X. Pantalla de forma individual bajo la iluminación de fluorescencia, dividiéndose en positivos transgénicos y de tipo salvaje (WT) piscinas no transgénicos. Mantener embriones en helado PBS 1X a lo largo de la disección.
- Bajo un microscopio de disección, sub-diseccionar el tracto urogenital. Mantenga el embrión en su lugar en el nivel de miembro superior con unas pinzas finas. Eliminar las vísceras desde el hígado hasta el tubérculo genital mediante la inserción de pinzas en el nivel del diafragma entonces rápidamente tirando de los órganos internos hacia abajo y lejos de la pared dorsal del cuerpo.
- Además sub-disecar el tejido de lainterés lejos del tejido circundante (Figura 1). Coloque cada uno de forma individual sub-tipo de tejido diseccionado en un tubo cónico de 15 ml que contiene hielo 1X HBSS fría. Piscina cada tipo de tejido en conjunto de acuerdo con el fenotipo de embriones (es decir, todas las buenas prácticas agrarias + muestras de intestino del feto se agrupan en un tubo cónico de 15 ml de una sola).
- Al mismo tiempo, diseccionar los tejidos comparables de tipo salvaje embriones a utilizar para controles de compensación en la citometría de flujo.
3. La disociación de los tejidos Subdissected
- Pellet sub-disección de tejidos por centrifugación a 210 la fuerza centrífuga relativa (RCF), 4 ° C durante 5 min. Tras la centrifugación, se aspira apagado como HBSS tanto como sea posible.
- Resuspender el sedimento de tejido en Accumax (Tecnologías Innovadoras celulares, Inc), y asegúrese de cambiar las puntas de pipeta para cada muestra para evitar la contaminación cruzada de los tipos de tejidos. La cantidad de Accumax añadido puede escalarse para cantidades mayores o menores de tejido. Típicamente, para una-5 Muestras de intestino fetal, 1 ml de Accumax se utilizaría, pero grandes grupos de tejidos que requieren un mayor volumen de lograr la disociación.
- Colocar los tubos en 37 ° C baño de agua durante 20-45 minutos dependiendo de la etapa del tejido que está siendo aislada (por ejemplo 13,5 intestino DPC 20 minutos, 15,5 intestino DPC 35 min). A mitad de camino cuando el tiempo de disociación, de forma manual romper el tejido golpeando el tubo contra el lado del baño de agua (o cualquier otra superficie sólida) y por el "parpadeo" del tubo (como era de extorsionar a un termómetro de mercurio pasada de moda). Al final del tiempo de disociación repetir el movimiento hacia abajo procedimiento varias veces para disociar aún más la muestra. Para las muestras más frágiles, reducir la vigorosidad de la sacudida hacia abajo y en lugar de utilizar la trituración de pipeta durante el paso de 3,5 a alcanzar un nivel adecuado de la disociación. Tiempos de disociación de 14,5 dpc y 15.5 dpc LUT son 35 y 45 minutos, respectivamente.
- Mientras que el tejido se está incubando en Accumax, constituyen enfriamiento paraluciones, denominado Quench Quench y 1:5. Quench se hace mediante la adición de 45 l de 5 mg / ml de DNasa I de 6 ml de L-15 de medios. Quench 01:05 se hace mediante la adición de 45 l de 5 mg / ml de DNasa I de 30 ml a 15 L-Media.
- Al final de la disociación, mover tubos de 15 ml en hielo y añadir inmediatamente 1 Quench ml a cada tubo. Se tritura cada muestra arriba y hacia abajo hasta que el tejido es casi completamente disociado (Figura 2). Todavía habrá algunos pequeños trozos de tejido presente en la solución. El logro de una muestra completamente homogénea es ni fácilmente realizable ni deseable ya que puede resultar en la viabilidad celular pobre.
- Mantener la muestra en hielo tanto como sea posible durante el resto del protocolo. Asegúrese de utilizar una punta de pipeta al pipetear hasta apagar o Quench 1:05 para evitar la contaminación cruzada de muestras.
4. Filtrado de la suspensión de la célula
- El uso de pinzas que se han empapado en etanol al 70%, colocar unos 3 cm cuadrados de 38 micras membrana de malla de nylon (Sefar América) sobre ella boca de un nuevo Tubo de 15 ml cónico. Filtrar las células a través de la malla al vaso en el centro de la membrana con estrechos consejos calibre. Si la membrana se satura mientras se filtra, se retire, secar la boca del tubo con una Kimwipe, y utilizar una nueva pieza de malla de nylon para filtrar el resto de la suspensión celular. Una vez que todas las células han sido filtrados, utilice 1 ml Quench 01:05 para enjuagar el tubo y el filtro de las células restantes.
- Cuando el filtrado es completa, o cuando se reemplaza una membrana obstruido, utilizar fórceps para enrollar los lados de la malla y limpie la membrana a través de la parte superior del tubo para eliminar cualquier gotitas colgantes de las células.
- Pellet suspensión de células por centrifugación a 210rcf, 4 ° C durante 5 min. Aspirar el sobrenadante y resuspender el pellet en 1 ml Quench 01:05.
- Suspensión de células a través del filtro de malla de nylon en 5 tubos de poliestireno ml. Lavar tubo de 15 ml con 1 ml Quench 1:5 y filtro para capturar todas las células restantes.
5. Preparación de muestras para la FACS
- Si se utiliza el mismo tejido de la clasificación y para los controles de compensación, la transferencia de 1/10 a 1/20 ª del volumen de muestra a un nuevo tubo de poliestireno de 5 ml de usar para los controles de compensación. Dividir la muestra de tejido de tipo salvaje en dos porciones. Una porción se mancha de tipo salvaje (WT solamente) mientras que el segundo medio tendrá 7-Aminoactinomycin D (7-AAD, un intercalador fluorescente excluidos de células vivas utilizadas como una "mancha viabilidad") que se añade a ella (7-AAD sólo ). Estos controles individuales son necesarias para permitir la compensación de cualquier solapamiento espectral entre las emisiones de fluoróforos discretos en el clasificador de flujo. Por ejemplo, para un solo reportero fluorescente como EGFP, los controles necesarios se incluyen: EGFP solamente, sin teñir las células en peso, y un tubo de teñido con 7-AAD sólo (Figura 3).
- Rellene todos los tubos de 5 ml que contienen suspensión celular con Quench 01:05 y centrifugar a 210rcf, 4 ° C durante 5 min. Aspirar el sobrenadante, dejando aproximadamente 200 l de líquidoen el tubo.
- Diluir 7-AAD 1:1000 en Quench 01:05. Agregar 7-AAD dilución de tinción de 7-AAD Control de compensación única y muestras que deben resolverse. No agregue 7-AAD a la EGFP sólo o WT controles de compensación solamente. Volumen de 7-AAD que se añade variará dependiendo de la cantidad de material de partida y el tamaño de sedimento celular obtenido. Una vez 7-AAD se ha añadido a los tubos apropiados, las muestras están listas para ser ordenados.
Tejido Tamaño de la muestra Piscina Volumen 7-AAD que se añade a * tubo 15.5 dpc Intestino 1-5 200 l 15.5 dpc LUT 1-5 150 l
Tabla 1. Cantidad de 7-AAD añadido a disocia tejidos diferentes * La cantidad total final en cada tubo variará por una cantidad que varía desde 50 hasta 100 l desde la aspiración de los medios es unn proceso aproximado y realiza para evitar el sedimento. Volúmenes finales no se miden con el fin de minimizar la manipulación de las células en solución. - Preparar los tubos de recogida de capturar las células de aislamiento de ARN mediante la adición de 0,75 ml de TRIzol LS a tubos de 1,5 ml de centrífuga.
- Si la recolección de células para el cultivo in vitro, en lugar de aislamiento de ARN, las células ordenar directamente en los medios de auto-renovación en placas de 6 pocillos de cultivo de tejidos, las revestidas con fibronectina y se llena con los medios que se describió anteriormente. 2,6,7
6. Citometría de Flujo
- En el citómetro de flujo, evaluar la compensación de los controles en primer lugar, asegurándose de eliminar de nuevo entre cada muestra para evitar la contaminación. Utilice los perfiles de las muestras de compensación para ajustar los voltajes o las puertas de la clasificación. Nótese que si las células positivas en el tejido deseado están presentes en números limitantes, un tejido distinto puede ser utilizado para establecer la configuración de compensación, siempre y cuando la intensidad de fluorescencia y tamaño de la celdaentre las muestras son comparables.
- Establezca los parámetros de compensación y las puertas para evitar que las células muertas, que ocupan el 7-AAD tinte y recoger las células que presentan alta intensidad de fluorescencia de GFP en relación a los controles sin teñir (Figura 4).
- Clasificar como máximo 25.000 células en cada tubo de microcentrífuga. Debe realizar una selección a la menor presión posible con una boquilla de gran calibre y bajo caudal (por ejemplo, 17psi, 100 m de la boquilla, 3.000 eventos por segundo) para preservar la viabilidad de células progenitoras neuronales. Por suerte para aislar las células EGFP + realizamos nuestros aislamientos en un FACSAriaII BD Biosciences utilizando un láser de 20mW 488nm para excitar el reportero EGFP.
- Si las muestras contienen altas concentraciones de células, es aconsejable diluir la suspensión de células adicionalmente usando 1:1000 7-AAD mancha para lograr mayores eficiencias de captura al ordenar.
- Vortex cada tubo de células capturadas en TRIzol LS inmediatamente después de la clasificación.
7. Los resultados representativos
La disociación de tejidos para producir un suspensiones celulares para ordenar el flujo es un delicado equilibrio entre la digestión enzimática adecuada y evitar el exceso de digestión que puede dar lugar a viabilidades celulares bajos. Un ejemplo de nivel deseado de tejido disociación se muestra en la Figura 2. En el tejido digerido apropiadamente antes de piezas manuales trituración de los órganos sub-disecados son todavía claramente evidente (Figura 2b, 2f). En los tejidos que son enzimáticamente tratados por un período demasiado largo de tiempo o en una concentración demasiado alta de la enzima, la suspensión resultante carece de piezas residuales grandes de tejido (Figura 2d, 2H).
Adecuada la disociación y el filtrado manual producir perfiles tipo en citometría de flujo que por lo general exhiben más de 90% de células viables y muestran altos niveles de expresión de EGFP (Figura 4). Poblaciones celulares obtenidos con este método ilustrar buenaviabilidad y puede ser capturada por la cultura posterior o análisis de la expresión génica de puerta de enlace para la captura de EGFP + progenitores neuronales.
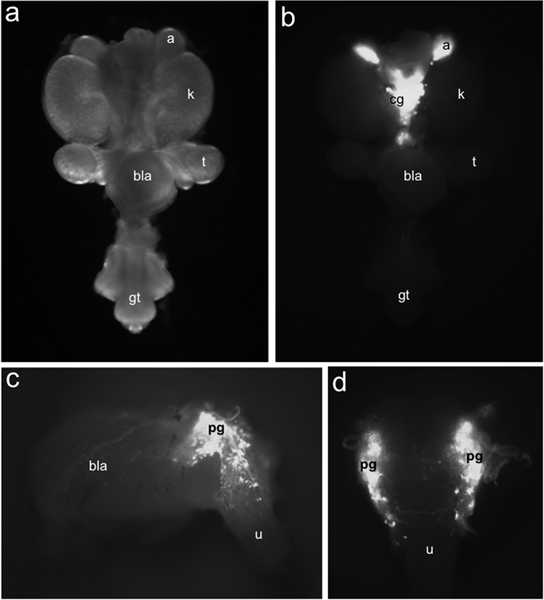
Figura 1. Distribución de la TH-EGFP + neuronales progenitores en LUT de ratón fetal. Todo el montaje en el tracto urogenital 15,5 dpc vista ventral bajo la iluminación de campo claro (a) en comparación con la distribución de EGFP + células marcadas por TH-EGFP expresión de los transgenes identificados bajo la iluminación de fluorescencia (b). TH-EGFP expresión está presente en las glándulas suprarrenales (a) y en los ganglios situados medialmente celíaca (cg). Lateral (c) punto de vista de 15,5 dpc TH-EGFP sub-muestras disecadas de vejiga de fluorescencia de la expresión del transgen en los ganglios de la pelvis (PG), la pared de la vejiga (BLA) y la uretra (u). En vista dorsal (d) EGFP + células son evidentes en la uretra anterior dorsal. Otras etiquetas: riñones (k), testículo (T), vejiga (BLA) y tubérculo genital (GT).

Figura 2. Imágenes de campo claro 15 LUT DPC fetal (a) y el intestino (e), respectivamente, fotografiado la mitad del período de incubación de disociación, al final de la incubación disociación antes de la interrupción (b, f), después de la interrupción de instrucciones (c, g), y en una muestra que ha sido demasiado disociado (d, h).
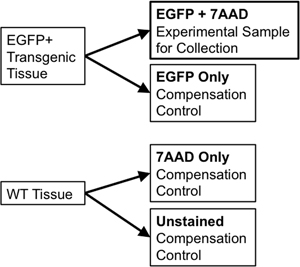
Figura 3. Diagrama esquemático ilustra la compensación necesaria para establecer controles rigurosos parámetros de compuerta FACS.
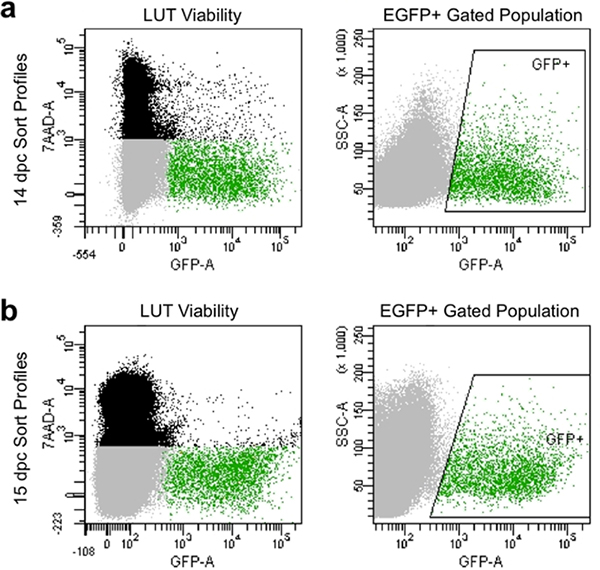
Figura 4. Imagen representativa de los perfiles de ordenación de flujos en un 14,5 dpc (a) y 15.5 dpc (b). Negro de la población se compone de células individuales basadas en la dispersión y la cara que están muertos y etiquetado por7-AAD fluorescencia. Población de Gray se compone de células singlete sobre la base de la dispersión y la cara que se han excluido 7-AAD y, por tanto viable. Población con acceso Verde se indica en caja "las buenas prácticas agrarias +" área y se compone de células individuales que han excluido a 7-AAD (viable) y presentan fluorescencia EGFP.
Discusión
Líneas de ratones que expresan reportero reporteros fluorescentes están siendo ampliamente disponibles a través de los múltiples esfuerzos de la comunidad de la genética murina 1,8,9. Como resultado, el método de disociación se ilustra aquí se puede aplicar ampliamente para el aislamiento de discretos subtipos neuronales basadas en neurotransmisor o patrones de expresión del receptor de cualquiera de los tejidos fetales o un adulto. Si bien hemos optimizado este método basado en la expresión de un ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Catalina Alford para obtener sugerencias sobre los métodos de disociación celular y Weller Kevin Flaherty David Matlock y Bretaña para el apoyo en la citometría de flujo de recursos compartidos en la Vanderbilt University Medical Center y Melissa A. Musser para la asistencia artística con ilustraciones. Agradecemos a los Dres. Jack Mosher y Sean Morrison para el asesoramiento en la implementación de aislamiento de progenitores neuronales. La Citometría de Flujo de Recursos VMC compartido con el apoyo de la Vanderbilt Ingram Cancer Center (P30 CA68485) y el Vanderbilt de Enfermedades Digestivas del Centro de Investigación (P30 DK058404). Este trabajo fue apoyado por fondos de EE.UU. Institutos Nacionales de Salud subvenciones DK064251, DK086594 y DK070219.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo Nombre | Vendedor | Número de catálogo | Comentarios |
| Accumax | Sigma (MFR: Tecnologías Innovadoras en la célula) | A7089-100ML | Almacenar congelado en alícuotas de 1 ml |
| DNasa I | Sigma | D-4527 | Almacenó congelado a -20 ° C 5 mg / ml en 1xHBSS, (Utilizado en Quench, Quench 01:05) |
| 10X de PBS pH 7,4 | Gibco | 70011-044 | Completar hasta 1x con agua de grado de cultivo de tejidos luego de filtro estéril |
| 10 veces HBSS w / o Ca o Mg | Gibco | 14185-052 | Completar hasta 1x con agua de grado de cultivo de tejidos luego de filtro estéril |
| Leibovitz medio L-15 | Gibco | 21083027 | |
| La penicilina / estreptomicina 100X | Gibco | 15140-133 | Tienda alícuotas a -20 ° C |
| BSA | Sigma | A3912-100G | Almacenar alícuotas a -20 ° C, 100 mg / ml en agua |
| Biowhittaker 1M en HEPES 0,85% de NaCl | Lonza | 17-737E | |
| 38 m de nylon de malla Nitex de membrana | Sefar Latina | 3-38/22 | Cortar en cuadrados ~ 3 cm. UV tratar la noche a la mañana para esterilizar en la campana de cultivo de tejidos. |
| 7-AAD | Invitrogen | A1310 | 1 mg / ml |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 ml tubos de poliestireno | Halcón | 352058 | |
| Tubos cónicos de 15 ml | Corning | 430790 | |
| Bellas Pinza de disección | Instrumentos Bellas Ciencia | 11251-30 | Dumont # 5 forcep, Dumoxel, estándar de la punta 0.1x0.06mm |
| Disección de una cuchara | Instrumentos Bellas Ciencia | 10370-18 |
Referencias
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados