需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
荧光激活细胞分选(FACS)自主神经祖细胞的分离,从胎鼠的内脏器官的优化程序
Erratum Notice
摘要
一个优化的过程,净化神经嵴源性神经祖细胞从小鼠胚胎组织被描述。此方法采用荧光报告基因的表达,通过荧光激活细胞分选(FACS)分离的离散人口。该技术可以应用到隔离整个发展或从成人组织中的神经元亚群。
摘要
在开发过程中,神经嵴(数控)的神经祖细胞迁移的神经管形成自主神经节,内脏器官,如小肠和下尿路。在开发过程中,这些细胞在成熟组织往往分散的整个组织,因此,使用激光捕获微解剖的方法离散人群的隔离是很难的。不过,他们可以直接可视化,如酪氨酸羟化酶(TH)神经元特异性基因的调控区域驱动的荧光记者表达。我们描述了产量高,可行的TH +神经祖细胞从胎鼠内脏组织,包括肠道和泌尿生殖道(LUT),基于分离和荧光激活细胞分选(FACS)进行了优化的方法。
TH基因编码的限速酶生产儿茶酚胺。肠道神经祖细胞开始表达TH期间ING在胎儿小肠1和TH他们迁移也是目前在成人骨盆神经节神经元2-4的一个子集。首次亮相的血统和这些神经元在其他方面的LUT,其隔离的分布尚未描述。神经祖细胞表达TH,可以很容易地可视化表达绿色荧光蛋白在小鼠携带的基因结构的Tg(TH-EGFP)DJ76Gsat/Mmnc 1。我们在小鼠胚胎成像这个基因的表达,以文件的发展中国家的LUT 15.5天后性交(DPC)的TH的分布+细胞,划定为0.5 DPC上午插件检测,并观察到的凝聚神经祖细胞的一个子集盆腔神经节表达EGFP的。
到隔离LUT的TH +神经元祖细胞,我们优化的方法,最初用来净化神经嵴干细胞从胎鼠小肠2-6。在此之前的努力隔离NC-派生的人口依靠鸡尾酒用胶原酶和胰蛋白酶消化获得细胞悬液,流式细胞仪。在我们的手中,这些方法产生的细胞悬液,从相对较低的可行性LUT。由于胎儿的LUT组织的神经祖细胞的发病率已经很低,我们成立了优化分离方法等,将增加在最终分解细胞生存。我们决心在Accumax温柔分离(创新的细胞技术公司),手动过滤,流量在低压力,使我们能够实现一贯更大的生存(细胞总数的70%),随后产量足够的神经祖细胞下游分析排序。我们所描述的方法,可以广泛应用于多种神经元的人口,无论从胎儿或成年小鼠组织隔离。
研究方案
1。媒体的准备(所有步骤在做组织培养罩)
- 结合以下几点:44毫升的L-15中,0.5毫升100X青霉素/链霉素(的P / S),0.5毫升100毫克/毫升牛血清白蛋白(BSA),0.5毫升1M肝素钠,5毫升的组织培养级水。务必混合,然后加入BSA和P / S彻底。这个量应该是足够了分解到5个不同类型的组织。该媒体将使用在步骤3.4准备淬火组织酶解后使用的解决方案。
- 虽然0.22微米聚醚砜(PES)过滤器的过滤介质。
- 准备1X汉克的平衡盐溶液(HBSS中)和1X的磷酸盐缓冲液(PBS)10X股票,利用组织培养级水。通过0.22微米的PES过滤器过滤。大量的这些试剂可以提前准备的时间,并储存在4°C,aliquoting需要在组织文化引擎盖小卷。
- 填写1X的HBSS(多个15毫升锥形管数等于你打算分,解剖组织)保持冰管的管。
2。解剖
- 按照机构的动物护理和使用委员会批准的协议和传输子宫安乐死定时到60或100毫米培养皿中含有冰冷的1×PBS孕鼠。
- 从子宫中取出胚胎及安乐死在冰冷的1×PBS斩首。屏幕荧光照明下单独划分为阳性转基因和野生型(WT)的非转基因池。整个解剖胚胎保存在冰冷的1×PBS。
- 在解剖显微镜下,分解剖泌尿生殖道。举行的地方用细镊子前肢的胚胎。从肝脏中取出内脏,生殖器结节水平膜片钳插入,然后轻快地拉动,远离背体壁内脏器官。
- 进一步细分,解剖组织远离利益的周围组织( 图1)。放入15毫升锥形管含冰冷的1X HBSS中的每个分解剖组织类型。池每个组织类型根据胚胎型( 即所有GFP +胎儿小肠样本集中在一个单一的15毫升锥形管)。
- 同时,从野生型胚胎解剖相媲美的组织补偿控制使用流式细胞仪。
3。解离Subdissected组织
- 颗粒子的解剖组织210相对离心力(RCF),4℃离心5分钟。离心后,吸出尽可能多的HBSS。
- Accumax(创新的细胞技术公司)悬浮颗粒组织,一定要改变每个样品之间的枪头,组织类型,以避免交叉污染。 Accumax增值金额为数额较大或较小的组织可以扩大。通常为1将用于-5胎儿小肠样本,1毫升Accumax,但更大的组织池将需要更大的体积来实现分离。
- 地方管到37°C的水浴20-45分钟,取决于被孤立的组织( 如 13.5 DPC肠20分钟,15.5 DPC肠道35分钟)的阶段。中途虽然分离时间,组织对水浴(或任何固体表面)一边敲管和“弹”管(会动摇了一个老式的水银温度计)手动分手。在解离时间结束,下跌过程中多次重复的震动,进一步分解样品。对于较脆弱的样品,减少摇下来的蓬勃生机,而不是在步骤3.5中使用吸管研磨,以达到适当的分解水平。典型的解离为14.5 DPC和15.5 DPC LUT的时间是35和45分钟分别。
- 虽然组织孵化Accumax,淬火,使lutions,称为淬火和淬火1:5。淬火时,加入45μL5 mg / ml的DNA酶I至6毫升的L-15媒体。加入45μL5 mg / ml的DNA酶I至30毫升的L-15媒体解渴1:5。
- 在解离结束时,走上冰15 ml反应管,并立即加入1毫升的淬火,以每管。每个样品磨碎,直到组织几乎完全分离( 图2)。仍然会有组织在解决目前一些小块。实现一个完全同质的样本,是既不容易实现的,也不可取,因为它可以导致细胞活力差。
- 冰样品,尽可能保持协议的其余部分。时移液淬火或淬火1:5到避免样品的交叉污染,务必使用新鲜枪头。
4。过滤细胞悬液
- 使用已在70%乙醇浸泡的镊子,将在38微米尼龙网膜3厘米正方形(SEFAR美国)一个新的15毫升锥形管口。通过滤网吸取到中心使用窄口径的提示膜细胞。如果趋于饱和,而过滤膜,将它删除,干管口与kimwipe,并使用一条新的尼龙网过滤细胞悬液的其余部分。一旦所有的细胞已被过滤,用1毫升,淬火1:5到冲洗管和过滤任何剩余的细胞。
- 过滤时是完整的,或更换堵塞膜时,使用镊子卷起网格的两侧和整个管顶部擦拭膜细胞中删除的任何挂水滴。
- 在颗粒细胞悬液,离心,4℃5分钟210rcf。 1毫升淬火1:5吸上清,重悬沉淀。
- 通过尼龙网过滤细胞悬液分为5毫升聚苯乙烯管。洗出1毫升15毫升管淬火1:5和过滤器捕捉任何剩余的细胞。
5。流式细胞仪样品准备
- 如果使用排序和补偿控制相同的组织,1/10的样本量的1/20 日到一个新的5毫升聚苯乙烯管,用于补偿控制转移。野生型的组织样本分成两部分。一个部分将不染野生型(野生型),而下半年将有7-Aminoactinomycin的D类(7-AAD的,荧光intercalator的“活力染色”用活细胞除外)(7-AAD的)。这些单独的控制需要,以便赔偿之间的离散流分拣荧光发射光谱重叠。例如,对于这样一个单一的EGFP荧光记者,必要的控制措施将包括:EGFP,不染野生型细胞,并与7-AAD的(图3)染色管。
- 填补所有5毫升管含有细胞悬液,以1:5和离心机淬火210rcf,4°C间5分钟。吸出上清液,留下约200微升液体在管。
- 7-AAD的1:1000稀释1:5淬火。加入7-AAD的染色稀释到7-AAD的唯一补偿控制和样本进行排序。不添加7-AAD EGFP的唯一或野生的唯一补偿控制。卷7-AAD要添加会有所不同起始原料和细胞颗粒大小获得金额为基础。一旦7-AAD的已被添加到相应的管,样品准备进行排序。
组织 样品池大小 第7卷-AAD被添加到管* 15.5 DPC小肠 1-5 200μL 15.5 DPC的LUT 1-5 150μL
表1。自媒体的愿望是,不同的组织中分离*最后在每个管的总金额的7-AAD的添加量会有所不同数额范围从50-100微升1n个近似的过程和执行,以避免沉淀。最终卷不测量,以尽量减少处理溶液中的细胞。 - 准备收集管捕获RNA提取的细胞,加入1.5毫升离心管0.75毫升的TRIzol-LS。
- 如果细胞在体外培养,而不是RNA分离收集,排序,直接进入自我更新的媒体在6孔组织培养板细胞,涂有纤维连接蛋白与媒体充满如前所述。2,6,7
6。流式细胞仪
- 在流式细胞仪检测,评估补偿控制第一,确保每个样品之间冲洗,以避免污染。使用补偿样本的配置文件设置电压/门排序。请注意所需的组织细胞,如果是限制多,一个独特的组织可以用来建立补偿设置,只要长的荧光强度和细胞大小样本之间的相媲美的。
- 设置补偿参数和大门,以避免占用7-AAD的染料和收集参展GFP荧光的相对强度高,不染控制( 图4)细胞的死亡细胞。
- 排序到每个离心管最大25000细胞。排序应在最低可能的压力与大口径喷嘴和低流量( 例如 ,17psi,100微米的喷嘴,3000事件/秒),以维持神经祖细胞的可行性。为各种分离绿色荧光蛋白+细胞,我们执行我们的BD Biosciences公司FACSAriaII隔离使用20mW的488nm激光激发绿色荧光蛋白记者。
- 如果样品含有很高的细胞浓度,这是明智的稀释细胞悬液,进一步用1:1000 7-AAD的染色排序时,以实现更高的捕获效率。
- 涡每管细胞中的TRIzol LS排序后,立即抓获。
7。代表结果
组织分解产生一个细胞悬液流排序是足够的消化酶和避免过度消化,可导致细胞存活率低之间的微妙平衡。所需的组织分离的一个例子如图2所示。前手工研磨件次解剖器官组织在适当的消化仍明显( 图2B,2F)。在太长的一段时间或酶浓度过高,是酶处理的组织,由此产生的暂停没有任何组织残留的大块( 图2D,2H)。
手册的适当分离和过滤产生排序型材,流式细胞仪,通常表现出活菌大于90%,显示EGFP的表达水平高( 图4)。通过这种方法得到的细胞群说明好由门捕获的EGFP +神经祖细胞的活力和可以捕获随后的文化基因表达分析。
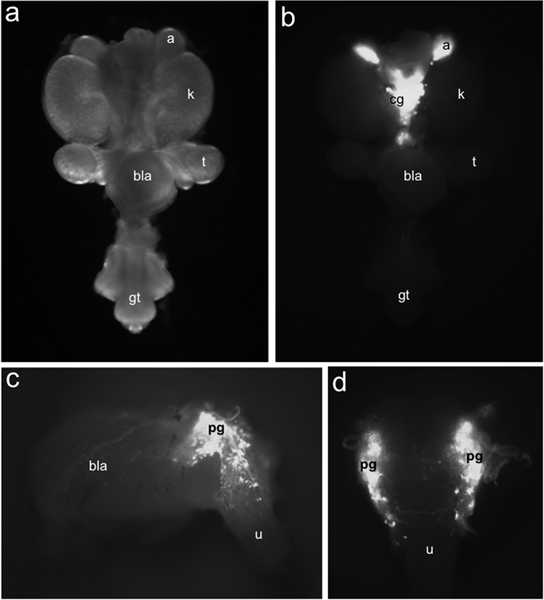
图1。胎鼠LUT的TH-EGFP的+神经祖细胞的分布。整个安装在泌尿生殖道15.5 DPC看腹侧(一)亮场照明下EGFP的TH-EGFP的荧光照明下(二)确定的转基因表达的标记细胞的分布相比。 TH-EGFP的表达,是存在于肾上腺(a)和内侧位于腹腔神经节(CG)。横向(三)鉴于15.5 DPC TH-EGFP的亚解剖膀胱展品在盆腔神经节(PG),膀胱壁和尿道(U)(BLA)的转基因表达的荧光。背视图(D)绿色荧光蛋白+细胞是显而易见的前背尿道。其他标签:肾脏(K),睾丸(T)(BLA),膀胱和生殖结节(GT)。
图2 15 DPC胎儿的LUT(a)和小肠(E)明场图像,分别拍摄中途通过分离潜伏期,在分离培养结束前中断(B,F)手动中断后,(C, g)和样品中,已经过于分离(D,H)。
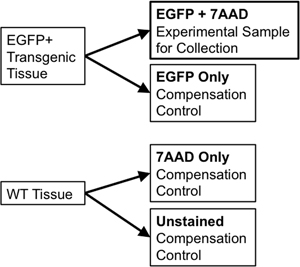
图3。示意图说明补偿控制,需要建立严格的流式细胞仪门参数。
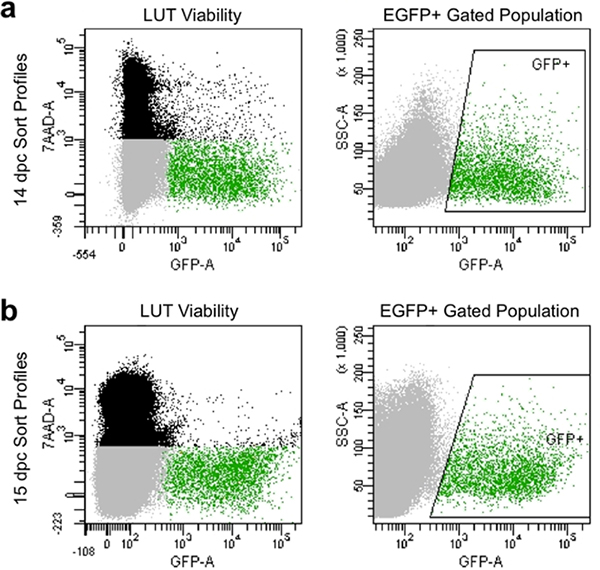
图4。14.5 DPC(a)和15.5 DPC(二)流量排序型材的形象代表。黑人人口由单一的基础上向前和侧面分散的细胞都死了,和标记7-AAD的荧光。灰色的人口是根据已排除7-AAD的,因此可行的正向和侧面散射的单细胞组成。绿门人口表示盒装“的GFP +”区域,并已排除7-AAD的(可行的),并表现出EGFP荧光的单细胞组成。
讨论
老鼠记者线条表达荧光记者正在成为广泛使用,通过多种努力在小鼠遗传学社区1,8,9。因此,说明这里的分离方法,可广泛应用于神经递质或受体的表达方式,无论从胎儿或成人组织为基础的离散神经元亚型隔离。虽然我们已经优化了基于荧光的转基因记者表达方法,它也可以被应用于标记活细胞免疫标记方法3-5,10表达细胞表面受体的样品。
在我们的手中,?...
披露声明
没有利益冲突的声明。
致谢
笔者想感谢细胞分离方法和凯文·韦勒,大卫·弗莱厄蒂和布列塔尼马特洛克建议凯瑟琳·奥尔福德在范德比尔特大学医学中心和Melissa A.马瑟在流式细胞仪共享资源的支持与插图艺术的援助。我们感谢博士。杰克·毛思迪和肖恩·莫里森实施隔离的神经祖细胞的意见。 VMC流式细胞仪共享资源是由范德比尔特英格拉姆癌症中心(P29 CA68485)和范德比尔特消化系统疾病研究中心(P29 DK058404)的支持。这项工作是由来自美国国家卫生补助DK064251,DK086594,DK070219研究院的资金支持。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 供应商 | 目录编号 | 评论 |
| accumax | 西格玛(MFR:创新的电池技术) | A7089-100ML | 存储在1毫升等分冻结 |
| DNA酶I | 西格玛 | D - 4527 | 储存在-20℃5毫克/毫升在1xHBSS, (用于在淬火,淬火1:5) |
| 10X PBS pH值7.4 | Gibco公司 | 70011-044 | 弥补组织文化品位水1倍,然后无菌过滤 |
| 10X的HBSS W / O型钙或镁 | Gibco公司 | 14185-052 | 弥补组织文化品位水1倍,然后无菌过滤 |
| 莱博维茨的L-15培养基 | Gibco公司 | 21083027 | |
| 青霉素/链霉素100X | Gibco公司 | 15140-133 | 店分装在-20°C |
| 牛血清白蛋白 | 西格玛 | A3912-100G | 储存在-20℃,100毫克/毫升的水,分装 |
| biowhittaker 1M HEPES在0.85%的NaCl | 龙沙 | 17-737E | |
| 38的微米NITEX尼龙网状膜 | SEFAR美国 | 3-38/22 | 切成3厘米正方形。紫外线治疗一夜之间在组织文化引擎盖消毒。 |
| 7-AAD的 | Invitrogen公司 | A1310 | 1毫克/毫升 |
| Trizol法的LS | Invitrogen公司 | 10296-028 | |
| 5毫升聚苯乙烯管 | 鹘 | 352058 | |
| 15毫升锥形管 | 康宁 | 430790 | |
| 精解剖钳 | 精密科学仪器 | 11251-30 | 杜蒙#5楼orcep,Dumoxel,小费标准0.1x0.06mm |
| 解剖勺 | 精密科学仪器 | 10370-18 |
参考文献
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。