Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine optimierte Methode für Fluorescence-Activated Cell Sorting (FACS) Isolierung von Autonomic neuralen Vorläuferzellen aus inneren Organen des Fötus Mäuse
In diesem Artikel
Erratum Notice
Zusammenfassung
Ein optimiertes Verfahren zur Neuralleiste abgeleitet neuronalen Vorläuferzellen-aus fetalen Gewebe der Maus zu reinigen, wird beschrieben. Diese Methode nutzt die Vorteile der Ausdruck von fluoreszierenden Reporter-Allele zu diskreten Populationen durch Fluoreszenz-aktivierte Zellsortierung (FACS) zu isolieren. Die Technik kann angewendet, um neuronale Subpopulationen während der Entwicklung oder von adulten Geweben zu isolieren.
Zusammenfassung
Bei der Entwicklung der Neuralleiste (NC)-abgeleiteten neuronalen Vorläuferzellen wandern weg von dem Neuralrohr zu autonomen Ganglien in inneren Organen wie dem Darm und der unteren Harnwege zu bilden. Sowohl während der Entwicklung und im reifen Gewebe Diese Zellen sind oft weit im gesamten Gewebe verteilt, so dass die Isolierung von diskreten Populationen mit Methoden wie Laser-Capture-Mikrodissektion ist schwierig. Sie können jedoch direkt visualisiert durch Expression von fluoreszierenden Reporter regulatorischen Regionen von Neuronen-spezifischen Gene, wie Tyrosin-Hydroxylase (TH) angetrieben wird. Wir beschreiben ein Verfahren, um hohe Ausbeuten von lebensfähigen TH + neuronalen Vorläuferzellen aus der fötalen Maus viszeralen Geweben, einschließlich Darm und unteren Urogenitaltrakts (LUT), bezogen auf Dissoziation und Fluoreszenz-aktivierte Zellsortierung (FACS) optimiert.
Die Th-Gen kodiert für das geschwindigkeitsbestimmende Enzym für die Produktion von Katecholaminen. Magensaftresistente neuronalen Vorläuferzellen beginnen, während TH ausdrückenÝng ihrer Wanderung in der fetalen Darm 1 und TH ist auch in einer Untergruppe von Erwachsenen pelvinen Ganglien Neuronen 2-4. Der erste Auftritt dieser Linie und die Verteilung dieser Neuronen in anderen Aspekten der LUT und ihre Isolation ist nicht beschrieben worden. Neuronale Vorläuferzellen exprimiert TH kann leicht sichtbar gemacht durch die Expression von EGFP in Mäusen, die das Transgen-Konstrukt Tg (Th-EGFP) DJ76Gsat/Mmnc 1. Wir abgebildet Ausdruck dieses Transgen in der fötalen Mäuse, die Verteilung der TH +-Zellen in den Entwicklungsländern LUT dokumentieren bei 15,5 Tage nach der Begattung (DPC), Benennung der Morgen des Plug-Erkennung als 0,5 DPC, und beobachtet, dass eine Teilmenge von neuronalen Vorläuferzellen in der Koaleszenz pelvinen Ganglien Express EGFP.
Um LUT TH + neuronalen Vorläuferzellen zu isolieren, optimierte Methoden, die wir ursprünglich verwendet wurden, um Neuralleiste Stammzellen aus fetalem Mausdarm 2-6 zu reinigen. Vorherige Bemühungen zur NC-derived Populationen angeführten isolierenVerdau mit einem Cocktail von Collagenase, Trypsin, um Zellsuspensionen für die Durchflusszytometrie zu erhalten. In unseren Händen diesen Methoden hergestellten Zellsuspensionen aus der LUT mit relativ geringen Rentabilität. Angesichts der ohnehin schon niedrige Inzidenz von neuronalen Vorläuferzellen im fetalen Gewebe LUT, machten wir uns um die Dissoziation Verfahren, so dass das Überleben der Zelle in den letzten distanziert erhöht werden würde optimieren. Wir festgestellt, dass sanfte Dissoziation in Accumax (Innovative Cell Technologies, Inc), manuelle Filterung, Sortierung und Durchfluss bei niedrigem Druck konnten wir durchweg höhere Überlebensrate (> 70% der gesamten Zellen) mit anschließender Ausbeuten von neuronalen Vorläuferzellen ausreichend für Downstream-Analyse zu erzielen. Verfahren beschreiben wir können allgemein angewendet werden, um eine Vielzahl von neuronalen Populationen von entweder fötalen oder adulten Mausgeweben isolieren.
Protokoll
1. Vorbereitung der Medien (Alle Schritte in Gewebekultur Haube getan)
- Kombinieren der folgenden: 44 ml L-15 Medium, 0,5 ml 100X Penicillin / Streptomycin (P / S), 0,5 ml 100 mg / ml Rinderserumalbumin (BSA), 0,5 ml 1 M HEPES, 5 ml Gewebekultur sterilem Wasser. Achten Sie darauf, BSA und P / S gründlich zu mischen, bevor Sie. Dieses Volumen sollte ausreichend sein für die Dissoziation von bis zu fünf verschiedenen Geweben Typen. Dieses Medium wird in Schritt 3.4 verwendet werden, um Abschrecken Lösungen für den Einsatz nach der enzymatischen Spaltung von Gewebe vorzubereiten.
- Filtermedien obwohl 0,22 um Polyethersulfon (PES)-Filter.
- Bereiten Sie 1X Hanks Balanced Salt Solution (HBSS) und 1x Phosphat-gepufferte Kochsalzlösung (PBS) ab 10x Stocks auf Gewebekulturen reines Wasser. Filtern durch 0,22 um PES-Filter. Große Mengen dieser Reagenzien können im Voraus hergestellt werden und bei 4 ° C, Aliquotieren kleineren Volumen in einer Gewebekulturabzug nach Bedarf.
- Füllen Sie mehrere 15 ml konischen Röhrchen mit 1X HBSS (Anzahl der Rohre, um die Anzahl von Geweben garantieren auf Sub-Zerlegung) halten Röhrchen auf Eis gleich.
2. Zergliederung
- Zeitüberschreitung schwangere Maus in Einklang mit den institutionellen Pflege der Tiere und Use Committee gebilligt Protokolle und Transfer in eine Gebärmutter einschläfern 60 oder 100 mm Petrischale mit eiskaltem 1X PBS.
- Embryonen aus der Gebärmutter entfernen und einschläfern durch Enthauptung in eiskaltem 1X PBS. Bildschirm einzeln unter Fluoreszenz-Beleuchtung, die Aufteilung in positiven transgenen und Wildtyp-(WT) nicht transgenen Pools. Halten Embryonen in eiskaltem 1X PBS während der Dissektion.
- Unter einem Binokular, sub-sezieren des Urogenitaltrakts. Halten Sie den Embryo im Ort an der Vorderpfote Ebene mit feinen Pinzetten. Entfernen der Eingeweide aus der Leber auf der Genitalhöcker durch Einführen einer Pinzette auf der Ebene der Membran dann kräftig Ziehen der inneren Organe nach unten und weg von der dorsalen Körperwand.
- Weitere Unterkategorien sezieren das Gewebe derInteresse von dem umgebenden Gewebe (1). Platzieren Sie jede einzeln Sub-seziert Gewebetyp in einem 15 ml konischen Röhrchen mit eiskaltem 1X HBSS. Pool jeden Gewebetyp zusammen nach Embryo-Phänotyp (dh alle GFP +-Proben von fetalen Darm sind in einem 15 ml konischen Röhrchen gepoolt).
- Parallel dazu sezieren vergleichbar Gewebe von Wildtyp-Embryonen für die Wiedergutmachung der Kontrollen an der Durchflusszytometrie verwenden.
3. Die Dissoziation von Gewebe Subdissected
- Pellet Gewebe durch Zentrifugation bei 210 relative Zentrifugalbeschleunigung (RCF), 4 ° C für 5 min Sub-seziert. Nach der Zentrifugation, absaugen so viel wie möglich HBSS.
- Resuspendieren Sie das Pellet in Gewebe Accumax (Innovative Cell Technologies, Inc), wobei Sie auf Pipettenspitzen zwischen jeder Probe ändern, um eine Kreuzkontamination von Gewebearten zu vermeiden. Die Menge des zugesetzten Accumax kann für größere oder kleinere Mengen von Gewebe skaliert werden. Typischerweise für 1-5 Fetalen Darm Proben, 1 ml Accumax würde verwendet werden, aber größere Gewebe Pools erfordert ein größeres Volumen zur Dissoziation zu erreichen.
- Die Röhrchen in 37 ° C Wasserbad für 20-45 Minuten, je nach Stufe des Gewebes isoliert (zB 13.5 dpc Darm 20 min, 15,5 dpc Darm 35 min). Halfway obwohl die Dissoziation Zeit manuell brechen die Gewebe durch Klopfen das Rohr gegen die Seite des Wasserbad (oder jede feste Oberfläche) und "blätterte" die Röhre (wie man es schüttelt sich ein altmodisches Quecksilber-Thermometer). Am Ende der Dissoziation Zeit wiederholen Sie den Shake Down Vorgang mehrmals zu weiteren distanzieren die Probe. Für weitere empfindliche Proben, reduzieren Sie die Heftigkeit der Shake Down und stattdessen Pipette Verreibung während Schritt 3,5 bis ein angemessenes Maß an Dissoziation zu erreichen. Typische Zeiten für Dissoziation 14,5 und 15,5 DPC DPC LUT sind 35 und 45 min, bzw..
- Während Gewebe in Accumax Inkubation wird, Make up Abschrecken sosungen, Quench Quench bezeichnet und 1:5. Quench wird durch Zugabe von 45 ul 5 mg / ml DNase I bis 6 ml L-15 Medien. Quench 1:5 durch Zugabe von 45 ul 5 mg / ml DNase I in 30 ml L-15 Medien.
- Am Ende der Dissoziation, bewegen Sie 15 ml Röhrchen auf Eis und sofort mit 1 ml Quench in jedes Röhrchen. Man reibt jede Probe auf und ab bis Gewebe ist fast vollständig dissoziiert (Abbildung 2). Es wird noch immer kleine Stücke des Gewebes in der Lösung vorhanden sein. Das Erreichen einer vollständig homogenen Probe ist weder leicht erreichbar noch wünschenswert, da es kann zu einer schlechten Lebensfähigkeit der Zellen führen.
- Halten auf Eis so weit wie möglich für den Rest des Protokolls. Achten Sie darauf, um eine frische Pipettenspitze verwenden beim Pipettieren bis Quench Quench oder 01.05, um eine Kreuzkontamination von Proben zu vermeiden.
4. Filterung Zellsuspension
- Mit einer Pinzette, die in 70% Ethanol eingeweicht worden sind, legen Sie eine 3 cm im Quadrat von 38 um Nylon-Mesh-Membran (Sefar America) über dieMund eines neuen 15 ml konischen Röhrchen. Filter-Zellen durch das Netz durch Pipettieren in die Mitte des Membran mit enger Bohrung Tipps. Wenn die Membran gesättigt, während Filterung, entfernen Sie es, trocknen Sie die Mündung der Röhre mit einem Kimwipe, und verwenden Sie ein neues Stück Nylon-Mesh, den Rest der Zellsuspension zu filtern. Sobald alle Zellen gefiltert wurde, verwenden Sie 1 ml Quench 1:5 bis spülen Sie den Schlauch und Filter alle restlichen Zellen.
- Beim Filtern abgeschlossen ist, oder beim Austausch einer verstopften Membran, verwenden Zange zu krempeln Sie die Seiten des Netzes und wischen Sie die Membran über Oberseite des Rohrs, um alle hängenden Tropfen der Zellen zu entfernen.
- Pellet Zellsuspension durch Zentrifugation bei 210rcf, 4 ° C für 5 min. Absaugen Überstand und Pellet erneut in 1 ml Quench 1:5.
- Filter Zellsuspension durch Nylon-Mesh in 5 ml Polystyrol-Röhrchen. Waschen Sie 15 ml Röhrchen mit 1 ml Quench 1:5 und Filter, um alle verbleibenden Zellen zu erfassen.
5. Probenvorbereitung für die FACS
- Wenn mit dem gleichen Gewebe zum Sortieren und zur Kompensation Kontrollen, 1/10 th bis 1/20 th des Probenvolumens auf ein neues 5 ml Polystyrol Röhrchen für die Wiedergutmachung der Steuerelemente verwenden zu übertragen. Teilen Sie den Wildtyp Gewebeprobe in zwei Teile. Ein Teil wird ungefärbt Wildtyp (WT Only) werden, während der zweiten Hälfte 7-Aminoactinomycin D (7-AAD, eine fluoreszierende Interkalator von lebenden Zellen als "Lebendfärbung" verwendet ausgeschlossen) haben wird hinzugefügt, um es (7-AAD nur ). Diese einzelnen Kontrollen sind notwendig, um auf Ersatz aller hieraus spektrale Überlappung zwischen Emission von diskreten Fluorophore am Fluss Sorter ermöglichen. Zum Beispiel für einen einzelnen fluoreszierenden Reporter wie EGFP, würde notwendigen Kontrollen umfassen: EGFP nur, ungefärbten WT-Zellen, und ein Rohr mit 7-AAD nur (Abbildung 3) gefärbt.
- Füllen Sie alle 5-ml-Röhrchen mit der Zellsuspension mit 1:5 und Quench-Zentrifuge bei 210rcf, 4 ° C für 5 min. Absaugen des Überstandes, so dass ungefähr 200 ul Flüssigkeitin Rohr.
- Verdünnen Sie 7-AAD 1:1000 in Quench 1:5. Fügen Sie 7-AAD-Färbung Verdünnung auf 7-AAD nur Ausgleichs-Steuerung und Proben, die sortiert werden. Fügen Sie nicht nur auf die EGFP oder WT nur Entschädigung Kontrollen 7-AAD. Band 7-AAD hinzugefügt wird auf die Menge an Ausgangsmaterial und hat eine Größe von Zellpellet gewonnen werden, variieren. Nach 7-AAD hat, geeignete Röhrchen zugefügt wird, sind Proben bereit, sortiert werden.
Gewebe Probe Pool Size Volume 7-AAD zu Rohr * hinzugefügt werden 15,5 DPC Darm 1-5 200 pl 15,5 DPC LUT 1-5 150 ul
Tabelle 1. Erzielte 7-AAD zugegeben, um verschiedene Gewebe dissoziiert * Die endgültige Summe in jedem Röhrchen wird um einen Betrag im Bereich von 50-100 &mgr; variieren, da das Ansaugen von Medien ist einn ungefähren Prozess und durchgeführt, um die Pellets zu vermeiden. Abschließende Volumes werden nicht, welche die Handhabung von Zellen in der Lösung zu minimieren gemessen. - Bereiten Sammelröhrchen, um Zellen für RNA-Isolierung durch Zugabe von 0,75 ml TRIzol-LS auf 1,5 ml Reaktionsgefäßen zu erfassen.
- Wenn Sammeln von Zellen in vitro-Kultur, als RNA-Isolierung, sortiert Zellen direkt in Selbsterneuerung Medien in 6-Well-Gewebekulturplatten, die mit Fibronectin beschichtet und gefüllt mit Medien, wie zuvor beschrieben. 2,6,7
6. Durchflusszytometrie
- Am Durchflusszytometer, bewerten die Entschädigung Kontrollen zuerst, dass auf jeden Fall wieder zwischen jeder Probe spülen, um Verunreinigungen zu vermeiden. Verwenden Sie die Profile der Entschädigung Proben zu Spannungen / Tore für die Sortierung eingestellt. Beachten Sie, dass, wenn positive Zellen in dem Gewebe in gewünschte Begrenzung Zahlen sind, eine deutliche Gewebe verwendet werden, um Belichtungsausgleichseinstellungen solange die Fluoreszenzintensität und Zellgröße einzurichtenzwischen den Proben sind vergleichbar.
- Set Kompensationsparametern und Tore, um tote Zellen, die bis zu 7-AAD-Farbstoff und sammeln Zellen, die eine hohe Intensität der GFP-Fluoreszenz relativ zu ungefärbten Steuerelemente (4) zu vermeiden.
- Sortieren Sie maximal 25.000 Zellen in jedes Mikrozentrifugenröhrchen. Die Sortierung sollte bei möglichst geringen Druck mit einer großen Bohrung und Düse geringer Strömungsgeschwindigkeit (zB 17psi, 100 um Düse, 3.000 Veranstaltungen / sec) zu neuronalen Vorläuferzellen lebensfähig zu erhalten durchgeführt werden. Für Sorten EGFP +-Zellen zu isolieren, um führen wir unsere Isolierungen auf einer BD Biosciences FACSAriaII mit einem 488nm 20mW-Laser, um die EGFP-Reporter zu erregen.
- Wenn die Proben hohe Konzentrationen Zelle enthalten, ist es ratsam, die Zellsuspension weitere Verwendung 1:1000 7-AAD Fleck auf höhere Wirkungsgrade zu erreichen Gefangennahme bei der Sortierung zu verdünnen.
- Jedes Röhrchen von Zellen in Trizol-LS sofort nach der Sortierung erfasst.
7. Repräsentative Ergebnisse
Gewebedissoziation, um eine Zelle Suspensionen für die Sortierung Flow produzieren, ist eine heikle Balance zwischen ausreichender enzymatische Verdauung und die Vermeidung von Über-Verdauung, die in niedriger Zellvitalitäten führen kann. Ein Beispiel für gewünschte Gewebedissoziation ist in 2 gezeigt. In geeigneter Weise verdaute Gewebe vor der manuellen Verreibung Stücke von Sub-sezierten Organe sind noch deutlich zu erkennen (Abb. 2b, 2f). In Geweben, die enzymatisch zu lange Zeit oder bei einer zu hohen Konzentration des Enzyms behandelt werden, fehlt die resultierende Suspension alle restlichen große Gewebestücke (2d, 2h).
Entsprechende Dissoziation und manuelle Filterung produzieren Art Profile bei der Durchflusszytometrie, die typischerweise mehr als 90% lebensfähige Zellen und zeigen ein hohes Maß an EGFP-Expression (Abbildung 4). Zellpopulationen durch dieses Verfahren erhalten illustrieren gutLebensfähigkeit und können für die spätere Kultur oder Analyse der Genexpression durch Gating werden zur Erfassung von neuronalen Vorläuferzellen EGFP + eingefangen.
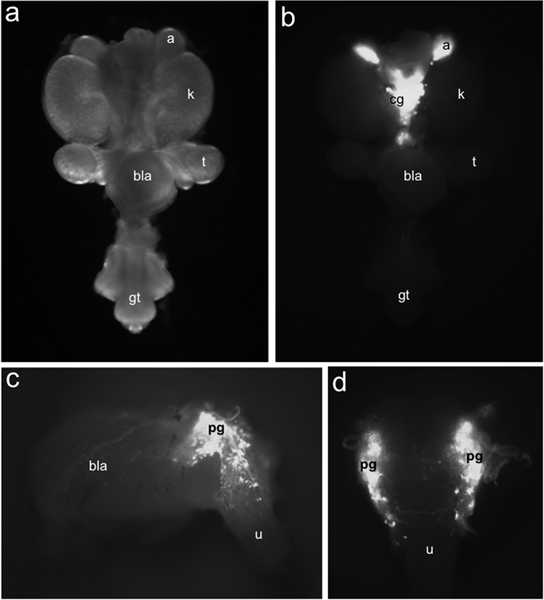
Abbildung 1. Verteilung der TH-EGFP + neuronale Vorläuferzellen in der fötalen Maus LUT. Whole-mount Urogenitaltraktes bei 15,5 DPC ventral unter Hellfeldbeleuchtung angesehen (a) im Vergleich zur Verteilung von EGFP + Zellen von TH-EGFP Transgenexpression unter Fluoreszenz-Beleuchtung (b) identifiziert beschriftet. TH-EGFP-Expression ist in Nebenniere (a) und medial angeordnet Zöliakie Ganglien (cg). Seitliche (c) Blick von 15,5 DPC TH-EGFP Sub-seziert Blase Exponate Fluoreszenz von Transgenexpression in pelvinen Ganglien (PG), der Blasenwand (bla) und Harnröhre (u). In Dorsalansicht (d) EGFP + Zellen sind in der vorderen Rückenflosse Harnröhre deutlich. Andere Labels: Nieren (k), Hoden (t), Blase (bla) und Genitalhöcker (gt).

2. Hellfeld Bilder von 15 dpc fetalen LUT (a) und Darm (e), jeweils zur Hälfte abgebildet durch Dissoziation Inkubationszeit am Ende der Dissoziation Inkubation vor Störungen (b, f), nach manueller Unterbrechung (c, g) und in einer Probe, wurde übermäßig dissoziiert (d, h).
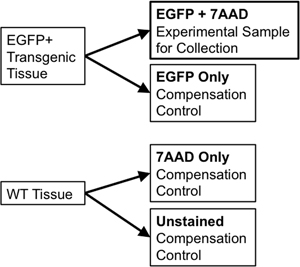
Abbildung 3. Schematische Darstellung veranschaulicht Entschädigung, die erforderlich sind, um rigorose FACS-Gating-Parameter zu etablieren.
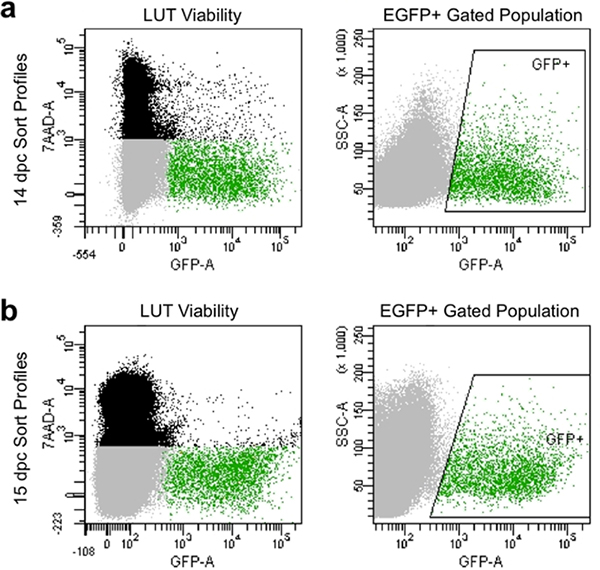
4. Repräsentative Bild Strömungsrichtung Art Profilen 14.5 dpc (a) und 15,5 dpc (b). Schwarze Bevölkerung setzt sich aus einzelnen Zellen basierend auf Vorwärts-und Seitwärts-Streulicht, die tot sind und gekennzeichnet durch umfasste7-AAD-Fluoreszenz. Grau Bevölkerung wird von Singulett-Zellen auf Vorwärts-und Seitwärts-Streulicht, das 7-AAD ausgeschlossen haben und sind somit tragfähige Basis besteht. Grüne gated Bevölkerung wird durch boxed "GFP +"-Bereich angegeben und besteht aus einzelnen Zellen, die 7-AAD (lebensfähigen) ausgeschlossen haben und zeigen EGFP-Fluoreszenz zusammen.
Diskussion
Maus-Reporter exprimieren fluoreszierenden Reporter sind eine immer stärkere Verbreitung über verschiedene Anstrengungen im murinen Genetik Gemeinde 1,8,9. Als ein Ergebnis die Dissoziation hier dargestellten Verfahren kann stark zur Isolierung von diskreten neuronalen Subtypen Neurotransmitter-Rezeptor oder Expressionsmuster von entweder fötalen oder adulten Geweben, aufgebracht werden. Während wir diese Methode auf Expression eines fluoreszierenden Reporter-Transgen Basis optimiert haben, kann es auch z...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Catherine Alford für Anregungen Zelldissoziationslösung Methoden und Kevin Weller, David Flaherty und der Bretagne Matlock danken für die Unterstützung in der Durchflusszytometrie Shared Resource an der Vanderbilt University Medical Center und Melissa A. Musser für künstlerische Unterstützung mit Illustrationen. Wir danken Dr.. Jack Mosher und Sean Morrison Beratung beim Einsatz Isolierung von neuronalen Vorläuferzellen. Der VMC Durchflusszytometrie Shared Resource wird von der Vanderbilt Ingram Cancer Center (P30 CA68485) und der Vanderbilt Digestive Disease Research Center (P30 DK058404) unterstützt. Diese Arbeit wurde durch Mittel aus US-amerikanischen National Institutes of Health Zuschüsse DK064251, DK086594 und DK070219 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagenz Namen | Verkäufer | Katalog-Nummer | Kommentare |
| Accumax | Sigma (MFR: Innovative Cell Technologies) | A7089-100ml | Bewahren eingefroren in 1 ml Aliquots |
| DNase I | Sigma | D-4527 | Bei -20 ° C eingefroren 5 mg / ml in 1xHBSS, (Wird in Quench, Quench 1:5) |
| 10X PBS, pH 7,4 | Gibco | 70011-044 | Machen Sie bis zu 1x mit Gewebekulturqualität Wasser dann Sterilfilter |
| 10x HBSS w / o Ca-oder Mg | Gibco | 14185-052 | Machen Sie bis zu 1x mit Gewebekulturqualität Wasser dann Sterilfilter |
| Leibovitz L-15-Medium | Gibco | 21083027 | |
| Penicillin / Streptomycin 100X | Gibco | 15140-133 | Lagerung bei -20 ° C aliquotiert |
| BSA | Sigma | A3912-100G | -Store aliquotiert bei -20 ° C, 100 mg / ml in Wasser |
| Biowhittaker 1M HEPES in 0,85% NaCl | Lonza | 17-737E | |
| 38 um NITEX Nylon-Mesh-Membran | Sefar America | 3-38/22 | Schneiden Sie in ca. 3 cm große Quadrate. UV-Behandlung über Nacht in der Gewebekultur Haube zu sterilisieren. |
| 7-AAD | Invitrogen | A1310 | 1 mg / ml |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 ml Polystyrol-Röhrchen | Falke | 352058 | |
| 15 ml konischen Röhrchen | Corning | 430790 | |
| Feine Dissektionszangen | Fine Science Instruments | 11251-30 | Dumont Nr. 5 forcep, Dumoxel, Standard-Spitze 0.1x0.06mm |
| Dissecting Löffel | Fine Science Instruments | 10370-18 |
Referenzen
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten