A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
נוהל אופטימליים עבור Fluorescence המופעל בידוד מיון (FACS) תא של אבות עצביות האוטונומית מאיברים בטן של עכברים עוברית
In This Article
Erratum Notice
Summary
הליך אופטימיזציה לטהר עצביים לפסגה הנגזרות אבות עצביים מרקמות העכבר העובר מתוארת. שיטה זו מנצלת את הביטוי של אללים הכתב ניאון לבודד אוכלוסיות נפרדות על ידי מיון הקרינה המופעל תאים (FACS). הטכניקה ניתן ליישם על מנת לבודד subpopulations עצביים לאורך ההתפתחות או ברקמות בוגרים.
Abstract
במהלך ההתפתחות העצבית לפסגה (NC) הנגזרות אבות נוירונים נודדים מן הצינור העצבי ליצירת הגרעינים האוטונומית באיברים כמו המעי בטן ועל דרכי השתן התחתונות. הן במהלך פיתוח ברקמות בוגרים תאים אלה הם לעתים קרובות מפוזרים באופן נרחב בכל הרקמות, כך בידוד אוכלוסיות נפרדות באמצעות שיטות כמו לכידת לייזר מיקרו לנתיחה קשה. הם יכולים עם זאת דמיינו ישירות על ידי הביטוי של עיתונאים המונעים על ניאון מאזורים הרגולציה של נוירון גנים ספציפיים כמו hydroxylase טירוזין (ה '). אנו מתארים את שיטת אופטימיזציה עבור תשואות גבוהות של TH + קיימא אבות עצביים מרקמות העכבר בטן העובר, כולל המעי בדרכי המין ודרכי השתן התחתונה (LUT), המבוסס על דיסוציאציה הקרינה המופעל מיון תאים (FACS).
ה 'הגן המקודד את האנזים מגביל את שיעור לייצור catecholamines. אבות עצביים אנטרי מתחילים להביע TH durלאינג ההגירה שלהם במעי העובר 1 ו TH נוכחת גם משנה של נוירונים בוגרים הגרעינים האגן 2-4. ההופעה הראשונה של שושלת זו לבין חלוקת נוירונים אלה בהיבטים אחרים של LUT, ובידוד שלהם לא תוארה. אבות נוירונים המבטאים TH ניתן דמיינו בקלות על ידי ביטוי EGFP בעכברים נושאי מבנה transgene Tg (TH-EGFP) DJ76Gsat/Mmnc 1. אנחנו צילמו ביטוי transgene זה בעכברים עובריים כדי לתעד את חלוקת TH + תאים LUT פיתוח ב 15.5 ימים שלאחר משגל (DPC), מייעדים הבוקר של זיהוי plug כמו 0.5 DPC, ו ציין כי תת קבוצה של אבות העצבית התגבשו האגן הגרעינים אקספרס EGFP.
לבודד TH + LUT אבות עצביים, אנו אופטימיזציה שיטות ששימשו בתחילה לטהר גזע עצביים לפסגה תאים מהמעי העכבר העובר 2-6. מאמצים קודמים לבודד NC-derived אוכלוסיות לסמוך עלעיכול עם קוקטייל של collagenase ו טריפסין להשיג השעיות התא עבור cytometry הזרימה. בידינו שיטות אלה מיוצרים השעיות סלולריים מ LUT עם כדאיות נמוכה יחסית. לאור השכיחות הנמוכה ממילא של אבות עצביים ברקמות העובר LUT, יצאנו כדי לייעל את שיטות ניתוק כאלה הישרדות התא של dissociates האחרונים היה להיות מוגברת. קבענו כי ניתוק עדינה Accumax (התא טכנולוגיות חדשניות, Inc), הוראות סינון, מיון וזרימה בלחצים נמוכים אפשרה לנו להשיג שרידות גבוהה יותר באופן עקבי (> 70% של תאים הכולל של הפורום) עם תשואות הבאות של אבות עצביים מספיקים לניתוח במורד הזרם. שיטת הפעולה המתואר יכול להיות מיושם באופן כללי לבודד מגוון של אוכלוסיות נוירונים מ משני Murine רקמות עובריות או מבוגר.
Protocol
1. הכנת מדיה (כל השלבים נעשה מכסה המנוע בתרבית רקמה)
- שלב הבא: 44 מ"ל L-15 בינוני, 0.5 מ"ל 100x פניצילין / סטרפטומיצין (P / S), 0.5 מ"ל 100 מ"ג / מ"ל שור סרום אלבומין (BSA), 0.5 HEPES מ"ל 1M, 5 רקמות מ"ל מים תרבות כיתה. יש להקפיד לערבב BSA ו-P / S היטב לפני הוספת. נפח זה אמור להיות מספיק דיסוציאציה של עד חמישה סוגי רקמות שונות. מדיה זה ישמש בשלב 3.4 להכין פתרונות מרווה לשימוש לאחר ניתוק האנזימטית של רקמה.
- Media סינון אם כי 0.22 מיקרומטר Polyethersulfone (PES) מסנן.
- הכן תמיסת מלח מאוזן 1X של האנק (HBSS) ופוספט 1X שנאגרו מלוחים (PBS) ממניות 10x באמצעות תרביות רקמה מים בכיתה. לסנן דרך 0.22 מיקרומטר סינון PES. כמויות גדולות של חומרים כימיים אלה אפשר להכין מראש ולאחסן ב 4 ° C, aliquoting כמויות קטנות יותר של מכסה המנוע בתרבית רקמה לפי הצורך.
- למלא מספר 15 צינורות חרוטי מ"ל עם 1x HBSS, (מספר צינורות שווה את מספר רקמות אתה מתכנן המשנה לנתח) שמירה על צינורות על הקרח.
2. בתור
- להרדים בעיתוי העכבר בהריון בהתאם טיפול בבעלי חיים המוסדית הוועדה להשתמש בפרוטוקולים מאושרים והרחם העברת לתוך 60 או 100 מ"מ צלחת פטרי המכילה קרח קר 1X PBS.
- הסר עוברים מן הרחם להרדים על ידי עריפת ראש של קר כקרח 1X PBS. מסך בנפרד תחת תאורה פלואורסצנטי, חלוקת לתוך חיוביות (WT) בריכות מהונדס ופרוע מסוג nontransgenic. שמור עוברים קר כקרח 1X PBS ברחבי לנתיחה.
- תחת מיקרוסקופ לנתח, משנה לנתח את מערכת המין ודרכי השתן. להחזיק את העובר במקום ברמה forelimb עם מלקחיים עדינים. הסר את הקרביים מהכבד אל גבשושית איברי המין על ידי החדרת מלקחיים ברמה של הסרעפת ואז בזריזות מושך את האיברים הפנימיים כלפי מטה מהקיר הגוף הגבי.
- יתר על כן משנה לנתח את הרקמה שלעניין מן הרקמה הסובבת (איור 1). מניחים כל סוג בנפרד המשנה גזור רקמה לתוך צינור חרוטי 15 מ"ל המכיל קרים כקרח HBSS 1X. בריכת כל סוג רקמה יחד לפי פנוטיפ העובר (כלומר את כל ה-GFP + דגימות של המעי העובר הם אספו בצינור אחד 15 מ"ל חרוטית).
- במקביל, לנתח רקמות דומים של wild-type עוברים לשימוש עבור פקדים פיצויים על cytometry הזרימה.
3. דיסוציאציה של רקמות Subdissected
- גלולה המשנה גזור רקמות על ידי צנטריפוגה לעבר כוח צנטריפוגלי 210 יחסית (RCF), 4 מעלות צלזיוס למשך 5 דקות. לאחר צנטריפוגה, לשאוב את HBSS כמו רבים ככל האפשר.
- Resuspend רקמות גלולה ב Accumax (התא טכנולוגיות חדשניות, Inc), אך יש להקפיד לשנות טיפים פיפטה בין מדגם זה, כדי למנוע זיהום צולבות של סוגי רקמות. סכום נוסף של Accumax וניתן לשנותם על כמויות גדולות יותר או קטן יותר של רקמת גוף. בדרך כלל 1-5 דגימות המעי העובר, 1 מ"ל של Accumax ישמשו אך בריכות רקמות גדולות יותר ידרוש נפח גדול יותר כדי להשיג ניתוק.
- מקום צינורות לתוך 37 ° C אמבט מים במשך 20-45 דקות, תלוי בשלב של רקמת בידוד (למשל 13.5 DPC המעי 20 דק ', 15.5 דקות 35 DPC המעי). באמצע הדרך כי הזמן דיסוציאציה, באופן ידני לשבור את הרקמה על ידי דפיקות צינור על הצד של האמבטיה במים (או כל משטח מוצק) ועל ידי "מצליף" צינור (כפי שניתן היה ללחוץ את המדחום הישן כספית). בתום הזמן לחזור על ניתוק ללחוץ כלפי מטה מספר פעמים ההליך עוד יותר לנתק את המדגם. לקבלת דוגמיות יותר שבירים, להפחית את נחישות של שייק למטה במקום להשתמש טחינה דקה פיפטה במהלך שלב 3.5 כדי להשיג רמה נאותה של דיסוציאציה. טיפוסי פעמים דיסוציאציה עבור 14.5 ו 15.5 DPC DPC LUT הם 35 ו 45 דקות, בהתאמה.
- בעוד רקמות דוגרים על Accumax, איפור מרווה כךlutions, כינה דובדבני לרוות את 01:05. להרוות נעשית על ידי הוספת 45 μl 5 מ"ג / מ"ל DNase אני עד 6 מ"ל L-15 מדיה. להרוות 01:05 מיוצר על ידי הוספת 45 μl 5 מ"ג / מ"ל DNase אני ל -30 מ"ל L-15 מדיה.
- בסופו של דיסוציאציה, להעביר 15 מ"ל צינורות אל הקרח ומיד להוסיף 1 מ"ל כדי להרוות צינור אחד. Triturate כל מדגם מעלה ומטה עד רקמת כמעט ניתק לחלוטין (איור 2). עדיין יהיו כמה גושים קטנים של רקמה בתמיסה. השגת דגימה הומוגנית לחלוטין אינו בר השגה בקלות ואינו רצוי כיוון שהיא יכולה לגרום כדאיות התא עניים.
- שמור על מדגם על הקרח כמה שיותר עד סוף הפרוטוקול. הקפד להשתמש קצה פיפטה טרי כאשר pipetting עד לצנן או דובדבני 1:05, כדי למנוע זיהום צולבות של דגימות.
4. סינון השעיה Cell
- באמצעות מלקחיים, כי כבר מושרים אתנול 70%, מקום 3 ס"מ רבועים של קרום ניילון 38 מיקרומטר (רשת Sefar אמריקה) עלהפה של צינור חדש מ"ל 15 חרוטי. תאים לסנן דרך רשת על ידי pipetting למרכז של הממברנה באמצעות טיפים נשא צרים. אם הקרום הופך להיות רווי תוך סינון, להסיר אותו, לייבש את קצה הצינור עם kimwipe, ולהשתמש קטע חדש של רשת ניילון לסנן את יתרת ההשעיה התא. לאחר כל התאים כבר מסוננים, השתמש 1 מ"ל דובדבני 1:05 לשטוף את צינור ולסנן את כל התאים הנותרים.
- בעת סינון הושלמה, או בעת החלפת הממברנה סתום, להשתמש במלקחיים להפשיל את הצדדים של רשת ולנגב את הקרום לרוחב החלק העליון של הצינור ולהסיר כל טיפות תלויים של תאים.
- גלולה ההשעיה התא על ידי צנטריפוגה ב 210rcf, 4 מעלות צלזיוס למשך 5 דקות. לשאוב את supernatant ו resuspend גלולה ב 1 מ"ל להרוות 01:05.
- תא ההשעיה סינון דרך רשת ניילון לתוך 5 מ"ל צינורות קלקר. לשטוף את הצינור 15 מ"ל 1 מ"ל עם דובדבני 01:05 וסינון כדי ללכוד את כל התאים הנותרים.
5. הכנת דוגמאות עבור FACS
- אם באמצעות רקמות זהה למיון של פקדים פיצויים, להעביר 1/10 עד ה ה 1/20 של היקף המדגם כדי צינור חדש 5 מ"ל קלקר להשתמש עבור פקדי פיצויים. מחלקים את המדגם wild-type רקמות לשני חלקים. חלק אחד יהיה בלא כתם wild-type ('ט' בלבד), ואילו המחצית השנייה תהיה 7-Aminoactinomycin D (7-AAD, intercalator ניאון מחוץ תאים חיים המשמשים "הכדאיות כתם") הוסיף לו (7-AAD בלבד ). בקרות אלה בודדים יש צורך, כדי לאפשר פיצוי על כל חפיפה בין ספקטרום פליטה של fluorophores בדידים ב סדרן לזרום. למשל, על הכתב ניאון אחד כמו EGFP, פקדי הדרושים יכלול: EGFP בלבד, תאים WT בלא כתם, וכן צינור מוכתם 7-AAD בלבד (איור 3).
- מלאו את כל 5 מ"ל צינורות המכילים ההשעיה התא עם 01:05 להרוות ו צנטריפוגות ב 210rcf, 4 מעלות צלזיוס למשך 5 דקות. Aspirate supernatant, והשאיר כ 200 μl של הנוזלבצינור.
- לדלל 7-AAD 1:1000 ב 01:05 להרוות. הוסף 7-AAD דילול מכתים לשליטה 7-AAD פיצוי רק דגימות להיות מסודר. אל תוסיף 7-AAD כדי EGFP בלבד או WT שולטת פיצויים בלבד. נפח 7-AAD כדי להוסיף ישתנו בהתאם כמות החומר ההתחלתי וגודל התא גלולה להשיג. לאחר 7-AAD נוספה צינורות מתאימים, דגימות מוכנים להיות מסודר.
רקמה בריכת גודל המדגם כרך 7-AAD כדי להוסיף * צינור 15.5 DPC המעי 1-5 200 μl 15.5 DPC LUT 1-5 150 μl
טבלה 1. סכום של 7-AAD נוסף dissociates רקמות שונות * הסכום הכולל הסופי של צינור זה משתנה בהתאם לסכום הנע בין 50-100 μl מאז השאיפה של התקשורתעכ תהליך משוער וביצע להימנע גלולה. הכרכים האחרונים אינם נמדדים על מנת למזער את הטיפול התאים בתמיסה. - הכינו צינורות איסוף ללכוד תאים של בידוד RNA על ידי הוספת 0.75 ml TRIzol-LS ל 1.5 צינורות microcentrifuge מ"ל.
- אם איסוף תאים עבור בתרבות חוץ גופית, ולא בידוד RNA, תאים המיון ישירות לתוך עצמי חידוש התקשורת 6 צלחות תרבות גם רקמות, מצופה fibronectin ומלא התקשורת כפי שתואר לעיל. 2,6,7
6. תזרים Cytometry
- ב cytometer את זרימת, להעריך את הפיצוי פקדי 1, אך יש להקפיד לשטוף את הגב בין מדגם זה, כדי למנוע זיהום. שימוש בפרופילים של דגימות פיצויים להגדיר מתח / שערים למיון. שים לב שאם תאים חיוביים רקמות הרצוי נמצאים מספרים מגבילים, רקמה ייחודית שניתן להשתמש בהם כדי להקים את הגדרות פיצוי, כל עוד עוצמת הקרינה ואת גודל התאבין מדגמים דומים.
- הגדרת פרמטרים פיצויים ושערים להימנע תאים מתים כי לקחת את 7-AAD צבע ולאסוף תאים המציגים בעוצמה גבוהה יחסית של הקרינה GFP לבקרות בלא כתם (איור 4).
- למיין בצורה מקסימלית על 25,000 תאים לתוך צינור אחד microcentrifuge. מיון יש לבצע בלחץ הנמוך ביותר עם זרבובית משעמם רחב ספיקה נמוכה (למשל, 17psi, 100 מיקרומטר זרבובית, 3,000 אירועים / sec) כדי לשמר את הכדאיות אבי העצבית. עבור מיני לבודד EGFP + תאים אנו מבצעים isolations שלנו על Biosciences BD FACSAriaII באמצעות לייזר 20mW 488nm לעורר את כתב EGFP.
- אם הדגימות מכילות ריכוזים גבוהים סלולריים, רצוי לדלל עוד יותר את ההשעיה התא באמצעות 1:1000 7-AAD כתם על מנת להשיג יעילות גבוהה יותר ללכוד בעת מיון.
- כל צינור מערבולת של תאים בשבי TRIzol-LS מיד לאחר מיון.
7. נציג תוצאות
רקמת הניתוק כדי לייצר תאים השעיות למיון הזרימה היא איזון עדין בין עיכול אנזימטי מספקת והימנעות יתר מערכת העיכול שיכולה לגרום viabilities סלולריים נמוכים. דוגמה הרמה הרצויה של רקמת ניתוק מוצג באיור 2. ברקמת מתעכל כראוי לפני חתיכות טחינה דקה ידנית של איברי המשנה גזור עדיין בבירור (איור 2b, 2F). ברקמות כי מטופלים enzymatically למשך זמן רב מדי זמן או בריכוז גבוה מדי של האנזים, וכתוצאה מכך הפסקת חסר כל חלקים גדולים שאריות של רקמות (איור 2 ד, 2h).
דיסוציאציה המתאים ידנית סינון לייצר פרופילי המיון בבית cytometry זרימה, כי בדרך כלל מציגים יותר מ -90% תאים קיימא ולהראות רמות גבוהות של ביטוי EGFP (איור 4). אוכלוסיות תאים המתקבלים בשיטה זו המחשה טובההכדאיות והוא יכול ליפול בפח לתרבות לאחר ניתוח או של ביטוי גנים על ידי gating על לכידתו של EGFP + אבות עצביים.
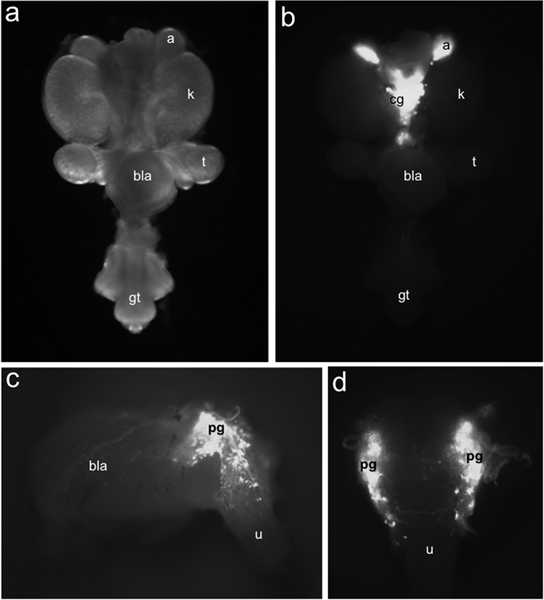
באיור 1. התפלגות TH-EGFP + נוירונים אבות ב LUT העכבר העובר. שלמה, הר בדרכי המין ודרכי השתן ב 15.5 DPC הנצפים ventrally תחת תאורה בשדה בהיר (א) לעומת חלוקת EGFP + תאים המסומנים ע"י ביטוי TH-EGFP transgene מזוהה תחת תאורה פלואורסצנטי (ב). TH-EGFP הביטוי קיים יותרת הכליה (א) ו הגרעינים צליאק ממוקם מדיאלית (CG). מבט לרוחב (ג) 15.5 DPC TH-EGFP משנה גזור תערוכות שלפוחית השתן הקרינה מן הביטוי transgene בגרעיני האגן (PG), קיר שלפוחית השתן (בלה) ו השופכה (U). לאור הגבי (ד) EGFP + תאים ניכרים השופכה הגבית קדמית. תוויות אחרות: כליות (K), testis (T), שלפוחית השתן (בלה) ו גבשושית איברי המין (GT).

איור 2. תמונות brightfield של LUT DPC 15 עוברי (א) ו המעי (ה), בהתאמה, צילמו באמצע תקופת הדגירה דיסוציאציה, בסוף הדגירה לפני ניתוק הפרעה (ב, ו), לאחר שיבוש ידנית (ג, ז), וכן במדגם כי כבר ניתק יתר על המידה (ד, ח).
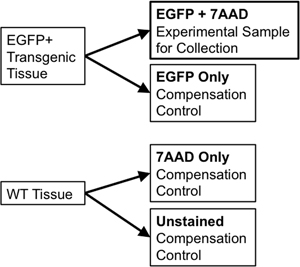
איור 3. תרשים סכמטי ממחיש פיצוי שולט צורך להקים מחמירות FACS פרמטרים gating.
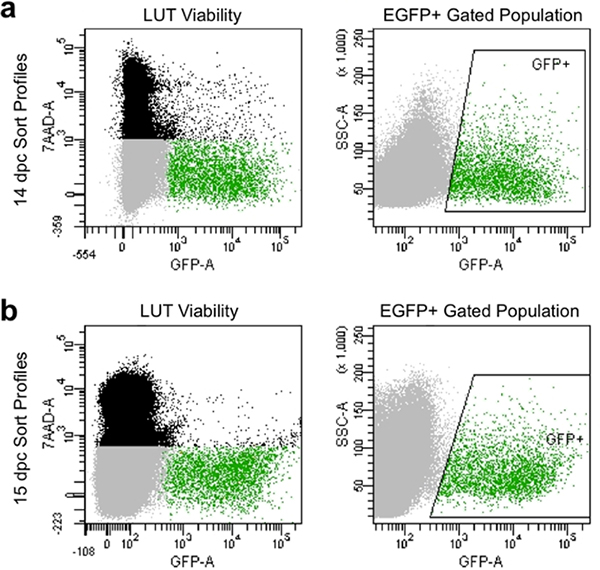
איור 4. התמונה נציג פרופילים מיון הזרימה ב 14.5 DPC (א) ו 15.5 DPC (ב). האוכלוסייה השחורה מורכב של תאים בודדים על בסיס פיזור קדימה בצד, כי הם מתים ומסומן על ידי7-AAD פלואורסצנטי. האוכלוסייה גריי מורכב תאים גופיית המבוססים על פיזור קדימה הצד אשר נכללו 7-AAD הם ישימים מבחינה בכך. אוכלוסייה מגודרת הירוק, הכיתוב "GFP +" התאגרף האזור מורכב של תאים בודדים אשר נכללו 7-AAD (בת קיימא) ולהציג הקרינה EGFP.
Discussion
הכתב עכבר קווים המבטאים כתבים ניאון הופכים להיות זמינים באופן נרחב באמצעות מאמצים מרובים Murine גנטיקה הקהילה 1,8,9. כתוצאה מכך שיטת ניתוק מאויר כאן יכולים להיות מיושמים באופן נרחב על בידודו של תת נוירונים בדידים המבוססים על עצבי או ביטוי דפוסי הקולטן מ משני רקמות ?...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
המחברים מבקשים להודות קתרין אלפורד לקבלת הצעות על התא דיסוציאציה שיטות וקווין ולר, דוד פלאהרטי ואת בריטני מטלוק על התמיכה ב משאבים תזרים Cytometry משותף באוניברסיטת ונדרבילט מרכז רפואי ומליסה א Musser לסיוע אמנותי עם איורים. אנו מודים בני הזוג. ג'ק מושר ושון מוריסון עצה יישום הבידוד של אבות עצביים. תזרים VMC Cytometry המשאב המשותף הוא נתמך על ידי אינגרם ונדרבילט במרכז לחקר הסרטן (p30 CA68485) לבין מחלות העיכול ונדרבילט מרכז המחקר (p30 DK058404). עבודה זו נתמכה על ידי ארה"ב במימון מכוני הבריאות הלאומיים מענקים DK064251, DK086594, ו DK070219.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב שם | מוכר | מספר קטלוגי | תגובות |
| Accumax | סיגמא (המימון המינימלי הנדרש: התא טכנולוגיות חדשניות) | A7089-100 מ"ל | אחסן קפוא 1 aliquots מ"ל |
| אני DNase | סיגמא | D-4527 | מאוחסן קפוא ב -20 ° C 5 מ"ג / מ"ל ב 1xHBSS, (משמש להרוות, תכבו 01:05) |
| PH 7.4 10X PBS | Gibco | 70011-044 | לעשות עד 1x במים תרבות רקמות כיתה ואז מסנן סטרילי |
| 10X HBSS W / O CA או Mg | Gibco | 14185-052 | לעשות עד 1x במים תרבות רקמות כיתה ואז מסנן סטרילי |
| ליבוביץ של L-15 בינוני | Gibco | 21083027 | |
| פניצילין / סטרפטומיצין 100x | Gibco | 15140-133 | חנות aliquoted ב -20 ° C |
| BSA | סיגמא | A3912-100 גרם | אחסן aliquoted ב -20 ° C, 100 מ"ג / מ"ל במים |
| Biowhittaker 1M HEPES ב NaCl 0.85% | Lonza | 17-737E | |
| 38 מיקרומטר NITEX ניילון קווי ממברנה | Sefar אמריקה | 3-38/22 | חותכים ~ 3 ריבועים ס"מ. UV לטיפול לילה לעקר בשכונה בתרבית רקמה. |
| 7-AAD | Invitrogen | A1310 | 1 מ"ג / מ"ל |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 מ"ל צינורות קלקר | בז | 352058 | |
| 15 צינורות חרוטי מ"ל | קורנינג | 430790 | |
| מלקחיים המבתרים יפות | המדע מכשירים דקים | 11251-30 | דומון # 5 Forcep, Dumoxel, רמת עצה 0.1x0.06mm |
| לנתח את כף | המדע מכשירים דקים | 10370-18 |
References
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved