É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um procedimento otimizado para fluorescência-ativado Isolamento classificação celular (FACS) da Autônomo progenitores neurais a partir de vísceras de ratos fetais
Neste Artigo
Erratum Notice
Resumo
Um procedimento otimizado para purificar crista neural derivados progenitores neuronais a partir de tecidos fetais de camundongos é descrito. Este método tira partido da expressão a partir de alelos repórter fluorescente para isolar populações discretas por fluorescência-activated separação de células (FACS). A técnica pode ser aplicada para isolar subpopulações neuronais ao longo do desenvolvimento ou a partir de tecidos adultos.
Resumo
Durante o desenvolvimento da crista neural (CN) derivados progenitores neuronais migrar do tubo neural para formar gânglios autonômicos em órgãos viscerais, como o intestino e do trato urinário inferior. Tanto durante o desenvolvimento e em tecidos maduros estas células são muitas vezes muito dispersos ao longo tecidos de modo a que o isolamento de populações discretas usando métodos como a laser de captura de micro-dissecção é difícil. Podem, contudo, ser directamente visualizadas por expressão de repórteres fluorescentes conduzidos a partir de regiões reguladoras de genes específicos de neurónios como tirosina hidroxilase (TH). Nós descrevemos um método optimizado para altos rendimentos de TH + de viável progenitoras neuronais a partir de tecidos de rato fetal viscerais, incluindo intestino e inferior do tracto urogenital (LUT), com base na dissociação e de fluorescência-activated separação de células (FACS).
O gene codifica Th a enzima limitante para a produção de catecolaminas. Entéricas progenitores neuronais começam a expressar TH durção a sua migração no intestino fetal 1 e TH também está presente em um subconjunto de adultos neurónios dos gânglios pélvicos 2-4. O primeiro aparecimento dessa linhagem ea distribuição destes neurónios em outros aspectos da LUT, e seu isolamento não foi descrita. Progenitores neuronais que expressam TH pode ser prontamente visualizadas por expressão de GFP em ratinhos que transportam o transgene construto Tg (Th-EGFP) DJ76Gsat/Mmnc 1. Nós imaged expressão deste transgene em ratinhos fetais para documentar a distribuição de TH + células na LUT desenvolver-se a 15,5 dias pós coito (DPC), designando a manhã de detecção do conector como 0,5 DPC, e observou-se que um subconjunto de células progenitoras neuronais no coalescência pélvica gânglios expressa EGFP.
Para isolar TH LUT + progenitores neuronais, otimizamos métodos que foram inicialmente utilizados para purificar células da crista neural estaminais do intestino do rato fetal 2-6. Esforços anteriores para isolar NC derivados populações invocadosdigestão com um cocktail de colagenase e tripsina para se obter suspensões de células por citometria de fluxo. Nas nossas mãos estes métodos produzido suspensões de células a partir da LUT com viabilidade relativamente baixo. Dada a incidência já baixo de progenitores neuronais nos tecidos fetais LUT, partimos para otimizar métodos de dissociação de tal forma que a sobrevivência da célula nos dissocia finais seriam aumentados. Nós determinamos que a dissociação suave em Accumax (Cell Technologies, Inc Inovadoras), manual de filtragem, classificação e fluxo a baixas pressões nos permitiram alcançar consistentemente maior sobrevivência (> 70% do total de células) com rendimentos posteriores de progenitores neurais suficientes para a análise a jusante. O método descrevemos podem ser amplamente aplicado para isolar uma variedade de populações neuronais a partir de qualquer fetais ou adultos tecidos de murino.
Protocolo
1. Preparação de meios de (Todos os passos feito em capuz cultura de tecidos)
- Combinar o seguinte: 44 L-15 ml de Meio, 0,5 ml 100X penicilina / estreptomicina (P / S), 0,5 ml de 100 mg / ml de Albumina de Soro Bovino (BSA), 0,5 ml de HEPES 1M, 5 ml de água de grau Tissue Culture. Certifique-se de misturar BSA e P / S bem antes de adicionar. Este volume deve ser adequada para a dissociação de até cinco tipos diferentes tecidos. Esse tipo de material será usado no Passo 3,4 para preparar soluções Quenching para uso após dissociação enzimática de tecido.
- Meio Filtrante embora de 0,22 Polietersulfona filtro (PES).
- Prepare a solução de 1X de Hank (HBSS) e fosfato 1X Buffered Saline (PBS) de Stocks 10X com tecido de água grau cultura. Filtrar através de filtro de 0,22 PES. Grandes volumes de estes reagentes podem ser preparados antes do tempo e armazenadas a 4 ° C, alíquotas volumes mais pequenos em um capuz de cultura de tecido, conforme necessário.
- Encha múltiplos 15 ml tubos cónicos com 1x HBSS, (número de tubos para igualar o número de tecidos a programar no sub-dissecando), mantendo tubos em gelo.
2. Dissecação
- Euthanize cronometrado rato grávidas, em conformidade com cuidado animal institucional e protocolos de uso aprovado pela comissão e útero de transferência de 60 ou 100 mm placa de Petri contendo gelada 1X PBS.
- Remover embriões do útero e eutanásia por decapitação no gelada 1X PBS. Tela individualmente sob iluminação fluorescente, dividindo-se positivos transgênicos e do tipo selvagem (WT) piscinas não transgênicas. Mantenha em embriões gelada 1X PBS durante dissecção.
- Sob um microscópio de dissecação, sub-dissecar do tracto urogenital. Segure o embrião no local no nível do membro anterior com pinça fina. Remover as vísceras a partir do fígado para baixo para o tubérculo genital através da inserção de uma pinça ao nível do diafragma, em seguida, rapidamente puxando os órgãos internos para baixo e para longe da parede do corpo dorsal.
- Além disso sub-dissecar o tecido deinteresse para longe do tecido circundante (Figura 1). Coloque cada um individualmente sub-tipo de tecido dissecado para um tubo de 15 ml cónico contendo geladas HBSS 1X. Piscina cada tipo de tecido em conjunto de acordo com o fenótipo embrião (ou seja, todos GFP + amostras de intestino fetal são agrupados em um tubo cônico 15 ml único).
- Em paralelo, dissecar tecidos comparáveis de tipo selvagem embriões a serem usados para os controlos de compensação em citometria de fluxo.
3. Dissociação de tecidos Subdissected
- Pellet sub-dissecados de tecidos por centrifugação a força relativa 210 centrífuga (RCF), 4 ° C durante 5 min. Após centrifugação, aspirar fora como HBSS tanto quanto possível.
- Ressuspender o sedimento em tecido Accumax (Cell Technologies, Inc Inovadoras), certificando-se de trocar a ponteira entre cada amostra para evitar a contaminação cruzada dos tipos de tecidos. A quantidade de Accumax agregado pode ser escalado para quantidades maiores ou menores de tecido. Tipicamente para uma-5 Amostras intestino fetal, 1 ml de Accumax seria usado mas piscinas maiores do tecido exigirá um maior volume de alcançar dissociação.
- Colocar os tubos em 37 ° C banho de água durante 20-45 min, dependendo fase do tecido a ser isolado (por exemplo, 13,5 intestino DPC 20 min, 15,5 intestino DPC 35 min). Na metade que o tempo dissociação, manualmente quebrar o tecido batendo o tubo contra o lado do banho de água (ou qualquer superfície sólida) e por "sacudir" o tubo (como seria de chacoalhar um antiquado termômetro de mercúrio). No final do tempo de dissociação repetir a agitação para baixo procedimento várias vezes para continuar a dissociar a amostra. Para amostras mais frágeis, reduzir o vigorousness do Shake Down e use pipeta de trituração durante a Etapa de 3,5 a atingir um nível adequado de dissociação. Tempos típicos de dissociação para 14,5 e 15,5 DPC DPC LUT são 35 e 45 min, respectivamente.
- Enquanto o tecido é incubado no Accumax, compõem Quenching assimluções, denominado Têmpera e Têmpera 1:5. Têmpera é feita pela adição de 45 uL de 5 mg / ml de DNase I a 6 ml de L-15 Media. Têmpera 01:05 é feita por adição de 45 uL de 5 mg / ml de DNase I a 30 ml de L-15 Media.
- No final da dissociação, mover tubos de 15 ml sobre gelo e imediatamente adicionar 1 Quench ml a cada tubo. Tritura-se cada amostra para cima e para baixo até que o tecido é quase completamente dissociado (Figura 2). Haverá ainda alguns pequenos pedaços de tecidos presentes na solução. Conseguir uma amostra completamente homogénea não é nem desejável nem facilmente realizável como pode resultar em viabilidade celular pobre.
- Manter amostra em gelo, tanto quanto possível para o restante do protocolo. Certifique-se de usar uma ponteira fresco ao pipetar até Têmpera Têmpera ou 1:5 a evitar a contaminação cruzada das amostras.
4. Filtragem suspensão de células
- Utilizando uma pinça que foram embebidos em etanol a 70%, coloque a 3 centímetros quadrados de 38 mesh membrana de nylon (iM Sefar América) ao longo doboca de um novo tubo de 15 ml cónico. Filtro de células através de malha de pipetagem em centro de membrana utilizando estreitas dicas furo. Se a membrana se torna saturado enquanto filtragem, removê-lo, secar a boca do tubo, com uma Kimwipe, e usar um novo pedaço de malha de nylon para filtrar o restante da suspensão de células. Uma vez que todas as células foram filtrados, utilizar 1 ml Quench 1:05 para enxaguar o tubo e filtrar quaisquer células restantes.
- Quando a filtragem é completa, ou quando a substituição de uma membrana entupido, utilize uma pinça para enrolar os lados do tecido e limpe a membrana através da parte superior do tubo para remover quaisquer gotas de suspensão de células.
- Pellet suspensão de células por centrifugação a 210rcf, 4 ° C durante 5 min. Aspirar fora o sobrenadante e ressuspender o pellet em 1 ml Quench 1:5.
- Suspensão de células através de filtro de malha de nylon em 5 ml tubos de poliestireno. Lavar a 15 ml de tubo com 1 ml Quench 1:5 e filtro para capturar quaisquer células restantes.
5. Preparação de amostras para FACS
- Se usando o mesmo tecido para classificação e para os controlos de compensação, transferir 1/10 th a 1/20 th do volume da amostra para um novo tubo de poliestireno 5 ml de usar para os controlos de compensação. Dividir a amostra de tecido do tipo selvagem em duas porções. Uma porção será unstained de tipo selvagem (WT Apenas), enquanto que a segunda metade terá 7-Aminoactinomycin D (7-AAD, um intercalador fluorescente excluídos a partir de células vivos utilizados como um "viabilidade mancha") adicionado a ele (7-AAD apenas ). Esses controles individuais são necessários para permitir a compensação de qualquer sobreposição espectral entre a emissão de fluoróforos discretos no classificador de fluxo. Por exemplo, para um repórter único fluorescente como EGFP, controlos necessários iria incluir: apenas EGFP, não coradas células em peso, e um tubo coradas com 7-AAD só (Figura 3).
- Preencher todos os 5 tubos ml contendo suspensão de células com 01:05 Têmpera e centrifugar a 210rcf, 4 ° C durante 5 min. Aspirar o sobrenadante, deixando cerca de 200 uL de líquidoem tubo.
- Diluir 7-AAD 1:1000 em 1:5 de têmpera. Adicionar 7-AAD diluição coloração para 7-AAD controle de compensação somente e amostras a serem classificadas. Não adicione 7-AAD para a EGFP apenas WT ou controles de compensação apenas. Volume de 7-AAD a ser adicionado irá variar com base na quantidade de material de partida e do tamanho do sedimento celular obtido. Uma vez 7-AAD foi adicionado a tubos adequados, as amostras estão prontas a ser classificado.
Tecido Tamanho do pool de amostra Volume 7-AAD a ser adicionado ao * tubo 15,5 Intestino dpc 1-5 200 ul 15,5 dpc LUT 1-5 150 ul
Tabela 1. Quantidade de 7-AAD adicionado a dissocia de tecidos diferentes * A quantidade total final de cada tubo irá variar de acordo com uma quantidade variando de 50-100 uL uma vez que a aspiração dos meios de comunicação é umn processo aproximada e realizada a fim de evitar o sedimento. Volumes finais não são medidos de modo a minimizar manipulação de células em solução. - Preparar tubos de recolha para capturar as células para isolamento de RNA por adição de 0,75 ml TRIzol-LS a 1,5 tubos de microcentrífuga ml.
- Se recolha de células para a cultura in vitro, em vez de isolamento de RNA, as células de classificação directamente para a auto-renovação meios de comunicação em 6 placas de cultura de tecidos, revestidas com fibronectina e preenchido com meios de comunicação, como descrito anteriormente. 2,6,7
6. Citometria de Fluxo
- No citômetro de fluxo, avaliar a compensação primeiros controles, tendo a certeza de voltar lavar entre cada amostra para evitar a contaminação. Use os perfis das amostras de compensação para definir tensões / portões para a classificação. Note-se que se as células positivas no tecido desejado estão presentes em números limitantes, um tecido distinto podem ser utilizados para estabelecer as configurações de compensação, desde que a intensidade de fluorescência e tamanho das célulasentre as amostras são comparáveis.
- Definir os parâmetros de compensação e portões para evitar as células mortas, que ocupam 7-AAD corante e recolher células que exibem elevada intensidade de fluorescência da GFP em relação aos controlos não coradas (Figura 4).
- Classificar màxima 25.000 células em cada tubo de microcentrífuga. Triagem deve ser realizada na pressão mais baixa possível com um bocal de largura furo e baixa taxa de fluxo (por exemplo, 17psi, 100 uM bocal, 3.000 eventos por segundo) para preservar a viabilidade do progenitor neuronal. Para os tipos para isolar células EGFP + de realizamos nossos isolamentos em um BD Biosciences FACSAriaII usando um laser de 488nm 20mW para excitar o repórter EGFP.
- Se as amostras contêm concentrações elevadas de células, é aconselhável para diluir a suspensão de células mais usando 1:1000 7-AAD mancha para alcançar uma maior eficiência de captura quando a classificação.
- Tubo Vortex cada uma das células capturado em TRIzol-LS imediatamente após a triagem.
7. Os resultados representativos
Tecido de dissociação para produzir um suspensões de células para triagem de fluxo é um equilíbrio delicado entre a digestão enzimática adequada e evitar o excesso de digestão, que pode resultar em viabilidade de células de baixo custo. Um exemplo de nível desejado de tecido de dissociação é mostrado na Figura 2. No tecido adequadamente digerido antes de trituração peças manuais de órgãos sub-dissecados ainda são claramente evidentes (Figura 2B, 2F). Em tecidos que são enzimaticamente tratados durante um período muito longo de tempo, ou em uma concentração demasiado elevada de enzima, a suspensão resultante não possui quaisquer peças residuais grandes de tecido (Figura 2d, 2H).
Dissociação apropriado e filtragem manual produzir perfis de classificação em citometria de fluxo que exibem tipicamente superior a 90% de células viáveis e apresentam níveis elevados de expressão EGFP (Figura 4). Populações de células obtidas por este método ilustrar boaviabilidade e podem ser capturados para a cultura subseqüente ou análise de expressão gênica pela passagem para a captura de EGFP + progenitores neuronais.
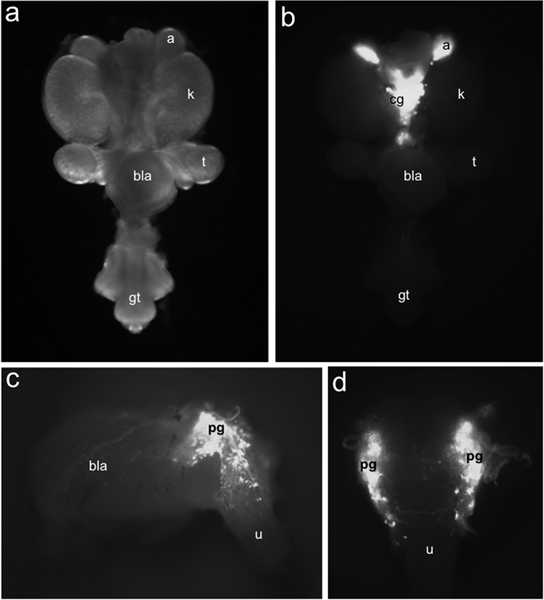
Figura 1. Distribuição de TH-EGFP + neuronais progenitores em LUT rato fetal. Whole-mount trato urogenital em 15,5 dpc visto ventralmente sob iluminação de campo claro (a) em relação à distribuição de células EGFP + de rotuladas por TH-EGFP expressão do transgene identificado sob iluminação de fluorescência (b). TH EGFP-expressão está presente em glândulas supra-renais (a) e gânglios celíaco medialmente localizado (cg). Ver (c) Lateral de 15,5 Dpc TH-EGFP sub-dissecados exposições bexiga de fluorescência a partir de expressão do transgene em gânglios pélvica (pg), a parede da bexiga (bla) e da uretra (u). Em vista dorsal (d) As células EGFP + são evidentes na uretra anterior dorsal. Outros rótulos: rins (k), testículos (t), bexiga (bla) e tubérculo genital (TG).

Figura 2. Imagens de campo claro de 15 LUT DPC fetal (a) e do intestino (e), respectivamente, trabalhada a meio do período de incubação de dissociação, no final da incubação dissociação antes ruptura (b, f), após ruptura manual (c, g), e em uma amostra que tem sido muito dissociada (d, h).
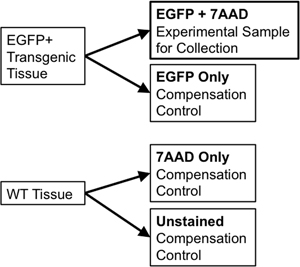
Figura 3. Diagrama esquemático ilustra a compensação necessária para estabelecer controles rigorosos parâmetros FACS gating.
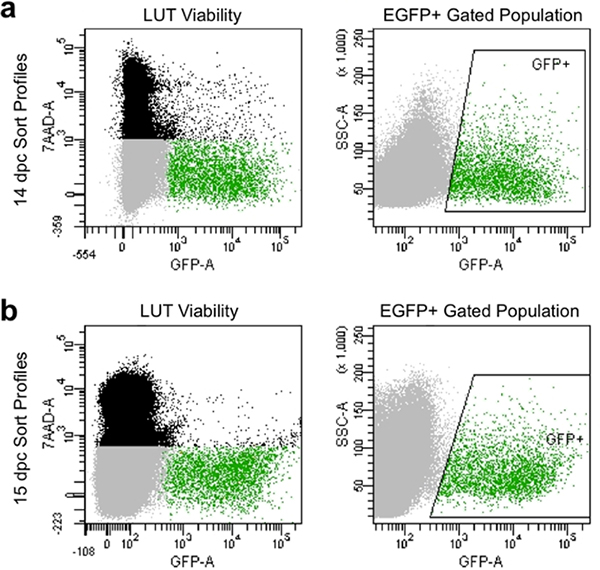
Figura 4. Imagem representativas dos perfis de classificação de fluxo em 14,5 DPC (a) e 15,5 DPC (b). População negra é composta por células isoladas com base na dispersão para a frente e de lado, que são mortos e rotulados por7-AAD de fluorescência. População cinza é composta por células singlete baseado em dispersão frontal e lateral que ter excluído 7-AAD e são, portanto, viável. População gated verde é indicada por "GFP +" encaixotado área e é composta de células únicas que têm excluídos 7-AAD (viável) e exibem fluorescência EGFP.
Discussão
Linhas de rato que expressam repórter repórteres fluorescentes estão se tornando amplamente disponível através de múltiplos esforços no murino genética comunidade 1,8,9. Como resultado do método de dissociação ilustrado aqui pode ser amplamente aplicado para o isolamento de discretas subtipos neuronais com base em neurotransmissor ou padrões de expressão de receptor a partir de ambos os tecidos fetais ou adulto. Embora tenhamos optimizado este método baseado na expressão de um transgene repórt...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer a Catherine Alford para sugestões de dissociação celular e métodos Weller Kevin, Flaherty e David Matlock Bretanha para apoio no Resource Citometria de Fluxo compartilhada no Vanderbilt University Medical Center e Melissa A. Musser de assistência artística com ilustrações. Agradecemos os drs. Jack Mosher e Sean Morrison para o conselho na implementação de isolamento de células progenitoras neuronais. O recurso de Citometria de Fluxo VMC partilhada é suportado pela Ingram Vanderbilt Câncer Center (P30 CA68485) ea Digestive Disease Vanderbilt Research Center (P30 DK058404). Este trabalho foi financiado por recursos do EUA National Institutes of Health bolsas DK064251, DK086594 e DK070219.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Vendedor | Número de Catálogo | Comentários |
| Accumax | Sigma (MFR: Cell Technologies Inovadoras) | A7089-100ML | Armazenar congelados em alíquotas de 1 ml |
| DNase I | Sigma | D-4527 | Armazenadas congeladas a -20 ° C 5 mg / ml em 1xHBSS, (Usado em Têmpera, Têmpera 1:5) |
| PH 7,4 PBS 10X | Gibco | 70011-044 | Faça até 1x com água grau cultura de tecido, em seguida, filtro estéril |
| 10X HBSS w / o Ca ou Mg | Gibco | 14185-052 | Faça até 1x com água grau cultura de tecido, em seguida, filtro estéril |
| L-15 de Leibovitz médio | Gibco | 21083027 | |
| Penicilina / estreptomicina 100X | Gibco | 15140-133 | Loja aliquotadas a -20 ° C |
| BSA | Sigma | A3912-100G | Armazenar aliquotadas a -20 ° C, 100 mg / ml em água |
| BioWhittaker 1M HEPES em NaCl 0,85% | Lonza | 17-737E | |
| 38 mM Nitex membrana de náilon | Sefar América | 3-38/22 | Corte em quadrados ~ 3 cm. UV tratar durante a noite para esterilizar no capuz de cultura de tecidos. |
| 7-AAD | Invitrogen | A1310 | 1 mg / ml |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 tubos de poliestireno ml | Falcão | 352058 | |
| 15 ml tubos cónicos | Corning | 430790 | |
| Belas Pinças de dissecação | Belas instrumentos científicos | 11251-30 | Dumont # 5 forcep, Dumoxel, padrão ponta 0.1x0.06mm |
| Dissecando Colher | Belas instrumentos científicos | 10370-18 |
Referências
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados