A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الردود الكالسيوم في الخلايا العصبية التصوير GFP الموسومة تحت المهاد البصري من شرائح مخ الفأر
In This Article
Erratum Notice
Summary
في هذا البروتوكول، نقوم بتحديث التقدم الذي أحرز مؤخرا في كاليفورنيا التصوير 2 + الإشارات من الخلايا العصبية في GFP الموسومة شرائح أنسجة المخ باستخدام أحمر فلوري كاليفورنيا 2 + مؤشر صباغة.
Abstract
على الرغم من الزيادة الهائلة في معرفتنا عن الآليات الكامنة والترميز للمعلومات في الدماغ، والسؤال المركزي بشأن الخطوات الدقيقة الجزيئية فضلا عن نشاط الخلايا العصبية محددة في نواة متعددة الوظائف للمناطق الدماغ مثل منطقة ما تحت المهاد لا تزال قائمة. هذه المشكلة يتضمن تحديد المكونات الجزيئية المشاركة في تنظيم مختلف الاجهزة هرمون عصبي نقل الإشارة. من الكالسيوم داخل الخلايا ترتفع 2 + تلعب دورا هاما في تنظيم حساسية الخلايا العصبية، سواء على مستوى نقل الإشارة في مواقع ومتشابك.
ظهرت أدوات جديدة للمساعدة في تحديد الخلايا العصبية في الدماغ لا يحصى من الخلايا العصبية بالإعراب عن بروتين الفلورية الخضراء (GFP) تحت سيطرة المروج معينة. لرصد كل من المكان والزمان التحفيز التي يسببها الكالسيوم 2 + الردود في GFP الموسومة الخلايا العصبية، وهي منظمة غير الفلورية الخضراء كا 2 + ن مؤشر صبغلاستخدامها eeds. وبالإضافة إلى ذلك، المجهري متحد البؤر هو وسيلة مفضلة من الخلايا العصبية الفردية في التصوير شرائح الأنسجة بسبب قدرته على تصور الخلايا العصبية في الطائرات متميزة من عمق داخل الأنسجة والحد من خارج التركيز مضان. كا 2 + مؤشر ratiometric FURA-2 وقد استخدم في تركيبة مع GFP الموسومة الخلايا العصبية 1. ومع ذلك، هو متحمس الصبغة بواسطة ضوء (UV) فوق البنفسجية. أعاقت تكلفة من الليزر وعمق الاختراق محدودة الضوئية للضوء UV استخدامه في العديد من المختبرات. وعلاوة على ذلك، قد GFP مضان تتداخل مع الإشارات FURA-2 2. لذلك، قررنا استخدام أحمر فلوري الكالسيوم مؤشر + 2 صباغة. التحول السكتات ضخمة من FURA متعدد الألوان الحمراء يسمح تحليل مضان أحمر في تركيبة مع GFP باستخدام الطول الموجي الإثارة واحد. كان لدينا نتائج جيدة في السابق باستخدام FURA الحمراء في تركيبة مع GFP الموسومة الخلايا العصبية الشمية 3. يبدو أن بروتوكولات لشرائح الأنسجة للعمل حاسة الشم هكذلك qually في الخلايا العصبية طائي 4. FURA الحمراء يعتمد كا 2 + وأيضا الجمع بين التصوير بنجاح مع خلايا البنكرياس β-GFP الموسومة وGFP الموسومة المستقبلات في الخلايا أعرب HEK 5،6. A هوس القليل من FURA الحمراء هو أن كثافة مضان في 650 نانومتر يقلل مرة واحدة في مؤشر يربط الكالسيوم 7. ولذلك، فإن مضان من الخلايا العصبية يستريح مع انخفاض تركيز الكالسيوم + 2 لديه كثافة عالية نسبيا. تجدر الإشارة إلى أن الأحمر أخرى CA 2 +-مؤشر الأصباغ موجودة أو يتم تطويرها حاليا، التي قد تعطي نتائج أفضل أو تحسين في الخلايا العصبية المختلفة، ومناطق الدماغ.
Protocol
1. إعداد الحل وجل الاغاروز
- إعداد حل خارج الخلية وفقا للجدول مع الماء المقطر مزدوجة. وسوف تكون درجة الحموضة 7.3 ~ بعد 10 دقيقة مع تحريك كربوجين (95٪ O 2/5٪ CO 2)، والأسمولية 300 الميلي أسمول 8. إذا كنت بحاجة لأعلى الأسمولية، يمكن تعديلها بإضافة مزيد من السكر (1 ملي تساوي 1 الميلي أسمول). يتم تصفية حل مرتين باستخدام غشاء ميكرون 0،2 مرشح للقضاء على جزيئات الغبار والتلوث الجرثومي ممكن.
| اسم كاشف | الاختصار | مول. الوزن | اضرب. | شركة | القط. N ° |
| كلوريد الصوديوم | كلوريد الصوديوم | 58،44 ز / مول | 120 مم | VWR | 27810 |
| <الصوديوم كربونات الهيدروجين/ TD> | NaHCO 3 | 84،01 ز / مول | 25 ملم | ميرك | 106329 |
| البوتاسيوم كلوريد | بوكل | 74،55 ز / مول | 5 ملم | ميرك | 104936 |
| BES * | C 6 H 15 NO S 5 | 213،25 ز / مول | 5 ملم | سيجما | 14853 |
| كبريتات المغنيسيوم، اللامائية | MgSO 4 | 120،37 ز / مول | 1 ملم | سيجما | M7506 |
| كلوريد الكالسيوم ثنائي الماء | CaCl * 2H 2 O | 147،02 ز / مول | 1 ملم | ميرك | 102382 |
| D (+)-الجلوكوز مونوهيدرات | C 6 H 12 O 8 * H 2 O | 198،17 ز / مول | 10 ملي | ميرك | 108342 |
*N، N-مكرر (2-هيدروكسي إيثيل)-2-aminoethansulfonic حمض
- يتم تخزين الحل في 4 درجات مئوية، ولكن ينبغي تهوية مع كربوجين (95٪ O 2/5٪ CO 2) لمدة 10 دقيقة قبل الاستخدام.
- في هذا الوقت، أيضا بإعداد 1 سم 3 بنات من هلام أجار لتحقيق الاستقرار في المخ أثناء عملية القطع (راجع الخطوة 3). الأولى، ويحل 4٪ (W / V) أجار (سيغما) في الماء المقطر المزدوج عن طريق تسخين حل لحوالي 60 ° C. يتم صب ساخنة حل أجار حل في طبق بتري مربع إلى ارتفاع 1 سم. بعد التبريد وتصلب، وقطع جل أجار 4٪ إلى كتل من 1 سم 3. ويمكن تخزين هذه الكتل لمدة تصل إلى 4 أسابيع في C. ° 4
2. تشريح مخ الفأر
الرجاء التأكد من أن يتم تنفيذ جميع الإجراءات حيوانات التجارب وفقا للمبادئ التوجيهية التي وضعتها لجان الرفق بالحيوان من المؤسسات المعنية.
- قبل sacrificing الحيوان، تأكد من كتل هلام أجار تكون جاهزة للاستخدام.
- تخدير الماوس مع isoflurane (1-4٪ isoflurane في الأكسجين باستخدام المرذاذ الدقة لحوالي 1 دقيقة). من المهم لمنع الضرر نقص الأكسجة والعصبية لذلك. والعيب من isoflurane هي تكلفة الخدمات اللوجستية واستخدام التبخير الدقة. ويمكن لجرعة زائدة قاتلة في نظام مفتوح يكون بديلا، حيث سيتم التضحية الماوس. السلامة المهنية في هذه الحالة مصدر قلق خطير. يجب أن يكون isoflurane تنفيس مباشرة خارج الغرفة. ولذلك، ينبغي أن يتم تنفيذ جرعة زائدة في نظام مفتوح في غطاء الدخان الكيميائي.
- الموت ببطء الماوس بقطع الرأس بعد رصد عمق التخدير عن طريق اختبار رد الفعل القدم الخلفية. يتم تنفيذ هذا منعكس قرصة دواسة أو مخلب من معسر بحزم مخلب إصبع القدم أو الأصابع بين واحد للحصول على رد من الانسحاب الحيوان. الحيوان الذي يظهر رد الفعل ليست على مستوى العمليات الجراحية في التخدير وليس بالتأكيد فيدولة إلى الموت ببطء.
- بعد قطع الرأس، وقطع في فروة الرأس مع واحدة حافة razorblade مركزيا في الاتجاه السهمي، من عظم الجبهي لالناشزة والقذالي الخارجية. نقل اثنين من أجزاء فروة الرأس، الأولى في الفترة من نهاية الذيلية الإنسي الوحشي في اتجاه منقاري، أسفل، ثم في الاتجاه البطني (الشكل 1A-C).
- جعل اثنين الجانبي واحد قطع منقاري في ماغنوم الثقبة مع مقص الربيع الصغيرة (انظر لقطع اتجاه السهام السوداء المتقطعة في الشكل 1C). يلتصق بعناية من الجمجمة من mediocaudal لمنقاري الجانبي مع ملقط فظة (انظر الأسهم الرمادية واسعة في الشكل 1C). في الحيوانات الأكبر سنا قطع صغير في خياطة السهمي مفيد وضروري في كثير من الأحيان لتجنب طبقات القشرية من الدماغ ضارة.
- وينبغي في هذه اللحظة يمكن فصل العظام القذالي، والجداريين الجداري. إذا لا تزال موجودة، ينبغي الأم الجافية باستخدام ملقط إزالة بعناية لمنع الأضرار التي لحقت رعين في الخطوة التالية.
- يسلب العظام صدفي، والثقبة الغربالية الأمامية الجبهية و(1D الشكل).
- ويمكن الآن بسهولة الدماغ يمكن إزالتها باستخدام ملعقة ملعقة مقلوب الصغيرة، وقطع الأعصاب القحفية (الشكل 1E).
3. تشريح المخ تحت المهاد البصري الأقسام الاكليل من مخ الفأر
- وضع الدماغ على جانبها البطنية على سطح قطع مقاومة وإزالة المخيخ بشفرة الحلاقة حافة واحدة (الشكل 2A). وهذا السطح خفض مستقيم تكون أساسا لتركيب المخ على طبق من ذهب لتمكين تشريح الدماغ من المقاطع الاكليلية.
- الغراء الدماغ مع قسم قطع على اللوح الأساس لمشراح (زايس، الوبر V50) باستخدام كميات قليلة من علاج سريع عالية الأداء لاصقة superglue CYANOACRYLATE (406 LOCTITE؛ الشكل 1A). وبالإضافة إلى ذلك، الغراء على 1 سم 3 كتلة أجار هلام (انظر 1.5) في الجانب البطنية من الدماغ (انظر 'V' في الشكل 2B) على اللوح الأساس لمشراح (زايس، الوبر V50) لدعم وإصلاح الدماغ أثناء تقطيع. تأكد من عدم استخدام الغراء أكثر من اللازم، للتهرب من الغراء الذي يخترق الدماغ وبين كتلة هلام يسبب مشاكل في إزالة الأنسجة شرائح بعد خفض الانتاج. وسيكون مقر كتلة هلام في الجانب الآخر من شفرة قطع من مشراح (الشكل 2B).
- بعد بضع ثوان السند قد جفت، وضعت لوحة في حمام من مشراح الخاص مليئة 6 ° C الباردة الاوكسيجين (95٪ O 2/5٪ CO 2) حل خارج الخلية (انظر 1.1).
- استخدام السرعة المناسبة منخفضة تشريح وقطع 300 ميكرون شرائح سميكة. في حالة مشراح لدينا، ونحن نستخدم تردد 60 هرتز، وسعة 0.8 مم وسرعة 0.8 مم / ثانية (الشكل 2C). يتم جمع إما شرائح الدماغ الاكليلية مباشرة بعد كل جرح أو يمكن ترك في الحمام حتى الدماغ كله كان مقطوع. شرائح الدماغ الاكليلية وحوالة بعنايةrred إلى دورق مع حل الباردة خارج الخلية الاوكسيجين. وقد تم تصميم أدوات مختلفة لأداء نقل (مثل البلاستيك أو قطع واسعة ماصات باستور الزجاج أو ملعقة ملاعق واسعة). ذلك يعتمد على experimentator الذي يجري المفضل. والأهم من ذلك، ينبغي أن يتم التعامل معها بشكل مناسب لشرائح تقليل الضرر.
- إذا كان من الممكن برمجة مشراح لقطع شرائح تلقائيا، يمكنك البدء في إعداد المؤشر الكالسيوم + 2 صبغة الحل تحميل في هذه اللحظة. خلاف ذلك، فمن المستحسن أن يتم تنفيذ إعداد هذا الحل قبل تشريح الدماغ قد انتهت للحد من التأخير لقياس الكالسيوم 2 + الردود في الخلايا العصبية، أي قبل بدء الخطوة 2.
4. إعداد المؤشر الكالسيوم + 2 الحل تحميل صبغ
A خطوة حاسمة في الخلايا العصبية التحميل لا يزال في كثير من الأحيان على صحة الخلايا التي تعتمد على مقدار الضرر الناجم عن وسرعةتشريح الداخلي. آخر خطوة أساسية ويبدو أن استخدام بلورونيك جديدة F-127 حل (انظر 4.1). ويجري المستحسن لجعل هذا الحل في المختبر وعدم استخدام الحل ج ابحث من بائع. اعتمادا على درجة الحرارة والرطوبة ومدة صلاحية وبلورونيك F-127 حل، لاحظنا تدهور الخلايا العصبية الشمية والدماغ أثناء كا 2 + التحميل الداخلي.
- إعداد بلورونيك 20٪ (W / V) F-127 (سيجما) في ثنائي ميثيل سلفوكسيد (DMSO) عن طريق إضافة بلورونيك F-127 على رأس مسحوق من الحل DMSO. يصوتن مباشرة دون هذا الحل قبل دوامة أو الاختلاط. وضمن حد أدنى 2 صوتنة يتم حل بلورونيك F-127. يتم إعداد 100 ميكرولتر بلورونيك F-127 حلول الأسبوعية الطازجة.
- اتخاذ أنبوب واحد من 50 fura-red/AM خلية قابلة للاختراق ميكروغرام (إينفيتروجن؛ AM، استر acetoxymethyl) وإضافة 5 ميكرولتر بلورونيك 20٪ F-127 الحل. مزيج الحل باستخدام غيض من ماصة الخاص بك.
- إضافة 45 ميكرولتر soluti خارج الخليةعلى (انظر 1.1) إلى المزيج ودوامة قريبا.
- إضافة ميكرولتر 325 إضافية حل خارج الخلية ويصوتن الأنبوب لمدة 3 دقائق.
- بعد إضافة صوتنة 1،156 مل الاوكسيجين (95٪ O 2/5٪ CO 2) حل خارج الخلية للحصول على الكالسيوم النهائي الخاص بك 2 + التحميل صبغ المؤشر الحل (30 ميكرومتر fura-red/AM، DMSO 0.33٪ وبلورونيك 0،065٪ F-127) . تخزين أنبوب في مكان مظلم حتى استخدام (انظر 4.8).
- نقل شرائح الدماغ الاكليلية لوحة خلية ثقافة 6 جيدا (BD فالكون) مليئة الحل (95٪ O 2/5٪ CO 2) الاوكسيجين خارج الخلية (تصل إلى ستة شرائح لكل بئر).
- تمتص الاوكسيجين من الحل خارج الخلية من غرف من لوحة 6 جيدا مع الحرص على عدم الإضرار شرائح الدماغ.
- الماصة مباشرة 750 ميكرولتر من الكالسيوم مؤشر + 2 تحميل حل لصبغ كل جانب. ينبغي تغطية شرائح المخ من محلول يحتوي على fura-red/AM (تحميل الغمر).
- Incubatه الشرائح في O 2 / CO ثقافة الخلية 2 الحاضنة (O 2: 23.5٪؛ CO 2: 5٪) لمدة 45 إلى 60 دقيقة عند 37 ° C.
- في نهاية فترة حضانة، يستعاض عن مؤشر الكالسيوم + 2 صبغ حل التحميل من حل جديد خارج الخلية لمنع الحمولة الزائدة الاوكسيجين للخلايا الحمراء مع FURA والتأثير بطريقة خفية كا 2 + قياس عن طريق العمل مخلبية للصباغة. وبعد ذلك يتم الاحتفاظ شرائح في O 2 / CO 2 الحاضنة (انظر النقطة السابقة لإعدادات) حتى استخدام وقابلة للبقاء لمدة تصل إلى 3-6 ساعة.
5. والتحليل المجهري
في هذا البروتوكول، سيتم قياس كثافة مضان من GFP، الذي يحدد الخلية من الفائدة، والكالسيوم من 2 صبغ المؤشر + شرائح في وقت واحد في الدماغ. وبالتالي، ينبغي أن تكون مجهزة المجهر مبائر مع ليزر الصحيح والفلاتر وأنابيب مضخم سنتين إلى جمع emissi 2على الإشارات. ويمكن قياس GFP والتغير في كثافة مضان من FURA الحمراء باستخدام الطول الموجي الإثارة واحد من 488 نانومتر. ويمكن جمع الانبعاثات مضان من fluorophores باستخدام نانومتر 522/DF35 فلتر لتصفية وGFP طويلة لتمرير موجات أكبر من 600 نانومتر لFURA الحمراء.
- لبدء الرصد التحفيز الناجم عن التغييرات في إشارة مضان، والتي هي على قدر من الكالسيوم داخل الخلايا تركيز + 2، يتم نقل واحدة من شرائح FURA الحمراء المحملة الدماغ إلى غرفة تسجيل (أي ارنر أدوات RC-27 غرفة حمام مفتوح) يمكن تركيبه على أن الإعداد المجهر متحد البؤر (الشكل 3A، B).
- تأمين شريحة الدماغ مع القيثارة (الشكل 3C) لمنع شريحة للانتقال نظرا لسرعة نضح من الحل حمام (حل خارج الخلية الاوكسيجين، وانظر الخطوة 1.1). يتم إجراء القيثارة (حامل شريحة) من مجموعة موازية من خيوط النايلون (فصلها عن بعضها البعض من خلال مم 1 ~) موتر علىالفضة شكل U أو الإطار البلاتين. ينبغي أن درجة حرارة حمام الحل في هذه الخطوة ان تكون على الاقل درجة حرارة الغرفة. إذا كانت هناك حاجة ارتفاع درجات الحرارة، والرعاية المناسبة لابد من اتخاذها لمنع التكثيف على العدسات المجهر وحركة الطائرة من التركيز بسبب تحول أجزاء في المجهر.
- يروي شريحة لمدة 10 دقيقة مع حل خارج الخلية الاوكسيجين لإزالة أي فائض من خارج الخلية CA 2 + صبغ المؤشر. ينبغي تعديل معدل تدفق التروية إلى (نصائح بشأن نظام نضح المناسبة انظر 9) 100 ~ ميكرولتر / ثانية.
- إلقاء نظرة على شريحة المجهر من خلال تضخم منخفضة، وجعل علما اتجاه شريحة لسجلاتك وإيجاد اهتماماتك في شريحة، في حالتنا منطقة المهاد في الدماغ.
- تضخم عالية لتغيير والعثور على خلية من الاهتمام في شريحة من خلال جمع الصور والتحقق في وقت واحد GFP كثافة مضان من FURA الحمراءإشارة (الشكل 4A-C). يمكن أن تتضرر الخلايا قرب سطح أو ميتا. ولذلك، ينبغي تحديد خلايا تقع على عمق أكثر من 10 ميكرون للتصوير. بدأت whereafter قوة الإشارة يمكننا قياس موثوق الخلايا يصل إلى عمق من 40-50 ميكرون، في الانخفاض. تذكر أن الإشارة الحمراء FURA من الخلايا في بقية الكالسيوم مع انخفاض تركيز + 2 لديك النسبي شدة مضان عالية. هذا هو كثافة عالية مضان في هذه الحالة ليس دليلا على الخلايا الميتة. ويمكن استخدام إشارة GFP للكشف عن أي انحراف أو حركة أو شريحة الأنسجة كمؤشر للتغيرات في درجة الحموضة داخل الخلايا 10.
- ضبط قوة الليزر إلى قيمة القياسات يسمح في تغيير FURA الحمراء كثافة مضان ويمنع تبيض من fluorophores اثنين. لذلك، تبدأ مع السلطة أدنى الليزر وضبط للحصول على ما يكفي من الإشارات إلى نسبة الضوضاء عن طريق تغيير مستوى الأسود (الأوفست)، والفتحة كاشف، وزيادة كثافة الليزر وفلتر محايدةق. باستثناء قوة الليزر، ينبغي أن يتم الشيء نفسه بالنسبة للإشارة GFP.
- تبدأ في الحصول على صور بمعدلات بين 0،5 حتي 2 هرتز لجمع FURA الحمراء وإشارات GFP. وينبغي أن يكون الأمثل لاكتساب معدل المعدل المتوقع لكا 2 + الإشارة. الجهد التي تعتمد على الكالسيوم 2 + قد يسبب طفرات العابرين أسرع وأقصر من تفعيل بعض أجهزة الطرد المركزي التي تتطلب نقل الإشارة تفعيل مختلف المرسال الثاني. ينبغي أن طول الحصول على الصور من المناسب لغرض التجربة. وإشارة مرور الوقت GFP مساعدة تحديد ما إذا كان أي حركة شريحة الدماغ حدث.
- خلال اقتناء والتجربة، وجميع إعدادات المسح رئيس يتعين ثابتة لتسجيل نتائج موثوقة يمكن مقارنتها.
- ويمكن تحليل التغيرات في مضان بمرور الوقت باستخدام برامج رياضية مختلفة، أي يماغيج (NIH، بيثيسدا، MD، HTTP:/ / rsb.info.nih.gov / ط /) وايغور برو (Wavemetrics) أو ماتلاب (وماثووركس). من تطويق somata من الخلايا العصبيه GFP الموسومة تشير إلى المنطقة ذات الاهتمام (ROI)، يمكن تحليل هذه المنطقة بالضبط نفس لإجراء تغييرات في كاليفورنيا 2 + باستخدام إشارة مضان FURA الحمراء مع مرور الوقت.
ويمكن عرض كاليفورنيا 2 + إشارات وحدات مضان التعسفي أو كقيم (ΔF / F) من التغير النسبي في كثافة مضان (ΔF) إلى تطبيع مضان خط الأساس (F). هذه النتائج في إجراء انحراف سلبي عندما الخلايا CA 2 + يزيد من تركيز باستخدام FURA الحمراء كما كا ال 2 + صبغ المؤشر. للتخفيف من تفسير النتائج، نوصي ضرب القيم ΔF / F مع -1 إلى الحصول على إشارات إيجابية مضان لعرض ارتفاع الكالسيوم 2 + (الشكل 4C).
لمقارنة النتائج بين الخلايا العصبية في السعة والتردد من الكالسيوم 2 + إشارات. حتى الآن، بعض إشارات الكالسيوم + 2 لا تحدث مع فترة العادية أو سعة قابلة للمقارنة. قد تكون بعض الإشارات تتأثر بشدة العمليات العشوائية داخل الخلية. وهكذا، لتقدير تغير في مجموع الكالسيوم 2 + في خلية معينة، وتمكين المقارنة بين الكالسيوم 2 + الردود بين الخلايا العصبية في مناطق الدماغ المختلفة، وتحليل للمنطقة تحت منحنى و-(AUC) هو أكثر ملاءمة. هذا الإجراء لكمية الكالسيوم 2 + يشمل أي كا 2 + الأولي عابرة، المرحلتين الثانية ويستمر ارتفاع الكالسيوم 2 + الردود والتذبذبات. وينبغي في هذه الرعاية الحالة يجب اتخاذها لتحليل نفس الفترة الزمنية لتمكين المقارنة بين الخلايا العصبية.
6. ممثل النتائج
لبدء تميز مستقبلات هرمون موجهة الغدد التناسلية الإفراج عن (GnRHR) معربا عن الخلايا العصبية في منطقة ما تحت المهاد التي قطعناها على أنفسنا استخدام الفئران المعدلة وراثيا التي تعبر عن GFP بعد بوساطة لجنة المساواة العرقية exciسيون في GnRHR، معربا عن الخلايا العصبية 4،11. وقد تم تحديد الخلايا العصبية GFP الفلورية في مناطق الدماغ المختلفة، بما في ذلك ما تحت المهاد. للتحقيق في خصائص الفسيولوجية للGnRHR هذه الخلايا العصبية، ونحن سجلت أول كا 2 + إشارات في شرائح طائي باستخدام مجهر متحد البؤر. أولا، حصلنا على شرائح الدماغ الاكليلية من هذه الفئران باستخدام بروتوكول المبين أعلاه. ويبين الشكل 1 أدوات اللازمة والمواد والخطوات لاستئصال دماغ الفأر. تم قطع شرائح الدماغ الاكليلية طائي (الشكل 2) ومن ثم تحميلها وفقا للخطوات في النقطة 4 من البروتوكول. توضع شريحة واحدة الدماغ من منطقة مناسبة في غرفة التسجيل، مع تأمين القيثارة (الشكل 3) ومن ثم تصويرها باستخدام مجهر متحد البؤر (انظر الخطوات 5،1-5،9). ويبين الشكل 4 مثالا من اثنين من شرائح الدماغ الاكليلية الفردية تحديد واحد أجسام الخلايا GnRHR-τGFP، ومضان في الراحة بعد من التحميلز شريحة الدماغ مع fura-red/AM والصورة المدمجة مبائر تشير إلى أن الخلايا العصبية GFP اتخذوا FURA الحمراء بما فيه الكفاية لتمكين التحقيق من الحوافز التي يسببها الكالسيوم 2 + إشارات في هذه الخلايا. باستخدام بروتوكول لدينا ونحن في البداية اختبار ما إذا كانت الخلايا العصبية GnRHR الاستفادة مماثلة كا 2 + إشارات للكشف عن التحفيز في مناطق مختلفة من منطقة ما تحت المهاد استجابة لتفعيل مباشرة مع GnRH (4E الشكل). ومع ذلك، تختلف هذه الإشارات في الموجي بهم اعتمادا على قوة التحفيز والدماغ 4 المساحة. لقياس التغير في ديناميكية ردود الكالسيوم + 2، ومنطقة تحت منحنى--يمكن حساب (AUC) كإجراء لزيادة الكالسيوم داخل الخلايا 2 + (4E الشكل) 4. الدراسات التي تجرى حاليا للتحقيق في أساس الجزيئية الكامنة وراء موجات الكالسيوم + 2 والتذبذبات، والاعتماد على الجنس والحالة الهرمونية للحيوان، وما إذا كانت يمكن أن تكون التضمينمن المحفزات الطبيعية الأخرى.
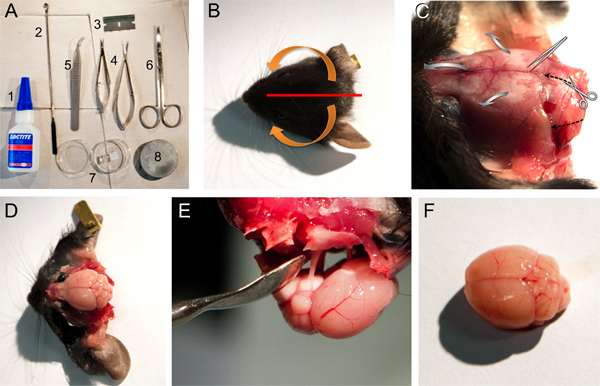
الشكل 1. أدوات ومواد والخطوات لاستئصال دماغ الفأر. A. الأدوات والمواد التي تستخدم في تشريح الدماغ: 1، 406 LOCTITE superglue، 2، ملعقة صغيرة ملعقة؛ 3، واحدة حافة شفرة حلاقة، 4، مقص الربيع الصغيرة والمتوسطة؛ 5، ملقط حادة؛ 6، مقص، 7، طبق بتري تحتوي آغار هلام كتلة و 8، لوحة للقاعدة الدماغ المتزايدة في مشراح. BF. صور لبعض الخطوات التي وصفها في النقطة 2 من البروتوكول. B. صورة لرئيس الماوس يشير إلى موضع القطع من فروة الرأس (خط أحمر) والسهام (البرتقال) تشير إلى اتجاه يجب أن يتم سحبها بعيدا عن الجلد والعظام (راجع الخطوة 2.4). C. صورة للرئيس الماوس بعد يتم سحبها بعيدا الجلد تظهر الهياكل العظمية (راجع الخطوة 2.4). قطع مقص اتجاه واتجاه لكسر الجمجمة مفتوحة مع ملقط حادة ويشار مع الأسود سواءمتقطع أو السهام السهام واسعة الرمادي، على التوالي. D. تصوير للدماغ الفأر بعد القضاء على الهياكل العظمية المختلفة (راجع الخطوة 2،5 حتي 2،7). E. صورة للإزالة من الدماغ لا تزال متصلة إلى الجمجمة عبر العصب القحفي. F. صورة لمخ الفأر غير التالفة نسبيا.

الشكل 2. تشريح أقسام طائي الاكليلية من مخ الفأر. A. تصوير تشير إلى موقف حافة شفرة حلاقة واحدة للقضاء على المخيخ (انظر الخطوة 3.1). B. موقف كتلة هلام أجار فيما يتعلق الدماغ لصقها على اللوح الأساس لمن مشراح (راجع الخطوة 3.2). C. قطع شريحة من الدماغ الاكليلية (لاحظ هنا موقع الدماغ ومواقف كتلة هلام فيما يتعلق شفرة قطع من مشراح، انظر الخطوة 3.4.). د، الظهرية، ت، بطني.

الشكل 3. شريحة الدماغ وضعه في غرفة تسجيل. A B.، نظرة عامة على (A) وارتفاع التكبير (B) من الآلات وارنر RC-27 مفتوحة حمام غرفة تسجيل وصول واسع مما يتيح للمناطق المهاد من الدماغ شريحة الاكليلية (راجع الخطوة 5.1). C. U على شكل القيثارة المعدنية التي تحتوي على صفوف متوازية من خيوط النايلون التي ستعقد في موقف شريحة في غرفة التسجيل (راجع الخطوة 5.2).
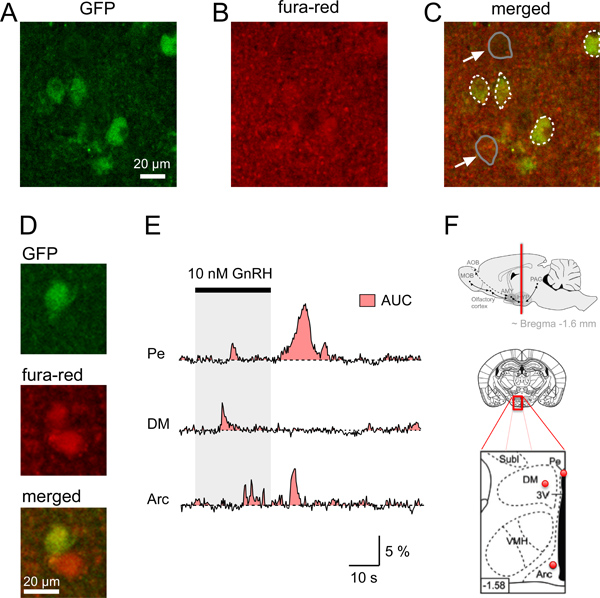
الشكل 4. كاليفورنيا 2 + إشارات في الخلايا العصبية τGFP من شرائح المخ تحت المهاد البصري الماوس. م. تحديد الخلايا العصبيه واكتساب GFP في وقت واحد من مضان FURA الحمراء في الاكليلية شرائح مخ الفأر. A. صورة متحد البؤر من شريحة الدماغ الاكليلية تحديد GnRHR-τGFP الخلايا العصبية (الخضراء). B. إشارة مضان موحدة نسبيا (الأحمر) من منطقة الدماغ هو موضح في A وحظ بعد تحميل شريحة الدماغ مع fura-red/AM. مدموجة C. صورة تظهر NEUrons صورت في صبغة محملة مؤشر CA 2 + (مصفر). يشار إلى حدود GFP الخلايا العصبية في خطوط بيضاء somata متقطع، في حين يشار إلى أمثلة من somata غير GFP اثنين (سهام) في خطوط رمادية. D. مثال لGFP والخلايا العصبية غير GFP مع كميات أكبر من مضان أحمر مقارنة الخلفية. أمثلة E. من التحفيز الجسدي الناجم عن الكالسيوم 2 + ردود من الخلايا العصبية GFP-الموسومة الفردية في مختلف مناطق المخ تحت المهاد البصري (PE، نواة حول البطينات الدماغية؛ DM، ظهراني إنسي المهاد؛ القوس، المقوس النواة). وصفت منطقة تحت منحنى الحركة و(AUC) من المنطقة الحمراء. المتميزة كا 2 + الإشارات بين الخلايا العصبية، معربا عن GnRHR من نوى المهاد مختلفة يمكن مقارنة باستخدام AUC كتقدير لمجموع التغير في كاليفورنيا 2 + في خلية معينة خلال نفس الفترة. F. رسومات الرسم التخطيطي وتشير إلى مكان وجود الخلايا العصبية GFP الموسومة تحليلها في أعالي AE الفريق بما يلي: مكان وجود دماغ الاكليليةection تحتوي على مناطق المخ تحت المهاد البصري (خط أحمر) الوسطى والسفلى لوحة: الرسم التخطيطي لشريحة الدماغ (وسط) والتكبير من مساحتها محاصر الأحمر (اللوحة السفلى) تشير إلى نقاط حمراء مع الموقف التقريبي للعصبونات مسجل GFP الموسومة من المؤسسة العامة، وقوس DM هو مبين في E؛ المنطقة السوداء في مخطط اللوحة السفلى: 3 ش البطين. يتم تكييفها مخططات اثنين من أقل Paxinos وفرانكلين 12. انخفاض عدد الزاوية اليسرى يشير إلى المسافة (ملم) من Bregma.
Discussion
والسؤال الكبير هو في علم الأعصاب لفهم كيفية عمل الدماغ بمعالجة المعلومات الاجتماعية. يتم ترميز مصدر الغالبة من المعلومات اللازمة للاعتراف الاجتماعي من خلال حاسة الشم أو إشارات pheromonal. الكشف عن هذه الإشارات العصبية من قبل السكان في الأنف والاعتراف الإشارات في الدماغ?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر زملائنا الذين شاركوا في أعمال تلخيص هنا. وأيد هذا العمل من المنح المقدمة من جمعية الألمانية للبحوث (SFB 894)، "تحليل التكاملية من الشم 'وSchwerpunktprogramm DFG 1392 وفولكس واجن من قبل مؤسسة (TLZ). TLZ أستاذ يشتنبرغ لمؤسسة فولكس واجن.
Materials
| Name | Company | Catalog Number | Comments |
| اسم | شركة | القط. N ° | |
| أجار | سيجما | A1296 | |
| Fura-red/AM | إينفيتروجن | F-3021 | |
| بلورونيك F-127 | سيجما | P2443 | |
| ثنائي ميثيل سلفوكسيد | فيشر العلمية | BP231 | |
| تهتز بليد مشراح الوبر V 50 | زايس | 9770170 | |
| CU جهاز التبريد 65 لمشراح الوبر V 50 | زايس | 9920120 | |
| O 2 / CO حاضنة 2، CB210-UL | غلاف | 0019389 | |
| سوبر الغراء، LOCTITE 406TM | هنكل | 142580 | |
| ضعف ملاعق، شكل ملعقة | Bochem | 3182 | |
| ملاعق Microspoon، شكل ملعقة | Bochem | 3344 | |
| مقص الربيع، موريا، Vannas-ولف - شفرات 7MM | أدوات العلوم الجميلة | 15370-52 | |
| مقص الربيع، Vannas - شفرات 3MM | أدوات العلوم الجميلة | 15000-00 | |
| فاغنر مقص | أدوات العلوم الجميلة | 14071-12 | |
| الملقط الطبية، دومون 7B | أدوات العلوم الجميلة | 11270-20 | |
| غرفة كبيرة مستطيلة حمام مفتوح (RC-27) | وارنر الصكوك | 64-0238 | |
| مبائر التألق BioRad مجهر 2100 | زايس | NA |
References
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved