このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
視床下部マウス脳スライスのGFPタグニューロンにおけるイメージングカルシウム応答
Erratum Notice
要約
このプロトコルでは、カルシウムイメージングの最近の進捗状況を更新 2 +信号 2 +指示薬色素。
要約
脳内の情報の符号化、正確な分子手順並びに視床下部が残っているとしての脳領域の多機能の核内の特定のニューロンの活動に関わる中心的な問題の根底にあるメカニズムについての我々の知識の巨大な増加にもかかわらず。この問題は、様々な神経ホルモンのシグナル伝達カスケードの調節に関与する分子成分の識別を含む。細胞内Ca 2 +の上昇は両方のシグナル伝達のレベルとシナプス部位で、神経細胞の感度を調節するのに重要な役割を果たしている。
新しいツールは、特定のプロモーターの制御下に緑色蛍光タンパク質(GFP)を発現させることにより、脳の神経細胞の無数のニューロンを特定するために浮上している。空間的にも時間的刺激によって誘発されるCa 2 +の GFPタグニューロン、非緑色蛍光Ca 2 +指示薬色素nの応答を監視するには使用するeeds。さらに、共焦点顕微鏡は、組織内の深さの異なる平面内のニューロンを可視化するとアウトフォーカスの蛍光を制限するために、その能力のために組織切片におけるイメージング個々のニューロンの好きな方法である。レシオメトリックのCa 2 +指示薬FURA-2は、GFPタグニューロン1と組み合わせて使用されています。しかし、染料は紫外線(UV)光によって励起される。レーザのコストおよびUV光の限られた光の浸透深さは、多くの研究室での使用を妨げた。また、GFP蛍光はFURA-2信号2と干渉する場合があります。したがって、私たちは赤い蛍光Ca 2 +指示薬色素を使用することを決めた。 FURA-赤の巨大なストロークシフトは単一の励起波長を用いて、GFPとの組み合わせで赤色蛍光の多色分析を可能にします。我々はGFPタグ嗅覚ニューロン3と組み合わせてFURA-赤を使用して以前に良好な結果を得た。嗅覚組織切片のためのプロトコルは、電子を動作するように見えたquallyよく視床下部ニューロン4インチのFura-赤基づくのCa 2 +イメージングにも成功し、膵β細胞とHEK細胞に発現し5,6 GFPタグ受容体GFPタグと組み合わせた。 FURA-赤の少し癖は、インジケータがカルシウム7をバインドした後650nmでの蛍光強度が減少することである。したがって、低Ca 2 +濃度と休息ニューロンの蛍光は、比較的高い強度を有している。それは注意すべきで、そのほかの赤のCa 2 +指示薬色素が存在しないか、現在開発されて、それはまた別のニューロンと脳領域におけるより良いまたは改善された結果を与えるかもしれない。
プロトコル
1。ソリューションおよびアガロースゲルの作製
- 再蒸留水を用いて表に従って細胞外溶液を準備します。 pHはcarbogen(95%O 2/5%CO 2)で、浸透圧300 mOsm 8で10分間通気後〜7.3となります。浸透圧が高いが必要な場合は、より多くのグルコース(1mmの1 mOsmに等しい)を加えることによって調整することができます。溶液は、ダスト粒子と考えられる細菌の汚染を除去するために0.2μmのメンブランフィルターを用いて二回フィルタリングされます。
| 試薬の名称 | 略称 | モル。重量 | コンク。 | 会社 | 猫。 N° |
| 塩化ナトリウム | NaClを | 58.44グラム/モル | 120mMの | VWR | 27810 |
| 炭酸水素ナトリウム | NaHCO 3を | 84.01グラム/モル | 25mMの | メルク | 106329 |
| 塩化カリウム | KClを | 74.55グラム/モル | 5mMの | メルク | 104936 |
| BES * | C 6 H 15 NO 5 S | 213.25グラム/モル | 5mMの | シグマ | 14853 |
| 無水硫酸マグネシウム、 | MgSO 4を | 120.37グラム/モル | 1mMの | シグマ | M7506 |
| 塩化カルシウム二水和物 | 塩化カルシウム* 2H 2 O | 147.02グラム/モル | 1mMの | メルク | 102382 |
| D(+) - グルコース一水和物 | C 6 H 12 O 8 * H 2 O | 198.17グラム/モル | 10mMの | メルク | 108342 |
*N、N-ビス(2 - ヒドロキシエチル)-2 - aminoethansulfonic酸
- 溶液を4℃で保存されていますが、使用前に10分間carbogen(95%O 2/5%CO 2)を通気しなければならない。
- この時、(ステップ3を参照)また、切断処置中に脳を安定させるために寒天ゲルの1cm 3ブロックを準備します。まず、約60に溶液を加熱することによって再蒸留水で4%(w / v)の寒天(Sigma社製)を溶解℃に温水溶解寒天溶液を1cmの高さに四角いペトリ皿に注がれています。冷却と硬化した後、4%寒天ゲルを1cm 3のブロックに切断される。これらのブロックは、4℃で4週間用に保存することができます
2。マウスの脳の解剖
すべての動物実験手順は、それぞれの機関の動物福祉委員会によって確立されたガイドラインに沿って行われていることを確認してください。
- SACR前動物をificing、寒天ゲルブロックを使用する準備ができていることを確認します。
- (約1分間精密気化器を用いた酸素でイソフルラン1〜4%)イソフルランでマウスを麻酔。低酸素症、したがって神経損傷を防止することが重要です。イソフルランの欠点は精度の気化器を使用した場合のコストと物流です。マウスを犠牲にすることになるので、開放系の致命的な過剰摂取は、代替可能性があります。職業上の安全は、このケースでは重大な関心事である。イソフルランは、直接部屋から出てガス抜きする必要があります。したがって、オープンシステムにおける過剰摂取は、化学ドラフトで実行する必要があります。
- 後足反射をテストすることによって、麻酔の深さを監視した後に断頭によりマウスを安楽死させる。このペダルや足ピンチ反射がしっかりと動物による撤退応答を誘発する一つの指の間に足や足の指をつまんで実行されます。反射を示す動物は麻酔の手術レベルではないと絶対にないで安楽死させる状態。
- 断頭後、前頭骨から外後頭隆起に、矢状方向に集中的に単一のエッジ黒人と頭皮を切った。次に下腹側方向に( 図1A-C)、吻側横方向における内側尾方端から最初、頭皮の二つの部分に移動します。
- 小さ な春のはさみと大後頭孔( 図1Cに方向を黒い破線の矢印を切断するために参照してください)の2つの側面と1吻側カットを行う。鈍鉗子( 図1Cに幅広い灰色の矢印を参照)と横吻側へmediocaudalから頭蓋オフ慎重に切断する。高齢の動物では矢状縫合の小さなカットが役に立つと脳の損傷皮質層を避けることがしばしば必要になります。
- この瞬間後頭部、壁間のと頭頂骨を切り離す必要があります。まだ存在している場合は、硬膜を注意深くBRへの損傷を防ぐためにピンセットを使って削除する必要がある次のステップでAIN。
- 側頭鱗骨、前篩骨と前頭孔( 図1D)を奪う。
- 脳は簡単に反転マイクロスプーンのヘラを使用しており、脳神経( 図1E)を切断除去することができる。
3。マウスの脳の冠状視床下部セクションのスライシング
- 抗切断面上に、その腹側に脳を置き、単一のエッジかみそりの刃( 図2A)と小脳を削除します。このまっすぐな切断面は、冠状脳切片のスライシング有効にするために板の上に脳を搭載するための基礎となります。
- 速硬化高 性能シアノアクリレート系接着剤瞬間接着剤(; 図1Aロックタイト406)の少量を使用して、ミクロトームのベースプレート(ツァイス、ハイラックスV50)の切断面との接着剤の脳を。さらに、接着剤脳の腹側で1cm 3寒天ゲルブロック(1.5参照)(の'v'を参照してください。 図2B)(ツァイス、ハイラックスV50)は、脳を支持し、修正することができます。脳とゲルブロックとの間に接着剤を横断、カット後に組織切片を除去する際に問題を引き起こすことを回避するために、あまりにも多くの接着剤を使用しないようにしてください。ゲルブロックはミクロトーム( 図2B)から切刃の反対側に配置されます。
- ボンドが乾いて数秒後に、で満たされてあなたのミクロトームの浴中にプレートを入れて6℃冷たい酸素(95%O 2/5%CO 2)の細胞外溶液(1.1参照)。
- 適切な低スライシング速度を使用し、厚さ300μmのスライスを切った。私たちのミクロトームのケースでは、60Hzの周波数、0.8ミリメートルと0.8ミリメートル/秒( 図2C)の速度の振幅を使用しています。冠状脳スライスがどちら各カットの直後に収集されるか、脳全体が区分されているまで、お風呂に残すことができる。冠状脳スライスを慎重transfeアール冷たい酸素細胞外溶液の入ったビーカーにrred。様々なツールは、転送( 例えば 、カット幅広いプラスチックまたはガラス製パスツールピペットまたは広いスプーンヘラ)を実行するように設計されています。それが好まれているexperimentatorに依存します。最も重要なのは、スライスが被害を最小限にするために適切に処理する必要があります。
- ミクロトームは自動的にスライスをカットするようにプログラムすることができる場合は、この時点でのCa 2 +指示薬色素ローディング溶液を調製し始めることができます。それ以外の場合は、スライス脳は、ステップ2を開始する前に、すなわち、神経細胞におけるCa 2 +応答を測定するための遅延を最小限にするために、終了する前にこの溶液の調製が行われることをお勧めします。
4。のCa 2 +指示薬色素ローディング溶液の調製
ニューロンを読み込むための重要なステップは、しばしばによって誘発される損害の額との速度に依存した細胞の健康状態のまま解剖手順。もう一つの重要なステップは、新鮮なプルロニックF-127溶液(4.1を参照)を使用すると思われる。それは実験室でこのソリューションを作るためにとベンダーからの既成のソリューションを使用しないことをお勧めされています。温度、湿度、プルロニックF-127溶液の貯蔵寿命に応じて、我々は、Ca 2 +ロード手順中に嗅覚と脳の神経細胞の劣化を指摘した。
- DMSO溶液の上プルロニックF-127の粉末を添加して、ジメチルスルホキシド(DMSO)中の20%(w / v)のプルロニックF-127(Sigma)を準備します。事前に直接またはボルテックス混合することなく、このソリューションを超音波洗浄します。 2分間の超音波処理内プルロニックF-127は解散いたします。 100μlのプルロニックF-127ソリューションは新鮮毎週用意されている。
- 50μgの細胞透過性fura-red/AM(インビトロジェン社、AM、アセトキシメチルエステル)の一つのチューブを取り、5μlの20%プルロニックF-127溶液を加える。あなたのピペットの先端を用いて溶液を混ぜる。
- 45μlの細胞外solutiを追加ミックスと渦まもなくそれに(1.1を参照)。
- 追加の325μlの細胞外溶液を加え、3分間チューブを超音波洗浄します。
- 超音波処理は、最終のCa 2 + 指示薬色素ローディング溶液 (30μMfura-red/AM、0.33%DMSO及び0.065パーセントプルロニックF-127)を取得するために1.156ミリリットル酸素(95%O 2/5%CO 2)の細胞外溶液を追加した後。使用するまで暗い場所にチューブを保管する(4.8を参照)。
- 酸素(95%O 2/5%CO 2)で細胞外溶液(ウェルあたり最大6つのスライス)を充填した6ウェル細胞培養プレート(BDファルコン)に冠状脳スライスを転送します。
- 脳スライスを損傷しないように注意しながら、6ウェルプレートのチャンバーから酸素を細胞外溶液を吸う。
- 直接ピペットで各ウェルへのCa 2 +指示薬色素のローディング溶液750μlを。脳切片をfura-red/AM(浸ローディング)を含有する溶液によってカバーされるべきである。
- Incubat37℃で45から60分間℃:;:O 2 / CO 2インキュベーター(5%CO 2、23.5パーセントのO 2)のeスライス
- インキュベーション時間の終わりには、フラ·赤で細胞を過負荷と色素のキレート作用を介して、微妙にCa 2 +の測定に影響を防止するために、新鮮な酸素を細胞外溶液でのCa 2 +指示薬色素のローディング溶液を交換してください。スライスは、次に使用するまでO 2 / CO 2インキュベーター(設定のための前のポイントを参照してください)に保存され、最大3から6時間までのために生存しているされています。
5。顕微鏡と分析
このプロトコルでは、目的の細胞を識別し、GFP、、のとCa 2 +指示薬色素の蛍光強度は、脳スライスで同時に測定されることになります。したがって、共焦点顕微鏡は、2 emissiを収集するために正しいレーザー、フィルターと2の光電子増倍管を装備する必要があります信号上。 GFPとフラ·赤の蛍光強度の変化を、488nmの単一の励起波長を用いて測定することができる。フルオロフォアからの発光蛍光はGFPとフラ赤のための600nmより長い波長用のロングパスフィルターのフィルター522/DF35 nmを使用して収集することができます。
- 細胞内Ca 2 +濃度の尺度である蛍光信号のモニタリング刺激による変化を開始するには、フラ·赤ロードされた脳スライスの1つは、記録室( すなわちワーナー·インスツルメンツのRC-27オープンバス商工会議所)に転送されますそれは共焦点顕微鏡のセットアップ( 図3A、B)の上に取り付けることができる。
- (;ステップ1.1を参照酸素細胞外液)浴溶液の灌流速度により移動するスライスを防止するためのハープ( 図3C)と脳切片を固定します。ハープ(スライスホルダー)に張らナイロンスレッドの並列配列(〜1ミリメートルによって互いに分離)により構成されているU字型の銀またはプラチナフレーム。この段階で浴溶液の温度は少なくとも室温でなければなりません。高い温度が必要な場合は、適切なケアは、顕微鏡レンズと顕微鏡の部品をシフトに起因する焦点面の動きに結露を防ぐために注意しなければならない。
- 細胞外Ca 2 +指示薬色素の任意の余剰酸素を除去する細胞外液で10分間のスライスを灌流する。灌流の流量は約100μL/秒(適切な灌流システムに関するヒントは9を参照)に調整する必要があります。
- 低倍率で顕微鏡を通してスライスを見て、自分の記録用のスライスの向きをメモしておくと、脳内の視床下部我々の場合には、スライスに興味のある分野を見つけてください。
- GFPの画像を収集すると同時に、フラ·赤の蛍光強度を確認することにより、高倍率に変更して、スライスへの関心のセルを見つける信号( 図4A-C)。表面近くの細胞が損傷しているか死んでいる可能性があります。したがって、10μm以上の深さに位置した細胞をイメージングするために選択されるべきである。我々は、確実に40から50ミクロンの深さまでの細胞を測定することができ、その後、信号強度が低下し始めた。低Ca 2 +濃度と安静時の細胞のフラ·赤の信号が相対的に高い蛍光強度を持っていることを忘れないでください。この高い蛍光強度は、このケースでは死んだ細胞の兆候ではない。 GFPシグナルは、組織切片のか、細胞内pH 10の変化の指標としてのドリフトや動きを検出するために用いることができる。
- FURA-赤色蛍光強度の変化の測定を可能にし、2つのフルオロフォアの退色防止する値にレーザーパワーを調整します。したがって、最低のレーザーパワーで開始し、黒レベル(オフセット)を変更することにより、十分な信号対雑音比を得るために調整し、検出器絞り、ゲイン、レーザー中性密度フィルターsである。レーザーパワーを除けば、同じことがGFPシグナルのために行われるべきである。
- 0.5の間にレートで画像を取得することからスタート - 2 HzがFURA-赤とGFPシグナルを収集する。取得率は、Ca 2 +シグナルの期待収益率を最適化する必要があります。電位依存性Ca 2 +のスパイクは、さまざまなセカンドメッセンジャーの活性化を必要とするいくつかのシグナル伝達カスケードの活性化よりも早く、短い過渡現象を引き起こす可能性があります。画像取得の長さは、実験の目的に適しています。時間の経過とともにGFPシグナルは、脳スライスの任意の動きが発生しているかどうかを判断するのに役立ちます。
- 買収と実験の間、すべての走査ヘッドの設定は、比較することができる信頼性の高い結果を記録するために一定に保たれなければならない。
- 、時間をかけて蛍光の変化は異なる数学のプログラム、 すなわち ImageJを(NIH、ベセスダ、MD使って分析することができ、HTTP:/ / rsb.info.nih.gov / IJ /)、イゴールプロ(WaveMetrics社)またはMATLAB(MathWorks社)。関心領域(ROI)を示すGFPタグニューロンの細胞体を取り囲むことにより、これとまったく同じ領域は、Ca 2の変化を分析することができます+時間をかけてフラ赤の蛍光シグナルを用いた。
Ca 2 +の信号は、任意の蛍光単位として、またはベースライン蛍光(F)に正規化蛍光強度(ΔF)の相対的な変化の値(ΔF/ F)として提示することができます。この手順では、負偏差の結果のCa 2 +指示薬としてFURA-赤を用いた細胞内Ca 2 +濃度が上昇する。結果の解釈を容易にするために、我々は、Ca 2 +( 図4C)の上昇を表示するように正の蛍光シグナルを得るために-1とΔF/ F値を乗じることをお勧めします。
ニューロンのCaの振幅と周波数の間で結果を比較する 2 +シグナルは、通常、分析されます。まだ、一部のCa 2 +シグナルは、通常の期間または同等の振幅で発生しません。幾つかのシグナルは強く、細胞内の確率過程に影響を受けている可能性があります。したがって、与えられたセル内のCa 2 +の変化量を定量化するために、さまざまな脳領域のニューロン間のCa 2 +応答の比較ができるようにするには、面積曲線下面積(AUC)の分析の方が適しています。 Ca 2 +の量のためにこの措置は+任意の初期Ca 2 +の一過性、第二フェーズを網羅し、高架のCa 2 +応答と振動を持続。この場合には注意がニューロン間の比較を可能にするため、同じ時間帯を分析するために取られるべきである。
6。代表的な結果
視床下部のニューロンを表現する性腺刺激ホルモン放出ホルモン受容体(GnRHR)を特徴付ける開始するには、我々は、Cre媒介EXCI後にGFPを発現するトランスジェニックマウスを利用したGnRHR発現ニューロン4,11でシオン。 GFP蛍光ニューロンは視床下部を含む様々な脳領域で同定された。これらGnRHRニューロンの生理学的特性を調べるために、我々は最初の共焦点顕微鏡を用いて視床下部スライスに+シグナルのCa 2を記録した 。まず、上述したプロトコルを使用して、これらのマウスから冠状脳スライスを取得しました。 図1は、マウス脳を切除するために必要なツール、材料と手順を示しています。コロナの視床下部の脳スライスはプロトコルのポイント4の手順に従ってカット( 図2)、次にロードされていました。適切な領域の単一の脳切片は、記録室に入れハープ( 図3)で固定した後(ステップ5.1から5.9を参照)を共焦点顕微鏡を用いて結像される。 図4は、単一の識別2個冠状脳スライスの例を示していますGnRHR-τGFP細胞体、Loadinの後の安静時に蛍光fura-red/AMとGFPニューロンが十分にこれらの細胞における刺激誘発Ca 2 +シグナルの調査を可能とするフラ·赤を取り上げたことを示しているマージされた共焦点画像とグラム脳スライス。我々のプロトコルを使用して、我々は最初にGnRHRニューロンはGnRHのとの直接活性化( 図4E)に応じて、視床下部のさまざまな分野で刺激検出のために類似したCa 2 +の信号を利用するかどうかを試験した。しかし、これらの信号は、刺激の強さと脳のエリア4に応じて、波形の形状が異なっていた。のCa 2 +応答のダイナミクスの変化を定量化するために、エリア曲線下面積(AUC)は、細胞内Ca 2 +( 図4E)4の増加のための尺度として計算することができます。研究は、現在のCa 2 +波や振動、セックスへの依存や動物のホルモン状態の根底にある分子的基礎を調査するために進められている、と彼らは変調することができるかどうか他の自然刺激による。
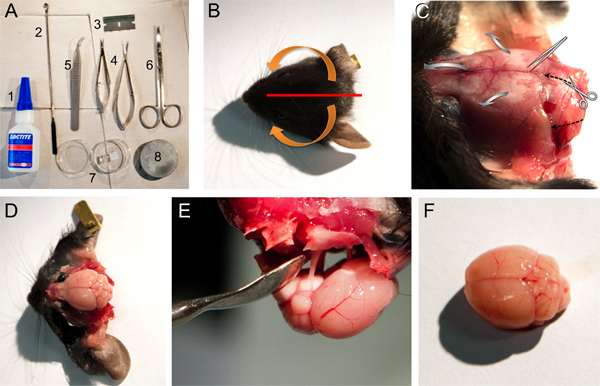
図1。マウス脳を切除するためのツール、材料と手順。A.脳の解剖に使用するツールと材料:1、ロックタイト406瞬間接着剤、2、マイクロスプーンのへら、3、単一のエッジかみそりの刃、4、中小春はさみ、5、鈍鉗子、6、ハサミ、7、寒天を含むペトリ皿ゲルブロック、8、ミクロトームに脳を取り付けるためのベースプレート。 BF。プロトコルのポイント2で説明されているいくつかのステップの画像。切削頭皮の位置(赤線)と皮膚には(ステップ2.4を参照)骨から引き離すべき方向を示す矢印(オレンジ)を示すマウスヘッドのBの写真。皮膚には(ステップ2.4を参照)骨構造を示す引き離された後、マウスの頭のC.写真。鈍鉗子で頭蓋骨を壊して開けるためのはさみや方向の向きを切断は黒のどちらかで示されますそれぞれ矢印または灰色の広い矢印を打ち砕いた。様々な骨の構造を排除した後、マウスの脳( - 2.7ステップ2.5を参照)のD.写真。脳の除去のE.写真はまだ脳神経を介して頭蓋骨に接続されています。比較的損傷を受けていないマウスの脳のF.写真。

図2。マウスの脳の冠状視床下部セクションのスライス。回答:小脳を除去するための単一のエッジかみそりの刃の位置を示す写真(ステップ3.1を参照)。ミクロトームのベースプレート上に接着脳との関係で寒天ゲルブロックのBの位置(ステップ3.2を参照)。冠状脳スライスのC.カット(ここでは、脳やミクロトームの切断刃に関してゲルブロック位置の位置を注意してください。、ステップ3.4を参照)。 dは、背側、V、腹。

図3。脳切片は、記録室に配置。、B.概要()と高倍率(B)は冠状脳スライスの視床下部領域(ステップ5.1を参照)への広範なアクセスを与えるワーナー·インスツルメンツのRC-27露天風呂記録室。 (ステップ5.2を参照)記録チャンバー内の位置でスライスを保持するナイロン糸のパラレル配列を含んでU字型の金属製のハープ。
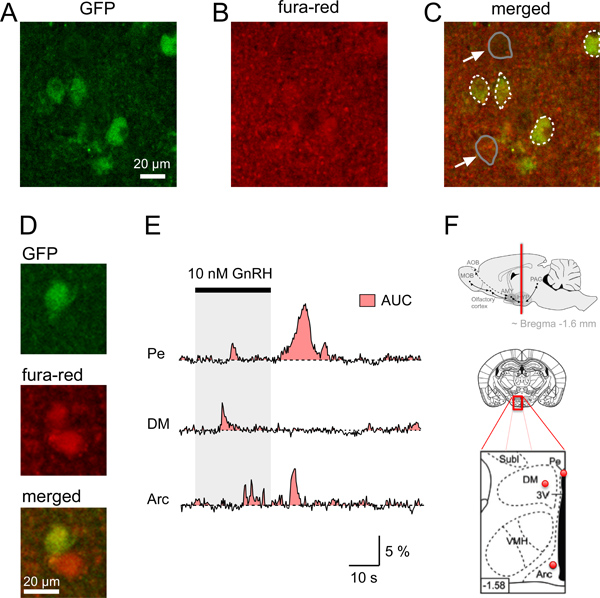
図4。マウス視床下部の脳スライスのτGFPニューロンにおけるCa 2 +シグナルの AD。 GFPのニューロンと冠状マウス脳スライスにおけるFURA-赤色蛍光の同時取得の同定。 GnRHR-τGFPニューロン( 緑 ) を識別する冠状脳スライスのAの共焦点画像。 B. fura-red/AM伴う脳スライスをロードした後に観察に示した脳領域の比較的均一な蛍光シグナル(赤)。 C.は神経を示す画像を合併ronsは、Ca 2 +指示薬色素( 黄 )でロードに示されている。 2非GFPの細胞体(矢印)の例はグレーの線で示されているのに対し、GFPニューロン細胞体の境界は、破線の白い線で示されている。背景に比べて赤色蛍光の高い金額を有するGFPおよび非GFPニューロンのD.例。体刺激誘発CaのE.例2 +さまざまな視床下部の脳領域のニューロンの個々のGFPタグからの応答(PE、脳室周囲核、DM、視床下部背内側、アーク、弓状核)。面積曲線下面積(AUC)は赤色の領域で示されている。異なる視床核からGnRHR発現ニューロンの間に明確なCa 2 +の信号は同じ期間に与えられた細胞内Ca 2の変化量の見積もり+としてAUCを使って比較することができます。 F.概略図面とAEで分析GFPタグニューロンの位置を示す図アッパーパネル :冠状脳sの場所視床下部の脳領域(赤線)を含むECTION 中部、下部パネル :脳切片( 中央 )と赤いドットでから記録されたGFPタグニューロンのおおよその位置を示す、赤い箱入りのエリアの倍率( 下のパネル )の模式図Eに示すPeのは、DMとアーク、下部パネル方式における黒領域:第3脳室。下2図はPaxinosとフランクリン12を適合させたものです。左下隅番号はブレグマからの距離(mm)を示します。
ディスカッション
神経科学の主要な問題は、脳が社会的な情報の処理方法を理解することです。社会的認識のために必要な情報の主なソースは、嗅覚やフェロモンの信号により符号化されている。神経鼻の集団、特に脳、視床下部における信号の認識によって、これらの信号の検出は、多くの社会的プロセスと影響ホルモンおよび他の神経内分泌因子13-16の重要な役割を果たしています。複数のニュー...
開示事項
特別な利害関係は宣言されません。
謝辞
私たちは作業に参加の仲間たちに感謝ここにまとめました。この作品は、ドイツ学術振興(SFB 894)、フォルクスワーゲン財団(TLZ)によるDFG Schwerpunktprogramm 1392 '嗅覚の統合解析 "からの補助金によって支えられている。 TLZは、フォルクスワーゲン財団のリヒテンベルグ教授です。
資料
| Name | Company | Catalog Number | Comments |
| 名前 | 会社 | 猫。 N° | |
| 寒天 | シグマ | A1296 | |
| Fura-red/AM | インビトロジェン | F-3021 | |
| プルロニックF-127 | シグマ | P2443 | |
| ジメチルスルホキシド | フィッシャー·サイエンティフィック | BP231 | |
| 振動刃ミクロトームハイラックスV 50 | ツァイス | 9770170 | |
| ミクロトームハイラックスV 50の冷却装置CU 65 | ツァイス | 9920120 | |
| O 2 / CO 2インキュベーター、CB210-UL | バインダー | 0019389 | |
| スーパー接着剤、ロックタイト406TM | ヘンケル | 142580 | |
| ダブルへら、スプーン形状 | Bochem | 3182 | |
| Microspoonのへら、スプーン形状 | Bochem | 3344 | |
| 春はさみ、モリア-Vannas·ウォルフ - 7ミリメートルブレード | ファイン科学ツール | 15370から52 | |
| 春のはさみ、Vannas - 3ミリメートルブレード | ファイン科学ツール | 15000から00 | |
| ワーグナーはさみ | ファイン科学ツール | 14071から12 | |
| 医療鉗子、デュモン7bは | ファイン科学ツール | 11270から20 | |
| 大きな長方形の露天風呂商工会議所(RC-27) | ワーナー·インスツルメンツ | 64から0238 | |
| 共焦点顕微鏡ラッドラディアンス2100 | ツァイス | NA |
参考文献
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved