È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Calcio Risposte imaging in neuroni GFP-tagged fette di cervello di topo ipotalamici
In questo articolo
Erratum Notice
Riepilogo
In questo protocollo, che aggiorniamo i recenti progressi nel campo dell'imaging Ca 2 + Segnali di neuroni GFP-tagged in fettine di tessuto cerebrale con un rosso fluorescente Ca 2 + Indicatore di colorante.
Abstract
Nonostante un aumento enorme nella nostra conoscenza dei meccanismi alla base della codifica delle informazioni nel cervello, una questione centrale relativa alle tappe precise molecolari così come l'attività dei neuroni specifici nuclei multi-funzionale delle aree cerebrali come l'ipotalamo rimangono. Questo problema si include l'identificazione dei componenti molecolari coinvolti nella regolazione delle cascate di trasduzione del segnale diverse neuro ormone. Elevazioni di Ca 2 + intracellulare svolgono un ruolo importante nella regolazione della sensibilità dei neuroni, sia a livello di trasduzione del segnale e nei siti sinaptici.
Sono emersi nuovi strumenti per identificare neuroni nel miriade di neuroni cerebrali esprimendo la proteina fluorescente verde (GFP) sotto il controllo di un promotore specifico. Per monitorare tempo e nello spazio stimolo-indotto di Ca 2 + risposte in GFP-tagged neuroni, un non-verde fluorescente Ca 2 + indicatore colorante nresponsabili politici da utilizzare. Inoltre, la microscopia confocale è un metodo preferito di neuroni immagini singole fette di tessuto a causa della sua capacità di visualizzare neuroni in diversi piani di profondità all'interno del tessuto e di limitare out-of-focus fluorescenza. Il raziometrico Ca 2 + indicatore fura-2 è stato usato in combinazione con GFP-tagged neuroni 1. Tuttavia, il colorante viene eccitato da raggi ultravioletti (UV). Il costo del laser e la limitata profondità di penetrazione della luce UV ottico ostacolato il suo uso in molti laboratori. Inoltre, fluorescenza GFP può interferire con le fura-2 segnali 2. Pertanto, abbiamo deciso di utilizzare un rosso fluorescente Ca 2 + indicatore colorante. L'enorme cambiamento Strokes di fura-rosso permette analisi multicolore della fluorescenza rossa in combinazione con GFP usando una singola lunghezza d'onda di eccitazione. Abbiamo avuto buoni risultati precedentemente con fura-rosso, in combinazione con GFP-tagged neuroni olfattivi 3. I protocolli di fettine di tessuto olfattivi sembrava funzionare equally bene in neuroni ipotalamici 4. Fura-rosso sulla base di Ca 2 + di imaging è successo anche in combinazione con GFP-tagged pancreatiche β-cellule e GFP-tagged recettori espressi in cellule HEK 5,6. Una peculiarità del piccolo fura-red è che la sua intensità di fluorescenza a 650 nm diminuisce per l'indicatore si lega calcio 7. Pertanto, la fluorescenza di neuroni di sosta con bassa concentrazione di Ca 2 + ha intensità relativamente elevata. Va notato, che gli altri rossi Ca 2 + indicatori di coloranti esistono o sono in fase di sviluppo, che potrebbe dare risultati migliori o migliorate di neuroni e aree cerebrali.
Protocollo
1. Preparazione della soluzione e gel di agarosio
- Preparare la soluzione extracellulare secondo la tabella con acqua bidistillata. Il pH sarà ~ 7,3 dopo 10 min con aerazione carbogeno (95% O 2/5% CO 2), l'osmolarità 300 mOsm 8. Se una osmolarità superiore è necessario, esso può essere regolato aggiungendo più glucosio (1 mM mOsm uguale a 1). La soluzione viene filtrata due volte usando un filtro a membrana 0,2 micron per eliminare particelle di polvere e possibili contaminazioni batteriche.
| Nome del reagente | Abbreviazione | Mol. peso | Conc.. | Azienda | Cat. N ° |
| Cloruro di sodio | NaCl | 58,44 g / mol | 120 mM | VWR | 27810 |
| Di sodio idrogeno | NaHCO 3 | 84,01 g / mol | 25 mM | Merck | 106329 |
| Cloruro di potassio | KCl | 74,55 g / mol | 5 mM | Merck | 104936 |
| BES * | C 6 H 15 NO 5 S | 213,25 g / mol | 5 mM | Sigma | 14853 |
| Magnesio solfato, anidro | MgSO4 | 120,37 g / mol | 1 mM | Sigma | M7506 |
| Cloruro di calcio diidrato | CaCl * 2H 2 O | 147,02 g / mol | 1 mM | Merck | 102382 |
| D (+)-glucosio monoidrato | C 6 H 12 O 8 * H 2 O | 198,17 g / mol | 10 mM | Merck | 108342 |
*N, N-Bis (2-idrossietil)-2-acido aminoethansulfonic
- La soluzione viene conservata a 4 ° C, ma deve essere aerato con carbogeno (95% O 2/5% CO 2) per 10 minuti prima dell'uso.
- In questo momento, preparare anche 1 cm 3 blocchi di gel di agar per stabilizzare il cervello durante la procedura di taglio (vedi punto 3). Primo, sciogliere 4% (w / v) agar (Sigma) in acqua bidistillata riscaldando la soluzione a circa 60 ° C. La soluzione riscaldata agar disciolto viene versata in una capsula Petri quadrato ad un'altezza di 1 cm. Dopo raffreddamento e indurimento, il gel di agar 4% viene tagliato in blocchi di 1 cm 3. Questi blocchi possono essere conservati per un massimo di 4 settimane a 4 ° C.
2. Dissezione del cervello di topo
Assicurarsi che tutte le procedure sperimentali su animali sono eseguiti in conformità con le linee guida stabilite dai comitati al benessere degli animali delle rispettive istituzioni.
- Prima Sacrificing l'animale, assicurarsi che i blocchi di agar gel sono pronti per l'uso.
- Anestetizzare il mouse con isoflurano (1-4% isoflurano in ossigeno utilizzando un vaporizzatore di precisione per circa 1 min). È importante per evitare danni ipossia e quindi neuronale. Uno svantaggio di isoflurano è il costo e la logistica di utilizzare vaporizzatori precisione. Una overdose fatale in un sistema aperto, potrebbe essere un'alternativa, dal momento che il mouse saranno sacrificati. Sicurezza del lavoro in questo caso è un problema serio. L'isoflurano deve essere direttamente scaricata fuori dalla stanza. Pertanto, un sovradosaggio in un sistema aperto deve essere eseguita in una cappa.
- Eutanasia il mouse per decapitazione dopo monitoraggio della profondità dell'anestesia testando il riflesso posteriore del piede. Questo pinch pedale o zampa riflesso viene eseguita da pizzicare saldamente una zampa o del piede tra le dita per provocare una risposta ritiro dell'animale. Un animale che mostra un riflesso non è a un livello di anestesia chirurgica e non certamenteuno stato di eutanasia.
- Dopo la decapitazione, tagliare il cuoio capelluto con una lametta singolo bordo centrale in direzione sagittale, dall'osso frontale alla protuberanza occipitale esterna. Spostare le due parti del cuoio capelluto, prima della fine mediale caudale in rostrale direzione laterale, poi giù in direzione ventrale (Figura 1A-C).
- Fare due laterali e un taglio rostrale nel foro occipitale con una forbice piccola molla (vedi per tagliare direzione delle frecce nere tratteggiate in Figura 1C). Fendere con cautela fuori dal cranio da mediocaudal a rostrale laterale con una pinza contundenti (vedi grandi frecce grigie nella Figura 1C). Nei vecchi animali un piccolo taglio alla sutura sagittale è utile e spesso necessario per evitare di danneggiare gli strati corticali del cervello.
- In questo momento le ossa occipitale, parietale e interparietale deve essere staccato. Se persiste, la dura madre deve essere attentamente rimossi con pinze per evitare di danneggiare il brain nella fase successiva.
- Togliete l'osso squamoso, il forame etmoidale anteriore e frontale (Figura 1D).
- Il cervello può essere facilmente rimosse con una spatola rovesciata cucchiaio micro e recidere i nervi cranici (Figura 1E).
3. Affettare Sezioni coronali ipotalamica del cervello di topo
- Posizionare il cervello sul suo lato ventrale su un taglio superficie resistente e rimuovere il cervelletto con singola lama di rasoio bordo (Figura 2A). Questa superficie taglio dritto sarà la base per il montaggio del cervello su una piastra per consentire di tagliare sezioni cerebrali coronali.
- Incollare il cervello con la sezione di taglio sulla piastra di base del microtomo (Zeiss, Hyrax V50) usando piccole quantità di un veloce indurimento adesivo ad alta prestazioni colla cianoacrilato (Loctite 406; Figura 1A). Inoltre, colla di cm 1 3 blocco gel di agar (vedere 1.5) sul lato ventrale del cervello (vedi 'v' in Figura 2B) sulla piastra di base del microtomo (Zeiss, Hyrax V50) per sostenere e fissare il cervello mentre taglio. Assicurarsi di non utilizzare la colla troppo, per evitare che le attraversa colla tra il cervello e il blocco di gel causando problemi nella rimozione di fettine di tessuto dopo il taglio. Il blocco gel sarà situato sul lato opposto della lama dal microtomo (Figura 2B).
- Dopo alcuni secondi il legame si è asciugata, mettere il piatto nel bagno del microtomo pieno di 6 ° C a freddo ossigenata (95% O 2/5% di CO 2) soluzione extracellulare (vedere 1.1).
- Utilizzare adeguati bassa velocità affettare e tagliare fette 300 micron di spessore. Nel caso del nostro microtomo, usiamo una frequenza di 60 Hz, un'ampiezza di 0,8 mm ed una velocità di 0,8 mm / s (Figura 2C). Le fettine cerebrali coronali sono raccolti direttamente o dopo ogni taglio o può essere lasciato nel bagno fino a tutto il cervello è stato sezionato. Le fette coronali del cervello sono accuratamente transfecui fa riferimento il un bicchiere freddo con soluzione ossigenata extracellulare. Vari strumenti sono stati progettati per eseguire il trasferimento (ad esempio taglio di plastica o di vetro ampio pipette Pasteur o spatole cucchiaio di massima). Dipende dalla sperimentatore che viene preferito. La cosa più importante, le fette devono essere gestiti in modo adeguato per ridurre al minimo i danni.
- Se il microtomo può essere programmato per tagliare fette automaticamente, si può iniziare a preparare il Ca 2 + soluzione colorante indicatore di carico in questo momento. Altrimenti, si raccomanda che la preparazione di questa soluzione viene eseguita prima che il cervello affettamento ha finito per ridurre i ritardi per misurare risposte Ca 2 + nei neuroni, cioè prima di iniziare la fase 2.
4. Preparazione della Soluzione 2 Indicatore di Ca + Loading Dye
Un punto critico in neuroni carico rimane spesso la salute delle cellule, che dipende dalla quantità di danno indotto da e la velocità dila procedura di dissezione. Un altro passo fondamentale sembra essere l'uso di Pluronic fresco F-127 soluzione (vedere 4.1). Viene consigliato di fare questa soluzione in laboratorio e non utilizzare una soluzione premade da un fornitore. A seconda della temperatura, l'umidità e la durata di conservazione del Pluronic F-127 soluzione, abbiamo notato degradazione dei neuroni olfattivi e cervello durante il Ca 2 + procedura di caricamento.
- Preparare il 20% (w / v) Pluronic F-127 (Sigma) in dimetilsolfossido (DMSO) aggiungendo la Pluronic F-127 polvere sulla superficie della soluzione DMSO. Direttamente da sonicazione questa soluzione senza vortice preventiva o di miscelazione. Entro 2 minuti, la sonicazione Pluronic F-127 sarà sciolta. 100 microlitri Pluronic F-127 soluzioni vengono preparate fresche settimanale.
- Prendete un tubo di 50 mg cellula permeabile fura-red/AM (Invitrogen, AM, acetossimetil estere) e aggiungere 5 Pluronic pl 20% F-127 soluzione. Mescolare la soluzione con la punta della pipetta.
- Aggiungere 45 microlitri soluzione molto extracellulare(vedere 1.1) per il mix e vortice è breve.
- Aggiungi un ulteriore 325 ul di soluzione extracellulare e sonicare il tubo per 3 min.
- Dopo sonicazione aggiungere 1,156 ml ossigenata (95% O 2/5% di CO 2) soluzione extracellulare per ottenere il finale Ca 2 + indicatore di soluzione colorante di caricamento (30 fura-red/AM mM, 0,33% DMSO e 0,065% Pluronic F-127) . Conservare il tubo in un luogo oscuro, finché l'uso (vedere paragrafo 4.8).
- Trasferire le fettine cerebrali coronali ad un piastra da 6 pozzetti di coltura cellulare (BD Falcon) riempito con ossigenata (95% O 2/5% CO 2) soluzione extracellulare (fino a sei fette per pozzetto).
- Aspirare la soluzione ossigenata extracellulare dalle camere della piastra da 6 pozzetti facendo attenzione a non danneggiare le fettine di cervello.
- Pipettare direttamente 750 microlitri della soluzione di Ca 2 Indicatore di carico + colorante per ogni bene. Le fettine di cervello dovrebbero essere coperti dalla soluzione contenente fura-red/AM (carico immersione).
- Incubatposta le fette in un O 2 / CO 2 incubatore per colture cellulari (O 2: 23,5%; CO 2: 5%) per 45 a 60 min a 37 ° C.
- Alla fine del periodo di incubazione, sostituire il Ca 2 + soluzione colorante indicatore loading dalla soluzione fresca ossigenata extracellulare per evitare di sovraccaricare le cellule con fura-rosso e influenzare in modo sottile il Ca 2 + misurazione tramite l'azione chelante del colorante. Le fette vengono poi tenuti in O 2 / CO 2 incubatore (vedi punto precedente per le impostazioni), fino al momento dell'uso e sono vitali per un massimo di 3-6 ore.
5. Microscopia e analisi
In questo protocollo, l'intensità di fluorescenza di GFP, che identifica la cella di interesse e del Ca 2 + colorante indicatore saranno misurati simultaneamente in fettine cerebrali. Così, il microscopio confocale deve essere equipaggiato con il laser corretta, filtri e due tubi fotomoltiplicatori per raccogliere i due emissisu segnali. GFP e la variazione di intensità di fluorescenza di fura-rosso può essere misurata usando una singola lunghezza d'onda di eccitazione di 488 nm. Fluorescenza di emissione dai fluorofori possono essere raccolti utilizzando un 522/DF35 nm filtro per GFP e una lunga filtro passa-per lunghezze d'onda superiori a 600 nm per il fura-rosso.
- Per avviare il monitoraggio di stimolo-indotte nel segnale di fluorescenza, che sono una misura della concentrazione intracellulare di Ca 2 +, uno dei fura-rosso fettine di cervello caricati verrà trasferito in una camera di registrazione (ad esempio Warner Instruments RC-27 Sezione Open Bath) che può essere montato sulla configurazione microscopio confocale (Figura 3A, B).
- Fissare la fetta cervello con un arpa (Figura 3C) per evitare che la fetta di muoversi a causa della velocità di perfusione della soluzione del bagno (ossigenata soluzione extracellulare, vedi passo 1.1). L'arpa (titolare slice) è realizzato in un array parallelo di fili di nylon (separate l'una dall'altra da ~ 1 mm) infilate suun argento forma di U o telaio platino. La temperatura della soluzione del bagno a questo punto dovrebbe essere almeno di temperatura ambiente. Se sono necessarie temperature più elevate, le cure adeguate deve essere presa per evitare la condensa sulle lenti del microscopio e il movimento del piano di messa a fuoco a causa di spostamento di componenti del microscopio.
- Perfusione la fetta per 10 minuti con una soluzione ossigenata extracellulare per rimuovere qualsiasi eccesso di extracellulare Ca 2 + indicatore colorante. La portata della perfusione deve essere regolata per ~ 100 (suggerimenti per quanto riguarda un sistema di perfusione adeguata vedi 9) pl / s.
- Guarda la fetta attraverso il microscopio a basso ingrandimento, prendere nota dell'orientamento della fetta per il proprio archivio e trovare l'area di interesse nella fetta, nel nostro caso l'area ipotalamica del cervello.
- Cambiare ingrandimento e trovare la cella di interesse nella fetta raccogliendo immagini GFP e contemporaneamente controllare l'intensità di fluorescenza della fura-rossosegnale (Figure 4A-C). Le cellule vicino alla superficie potrebbe essere danneggiato o morto. Pertanto, cellule situate ad una profondità superiore a 10 um dovrebbe essere selezionato per l'imaging. Potremmo attendibilmente valutare cellule fino ad una profondità di 40-50 micron, dopodiché il segnale iniziato a calare. Ricordate che il fura-rosso segnale delle cellule a riposo con una bassa concentrazione di Ca 2 + sono relativamente alte intensità di fluorescenza. Questa alta intensità di fluorescenza è in questo caso non è un segno di cellule morte. Il segnale GFP può essere utilizzato per rilevare qualsiasi deriva o movimento della fetta tessuto o come indicatore per le variazioni di pH intracellulare 10.
- Regolare la potenza del laser ad un valore che consente misurazioni del cambiamento di fura-rosso intensità di fluorescenza e impedisce sbiancamento dei due fluorofori. Quindi, iniziare con la minore potenza del laser e regolare per ottenere un sufficiente rapporto segnale-rumore cambiando il livello del nero (offset), l'apertura del rivelatore, il guadagno e filtro a densità neutra lasers. Fatta eccezione per la potenza del laser, lo stesso dovrebbe essere fatto per il segnale GFP.
- Avvio di acquisire immagini a prezzi tra 0,5 - 2 Hz per raccogliere il fura-rosso e segnali GFP. La rata di acquisizione dovrebbe essere ottimizzato per il tasso atteso del Ca 2 + segnale. Voltaggio-dipendenti del Ca 2 + può causare picchi transitori più rapidi e più brevi di attivazione di cascate di trasduzione del segnale di alcuni che richiedono l'attivazione di vari secondi messaggeri. La lunghezza dell'acquisizione dell'immagine deve essere adeguato allo scopo dell'esperimento. Il segnale GFP nel tempo sarà possibile stabilire se ogni movimento della fetta cervello è verificato.
- Durante l'acquisizione e l'esperimento, tutte le impostazioni di testa di scansione deve essere mantenuta costante per registrare risultati attendibili che possono essere comparati.
- Le variazioni nella fluorescenza nel tempo possono essere analizzati utilizzando diversi programmi matematici, cioè ImageJ (NIH, Bethesda, MD; http:/ / Rsb.info.nih.gov / IJ /), Igor Pro (Wavemetrics) o Matlab (The MathWorks). Circondando la somata di una GFP-etichettato neurone indica la regione di interesse (ROI), questa regione esattamente lo stesso può essere analizzata per variazioni Ca 2 + utilizzando il fura-rosso segnale di fluorescenza nel tempo.
Ca 2 + segnali possono essere presentate come unità arbitrarie fluorescenza o come valori (Af / F) della variazione relativa intensità di fluorescenza (Af) normalizzati alla fluorescenza di linea di base (F). Questo procedimento in una deflessione negativa quando i intracellulari Ca 2 + aumenta la concentrazione con fura-rosso come indicatore 2 Ca + colorante. Per facilitare l'interpretazione dei risultati, si consiglia di moltiplicare le Af / F valori con -1 per ottenere positivi segnali di fluorescenza per visualizzare un aumento del Ca 2 + (Figura 4C).
Per confrontare i risultati tra i neuroni l'ampiezza e la frequenza della Ca 2 + segnali vengono analizzati. Tuttavia, alcuni segnali + Ca 2 non si verificano con un periodo normale o ampiezze comparabili. Alcuni segnali possono essere fortemente influenzate dai processi stocastici all'interno della cellula. Così, per quantificare la variazione totale di Ca 2 + in una determinata casella e per consentire un confronto di Ca 2 + risposte tra neuroni in differenti regioni del cervello, l'analisi della area sotto la curva (AUC) è più appropriato. Questa misura per la quantità di Ca 2 + comprende qualsiasi iniziale Ca 2 + transitori, seconde fasi e sostenuto elevati Ca 2 + risposte e oscillazioni. In questo caso la cura deve essere presa per analizzare lo stesso periodo di tempo per consentire il confronto tra i neuroni.
6. Risultati rappresentativi
Per avviare la caratterizzazione del recettore dell'ormone di rilascio delle gonadotropine (GnRHR) che esprime i neuroni nell'ipotalamo abbiamo fatto uso di topi transgenici che esprimono GFP dopo Cre-mediata escissionesione in GnRHR esprimenti neuroni 4,11. GFP neuroni fluorescenti sono stati identificati in varie aree cerebrali, tra l'ipotalamo. Per studiare le proprietà fisiologiche di questi neuroni GnRHR, per prima cosa registrato Ca 2 + segnali in fette ipotalamici utilizzando un microscopio confocale. Prima, abbiamo ottenuto fettine cerebrali coronali da questi topi usando il protocollo descritto sopra. Figura 1 illustra la necessaria strumenti, materiale e passaggi per asportare un cervello di topo. Le fette coronali del cervello ipotalamici sono stati tagliati (Figura 2) e poi caricato in base alla procedura di cui al punto 4 del protocollo. Fetta cervello unico dell'area appropriate sono posti in una camera di registrazione, fissato con un arpa (Figura 3) e poi ripreso con un microscopio confocale (vedi fasi 5,1-5,9). Figura 4 mostra un esempio di due singole sezioni coronali di cervello di identificazione unico GnRHR-τGFP corpi cellulari, la fluorescenza a riposo dopo loading la fetta cervello con fura-red/AM e l'immagine unita confocale indicando che il neurone GFP aveva preso fura-rosso sufficientemente per consentire indagini di stimolo indotto Ca 2 + segnali in queste cellule. Usando il nostro protocollo abbiamo testato se inizialmente neuroni GnRHR utilizzare simili Ca 2 + segnali per la rilevazione stimolo in diverse zone dell'ipotalamo in risposta all'attivazione diretta con GnRH (figura 4E). Tuttavia, questi segnali hanno diversamente waveform seconda forza stimolo e la zona 4 del cervello. Per quantificare la variazione dinamica delle risposte Ca 2 +, l'area sotto la curva (AUC) può essere calcolata come misura per l'aumento intracellulare di Ca 2 + (Figura 4E) 4. Gli studi sono attualmente in corso per indagare le basi molecolari alla base delle 2 onde + Ca e oscillazioni, la loro dipendenza da sesso e lo stato ormonale dell'animale, e se possono essere modulatada altri stimoli naturali.
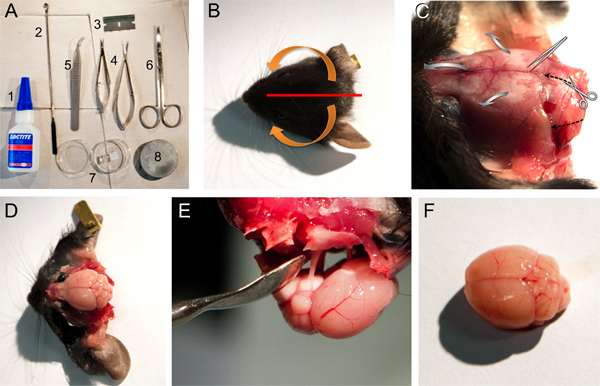
Figura 1. Strumenti, materiali e le operazioni necessarie per l'escissione di un cervello di topo. A. Strumenti e materiali utilizzati per la dissezione del cervello: 1, Loctite 406 supercolla, 2, spatola, cucchiaio, micro, 3, lama ad archetto, 4, forbici a molla piccole e medie imprese, 5, pinze contundenti, 6, 7, forbici, capsula di Petri contenente agar gel di blocco, 8, piastra di base per il cervello il montaggio in microtomo. BF. Immagini di alcuni passaggi che vengono descritti al punto 2 del protocollo. Fotografia B. di una testa del mouse che indica la posizione di taglio del cuoio capelluto (linea rossa) e le frecce (arancione) che indicano la direzione della pelle deve essere tirato e rimosso dalle ossa (vedi punto 2.4). Fotografia C. della testa del mouse dopo che la pelle è tirata via che mostra le strutture ossee (vedi passo 2.4). Direzione di taglio a forbice e la direzione per rompere aperto il cranio con la pinza smussati è indicato sia con il nerotratteggiato frecce o grigio frecce larghe, rispettivamente. Fotografia D. del cervello di topo dopo aver eliminato le strutture ossee varie (vedi passo 2,5-2,7). Fotografia E. della rimozione del cervello ancora collegato al cranio tramite i nervi cranici. Fotografia F. di un cervello di topo relativamente intatto.

Figura 2. Affettare di sezioni coronali ipotalamica del cervello di topo. A. Fotografare indicante la posizione della singola lama di rasoio bordo per eliminare il cervelletto (vedi passo 3.1). B. Posizione del blocco gel di agar in relazione al cervello incollato sulla piastra di base del microtomo (v. punto 3.2). C. Taglio della fetta cervello coronale (notare la posizione del cervello e le posizioni di blocco di gel per quanto riguarda la lama di taglio del microtomo, vedere il punto 3.4.). d, dorsale, v, ventrale.

Figura 3. Fetta cervello posizionato in camera di registrazione. A, B. Panoramica (A) e più alto ingrandimento (B) di un Warner Instruments RC-27 camera aperta registrazione bagno dà ampio accesso alle aree ipotalamiche della fetta cervello coronale (vedi punto 5.1). Metallo arpa C. a forma di U contenente matrici parallele di fili di nylon che detengono la fetta in posizione nella camera di registrazione (vedi punto 5.2).
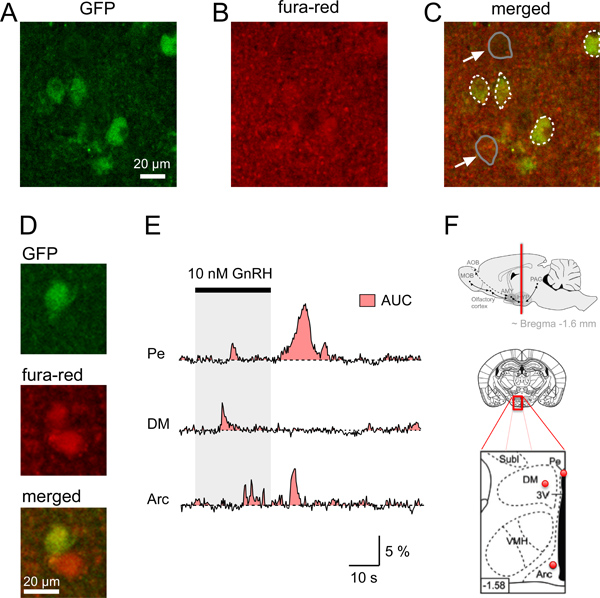
Figura 4. Ca 2 + segnali in neuroni di topo τGFP fettine di cervello ipotalamico. AD. Identificazione di un neurone GFP e acquisizione simultanea del fura-fluorescenza rossa in fettine coronali di cervello di topo. A. immagine confocale di una fetta cervello coronale identificare GnRHR-τGFP neuroni (verde). B. relativamente uniforme del segnale di fluorescenza (rosso) della zona del cervello mostrato in A osservato dopo aver caricato la fetta cervello con fura-red/AM. C. Fusione immagine mostra la neuRons raffigurato in A caricato con il Ca 2 + indicatore colorante (giallo). I confini di GFP neurone somata sono indicati in linee bianche tratteggiate, mentre esempi di due non-GFP somata (frecce) sono indicate nelle linee grigie. D. Esempio di GFP e non-GFP neurone con una maggiore quantità di fluorescenza rossa rispetto allo sfondo. E. Esempi di stimolo somatico-indotta Ca 2 + risposte da singoli GFP-tagged neuroni in diverse aree cerebrali ipotalamici (Pe, periventricolare nucleo; DM, ipotalamo dorsomediale, Arco, nucleo arcuato). Area-sotto-la-curva (AUC) è rappresentata dalla zona rossa. La distinta Ca 2 + segnali tra i neuroni che esprimono GnRHR provenienti da diversi nuclei ipotalamici possono essere confrontati con l'AUC come stima per la variazione totale di Ca 2 + in una determinata casella durante lo stesso periodo. F. disegni schematici e diagrammi che indicano la posizione dei neuroni GFP-tagged analizzati in AE pannello superiore.: La sede di un s cervello coronaleezione contenente regioni cerebrali ipotalamici (linea rossa) Medio e pannello inferiore:. Disegno schematico di una fetta del cervello (al centro) e l'ingrandimento della sua zona rossa in scatola (pannello inferiore) indicando con puntini rossi la posizione approssimativa dei neuroni registrati GFP-tagged da il Pe, DM e Arc mostrato in E, nero zona nello schema pannello inferiore: 3 ° ventricolo. Minori diagrammi due sono adattato da Paxinos e Franklin 12. Basso numero a sinistra indica la distanza (mm) dal bregma.
Discussione
Una questione importante nel campo delle neuroscienze è quello di capire come il cervello elabora le informazioni sociale. La fonte principale delle informazioni necessarie per il riconoscimento sociale è codificato da segnali olfattivi o feromonale. La rilevazione di questi segnali da parte delle popolazioni neuronali nel naso e il riconoscimento dei segnali nel cervello, in particolare l'ipotalamo, svolgono un ruolo fondamentale in molti processi sociali ed ormoni influenza e di altri fattori neuroendocrini
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo i nostri colleghi che hanno partecipato ai lavori qui riassunte. Questo lavoro è stato sostenuto da finanziamenti della Deutsche Forschungsgemeinschaft (SFB 894), 'analisi integrativa dell'olfatto' della DFG Schwerpunktprogramm 1392 e dalla Fondazione Volkswagen (TLZ). TLZ è professore Lichtenberg della Fondazione Volkswagen.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome | Azienda | Cat. N ° | |
| Agar | Sigma | A1296 | |
| Fura-red/AM | Invitrogen | F-3021 | |
| Pluronic F-127 | Sigma | P2443 | |
| Dimetilsolfossido | Fisher Scientific | BP231 | |
| Vibrante-Blade Microtomo Hyrax V 50 | Zeiss | 9770170 | |
| Dispositivo di raffreddamento CU 65 per Microtomo Hyrax V 50 | Zeiss | 9920120 | |
| O 2 / CO 2 Incubatore, CB210-UL | Legante | 0019389 | |
| Super colla, Loctite 406TM | Henckel | 142580 | |
| Spatole doppia, a forma di cucchiaio | Bochem | 3182 | |
| Spatole Microspoon, forma cucchiaio | Bochem | 3344 | |
| Forbici di primavera, Moria-Vannas-Wolff - Lame 7 millimetri | Strumenti Scienza Belle | 15370-52 | |
| Forbici di primavera, Vännäs - Lame 3 millimetri | Strumenti Scienza Belle | 15000-00 | |
| Wagner Forbici | Strumenti Scienza Belle | 14071-12 | |
| Medical Pinze, 7b Dumont | Strumenti Scienza Belle | 11270-20 | |
| Grande camera rettangolare Open Bath (RC-27) | Warner Instruments | 64-0238 | |
| Confocale BioRad Radiance Microscopio 2100 | Zeiss | na |
Riferimenti
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon