Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Imaging Calcium Antworten in GFP-markierten Neuronen des Hypothalamus Maus Hirnschnitten
In diesem Artikel
Erratum Notice
Zusammenfassung
In diesem Protokoll, aktualisieren wir die jüngsten Fortschritte in der Bildgebung Ca 2 + Signale GFP-markierten Neuronen im Gehirn Gewebeschnitte mit einem rot fluoreszierenden Ca 2 + Indikatorfarbstoff.
Zusammenfassung
Trotz einer enormen Steigerung in unserem Wissen über die Mechanismen der Kodierung von Informationen im Gehirn, eine zentrale Frage, die die genauen molekularen Schritte sowie die Aktivität bestimmter Nervenzellen im multifunktionalen Kerne von Hirnarealen wie dem Hypothalamus bleiben. Dieses Problem umfasst die Identifizierung der molekularen Komponenten der Regulation verschiedener Neurohormon Signaltransduktionskaskaden beteiligt. Erhöhungen der intrazellulären Ca 2 + spielen eine wichtige Rolle bei der Regulierung der Empfindlichkeit von Nervenzellen, sowohl auf der Ebene der Signaltransduktion und an synaptischen Websites.
Neue Werkzeuge sind entstanden, um zur Ermittlung Neuronen in der Vielzahl von Neuronen des Gehirns durch Expression grün fluoreszierendes Protein (GFP) unter der Kontrolle eines bestimmten Promotors. Sowohl räumlich als auch zeitlich Stimulus-induzierten überwachen Ca 2 +-Antworten in GFP-markierten Neuronen, eine nicht-grünen fluoreszierenden Ca 2 +-Indikatorfarbstoff nEEDS verwendet werden. Darüber hinaus ist ein beliebtes Konfokalmikroskopie Verfahren zum Abbilden einzelner Neuronen in Gewebeschnitten durch seine Fähigkeit, Neuronen in verschiedenen Ebenen der Tiefe innerhalb des Gewebes sichtbar zu machen und außerhalb des Fokus Fluoreszenz begrenzen. Die ratiometrische Ca 2 +-Indikator Fura-2 wurde in Kombination mit Neuronen verwendet ein GFP-markierten. Jedoch wird der Farbstoff durch ultraviolettes (UV) Licht angeregt. Die Kosten für den Laser und die begrenzte optische Eindringtiefe des UV-Lichts verhindert die Verwendung in vielen Laboratorien. Darüber hinaus kann GFP-Fluoreszenz mit den Fura-2 Signale 2 stören. Deshalb haben wir beschlossen, ein rot fluoreszierendes Ca 2 +-Indikator-Farbstoff verwenden. Die riesige Strokes Verschiebung der Fura-Rot erlaubt multicolor Analyse der roten Fluoreszenz in Kombination mit GFP mit einer einzigen Anregungswellenlänge. Wir hatten zuvor gute Ergebnisse mit Fura-Rot in Kombination mit GFP-markierten olfaktorischen Neuronen 3. Die Protokolle für olfaktorischen Gewebeschnitten schien e arbeitenQually auch in Neuronen des Hypothalamus 4. Fura-rot Basis Ca 2 +-Imaging wurde auch erfolgreich mit GFP-markierten Pankreas β-Zellen und GFP-markierten Rezeptoren in HEK-Zellen 5,6 Ausdruck kombiniert. Ein wenig Laune des Fura-Rot ist, dass seine Fluoreszenzintensität bei 650 nm, wenn die Anzeige bindet Calcium 7 abnimmt. Daher weist die Fluoreszenz des ruhenden Neuronen mit niedrigen Ca 2 +-Konzentration relativ hoher Intensität. Es sollte angemerkt werden, dass andere rote Ca 2 +-Indikatorfarbstoffe existieren oder derzeit entwickelt werden, könnte das eine bessere oder verbesserte Ergebnisse in verschiedenen Neuronen und Hirnareale.
Protokoll
Ein. Vorbereitung der Lösung und Agarose Gel
- Bereiten extrazellulären Lösung gemäß der Tabelle mit doppelt destilliertem Wasser. Der pH-Wert wird ~ 7,3 nach 10 min Begasung mit Carbogen (95% O 2/5% CO 2), die Osmolarität 300 mOsm 8. Wenn eine höhere Osmolarität erforderlich ist, kann es durch Zugabe von mehr Glucose (1 mM gleich 1 mOsm) eingestellt werden. Die Lösung wird zweimal mit einem 0,2 um Membranfilter an Staubpartikel und mögliche bakterielle Verunreinigungen zu eliminieren.
| Namen Reagenz | Abkürzung | Mol. Gewicht | Conc. | Firma | Cat. Nr. |
| Kochsalz | NaCl | 58,44 g / mol | 120 mM | VWR | 27810 |
| Natriumhydrogencarbonat | NaHCO 3 | 84,01 g / mol | 25 mM | Merck | 106329 |
| Kaliumchlorid | KCl | 74,55 g / mol | 5 mM | Merck | 104936 |
| BES * | C 6 H 15 NO 5 S | 213,25 g / mol | 5 mM | Sigma | 14853 |
| Magnesiumsulfat, wasserfreiem | MgSO 4 | 120,37 g / mol | 1 mM | Sigma | M7506 |
| Calciumchloriddihydrat | CaCl · 2H 2 O | 147,02 g / mol | 1 mM | Merck | 102382 |
| D (+)-Glucose-Monohydrat | C 6 H 12 O 8 * H 2 O | 198,17 g / mol | 10 mM | Merck | 108342 |
*N, N-Bis (2-hydroxyethyl)-2-Säure aminoethansulfonic
- Die Lösung wird bei 4 ° C gelagert, sondern mit Carbogen (95% O 2/5% CO 2) für 10 Minuten vor der Verwendung belüftet werden.
- Zu diesem Zeitpunkt wird auch vorbereiten 1 cm 3 Blöcke von Agargel, das Gehirn während des Schneidvorganges zu stabilisieren (siehe Schritt 3). Erstens lösen 4% (w / v) Agar (Sigma) in doppelt destilliertem Wasser durch Erwärmen der Lösung auf etwa 60 ° C. Die erwärmte gelöst Agarlösung in eine quadratische Petrischale zu einer Höhe von 1 cm gegossen. Nach Abkühlen und Aushärten wird die 4% Agargel in Blöcke von 1 cm 3 geschnitten. Diese Blöcke können gelagert werden bis zu 4 Wochen bei 4 ° C.
2. Dissektion der Maus Gehirn
Bitte stellen Sie sicher, dass alle tierexperimentellen Verfahren in Übereinstimmung mit den Richtlinien der Tierschutz Ausschüsse der jeweiligen Institutionen geschaffen werden durchgeführt.
- Vor sacrificing das Tier sicher, dass die Agar-Gel-Blöcke sind für den Einsatz bereit.
- Anästhesieren die Maus mit Isofluran (1-4% Isofluran in Sauerstoff unter Verwendung eines Verdampfers Präzision für ca. 1 min). Es ist wichtig, Hypoxie und daher neuronalen Schäden zu verhindern. Ein Nachteil von Isofluran ist die Kosten-und Logistik mit Präzisions-Verdampfer. Eine tödliche Überdosis in einem offenen System könnte eine Alternative sein, da die Maus geopfert werden. Arbeitssicherheit ist in diesem Fall ein ernsthafter Besorgnis. Die Isofluran muss direkt entlüftet werden aus dem Zimmer. Daher sollte eine Überdosierung in einem offenen System in einer chemischen Abzugshaube durchgeführt werden.
- Euthanize die Maus durch Enthauptung nach Überwachung der Narkosetiefe durch Testen Sie den hinteren Fuß-Reflex. Dieses Pedal oder Pfote Prise Reflex wird durch fest einklemmen eine Pfote oder Zehen zwischen den Fingern, einen Rückzug Reaktion des Tieres hervorrufen durchgeführt. Ein Tier, das einen Reflex zeigt, ist nicht an einer chirurgischen Niveau der Anästhesie und definitiv nicht inein Staat einschläfern.
- Nach Enthauptung, schneiden Sie die Kopfhaut mit einer einzigen Kante razorblade zentral in sagittaler Richtung, aus der Stirnbein dem externen Hinterhaupthöcker. Bewegen der zwei Teile der Kopfhaut, zuerst von der medialen kaudalen Ende im rostralen seitlichen Richtung, dann nach unten in ventraler Richtung (1A-C).
- Machen Sie zwei seitlichen und einem rostral Schnitt in das Foramen magnum mit einer kleinen Feder Schere (siehe zum Schneiden Richtung die schwarz gestrichelte Pfeile in Abbildung 1C). Sorgfältig Abspaltung der Schädel von mediocaudal um seitliche rostral mit stumpfen Pinzette (siehe breiten grauen Pfeile in Abbildung 1C). Bei älteren Tieren ein kleiner Schnitt an der Pfeilnaht ist hilfreich und wird häufig benötigt, um eine Beschädigung kortikalen Schichten des Gehirns zu vermeiden.
- In diesem Augenblick die occipital, interparietal und parietalen Knochen sollte abgelöst werden. Falls noch vorhanden, sollte die Dura mater sorgfältig entfernt werden mit einer Pinzette, um Schäden am br verhindernain im nächsten Schritt.
- Nehmen Sie die Squamosum Knochen, die ethmoidalis anterior und frontal Foramen (Abbildung 1D).
- Das Gehirn kann nun leicht entfernt unter Verwendung eines invertierten micro Löffel Spatel und Durchtrennen der Hirnnerven (1E) werden.
3. Slicing Coronal Hypothalamic Abschnitte Gehirn der Maus
- Legen Sie das Gehirn auf ihrer Bauchseite auf einem cut-Oberfläche und entfernen Sie das Kleinhirn mit einer einzigen Rasierklinge (Abbildung 2A). Diese gerade geschnittene Oberfläche wird die Basis für den Aufbau des Gehirns auf einer Platte zu ermöglichen Schneiden von koronalen Hirnschnitten sein.
- Kleber das Gehirn mit dem geschnittenen Abschnitt auf der Grundplatte des Mikrotoms (Zeiss, Hyrax V50) mit geringen Mengen einer schnellen Aushärtung Hochleistungs Cyanacrylatklebstoff superglue (Loctite 406; 1A). Darüber hinaus kleben ein 1 cm 3 Agargel Block (siehe 1.5) an der ventralen Seite des Gehirns (siehe "v" in 2B) auf der Grundplatte des Mikrotoms (Zeiss, Hyrax V50) zu unterstützen und zu beheben das Gehirn während Slicing. Achten Sie darauf, nicht zu viel Kleber zu verwenden, um sicherzustellen, dass Kleber Traversen zwischen Gehirn und Gelblock Probleme verursachen bei der Beseitigung von Gewebeschnitten nach dem Schnitt zu entziehen. Das Gel Block wird an der gegenüberliegenden Seite des Schneidmessers aus dem Mikrotom (2B) befindet.
- Nach ein paar Sekunden wird die Anleihe wurde getrocknet, stellte den Teller in das Bad Ihrer Mikrotom gefüllt mit 6 ° C kalte Sauerstoff (95% O 2/5% CO 2) extrazelluläre Lösung (siehe 1.1).
- Verwenden Sie geeignete niedrige Slicing Geschwindigkeit und geschnitten 300 um dicke Scheiben schneiden. Im Falle unseres Mikrotom, verwenden wir eine Frequenz von 60 Hz, einer Amplitude von 0,8 mm und einer Geschwindigkeit von 0,8 mm / s (Abb. 2C). Die koronalen Gehirnschnitte werden entweder direkt nach jedem Schnitt gesammelt oder können im Bad belassen werden, bis das gesamte Gehirn wurde geschnitten. Die koronalen Hirnschnitten werden sorgfältig transferred in ein Becherglas mit kaltem Sauerstoff extrazellulären Lösung. Diverse Tools wurden entwickelt, um die Übertragung (zB Schnitt breite Kunststoff oder Glas Pasteur Pipetten oder breite Löffelspatel) durchzuführen. Es hängt von der Experimentator die bevorzugt wird. Vor allem aber sollte die Scheiben entsprechend behandelt werden, um Schäden zu minimieren.
- Wenn das Mikrotom kann so programmiert werden, um Scheiben automatisch geschnitten werden, können Sie beginnen, die Ca 2 +-Indikator-Farbstoff Beladungslösung in diesem Moment vorzubereiten. Ansonsten empfiehlt es sich, dass die Herstellung dieser Lösung durchgeführt wird, bevor das Gehirn Schneiden beendet ist, um Verzögerungen zu messen Ca 2 +-Antworten in den Neuronen, nämlich vor Beginn der Stufe 2 zu minimieren.
4. Herstellung des Ca 2 +-Indikatorfarbstoff Loading Solution
Ein entscheidender Schritt beim Laden Neuronen bleibt oft der Gesundheit der Zellen, die auf dem Ausmaß der Beschädigung induziert durch abhängt und die Drehzahl desdie Dissektion Verfahren. Ein weiterer wesentlicher Schritt scheint die Verwendung von frischen Pluronic F-127-Lösung (siehe 4.1). Es wird empfohlen, diese Lösung im Labor zu machen und nicht zu einem vorgefertigten Lösung von einem Anbieter zu verwenden. Abhängig von der Temperatur, der Feuchtigkeit und dem Regal Lebensdauer des Pluronic F-127-Lösung, haben wir festgestellt, Abbau der olfaktorischen und Gehirn Neuronen während des Ca 2 +-Ladevorgangs.
- Bereiten Sie die 20% (w / v) Pluronic F-127 (Sigma) in Dimethylsulfoxid (DMSO) durch Addieren des Pluronic F-127-Pulver auf der Oberseite der DMSO-Lösung. Direkt beschallen diese Lösung ohne vorherige Wirbel oder Vermischung. Innerhalb von 2 min Ultraschallbehandlung die Pluronic F-127 wird aufgelöst. 100 ul Pluronic F-127-Lösungen sind frische Woche vorbereitet.
- Nehmen Sie ein Rohr von 50 ug zellpermeablen fura-red/AM (Invitrogen; AM, Acetoxymethylester) und mit 5 ul 20% Pluronic F-127-Lösung. Mischen Sie die Lösung mit der Spitze Ihrer Pipette.
- Fügen Sie 45 ul extrazellulären Löauf (siehe 1.1) auf die Mischung und Vortex es kurz.
- Fügen Sie eine weitere 325 ul extrazelluläre Lösung und beschallen das Rohr für 3 min.
- Nach der Beschallung hinzuzufügen 1,156 ml Sauerstoff (95% O 2/5% CO 2) extrazellulären Lösung, um Ihre endgültige Ca 2 + Indikatorfarbstoff Laden-Lösung (30 uM fura-red/AM, 0,33% DMSO und 0,065% Pluronic F-127) erhalten . Bewahren Sie das Rohr in einem dunklen Ort bis zur Verwendung (siehe 4.8).
- Übertragen Sie die koronalen Hirnschnitten zu einer 6-well Zellkulturplatte (BD Falcon) mit sauerstoffreichem (95% O 2/5% CO 2) extrazellulären Lösung (bis zu sechs Scheiben pro well) gefüllt.
- Absaugen Sauerstoff extrazellulären Lösung aus den Kammern der 6-Well-Platte dabei nicht um die Hirnschnitten beschädigen.
- Pipet direkt 750 ul der Ca 2 +-Indikator-Farbstoff Belastung Lösung für jeden gut. Die Hirnschnitten sollte von der Lösung mit fura-red/AM (Immersion loading) abgedeckt werden.
- INCUBATe die Scheiben in einer O 2 / CO 2 Zellkulturbrutschrank (O 2: 23,5%, CO 2: 5%) für 45 bis 60 min bei 37 ° C.
- Am Ende der Inkubationszeit, ersetzen Sie die Ca 2 +-Indikator-Farbstoff Belastung durch frisches sauerstoffreiches extrazellulären Lösung, um eine Überlastung der Zellen mit Fura-Rot und beeinflussen auf subtile Weise die Ca 2 +-Messung über die chelatisierende Wirkung des Farbstoffs. Die Scheiben werden dann in der O 2 / CO 2-Inkubator (siehe voriger Punkt für die Einstellung) bis zur Verwendung aufbewahrt und sind für bis zu 3-6 Stunden lebensfähig.
5. Microscopy and Analysis
In diesem Protokoll wird die Fluoreszenzintensität der GFP, die die Zelle von Interesse identifiziert, und der Ca 2 +-Indikatorfarbstoff gleichzeitig in Hirnschnitten gemessen werden. Somit sollte die Konfokalmikroskop mit der korrekten Laser, Filter und zwei Photovervielfacherröhren ausgestattet sein, um die beiden zu sammeln Emissiauf Signalen. GFP und die Änderung der Fluoreszenzintensität des Fura-roten kann unter Verwendung eines einzigen Anregungswellenlänge von 488 nm ist. Emission Fluoreszenz der Fluorophore können gesammelt unter Verwendung eines 522/DF35 nm Filter für GFP und einem Langpassfilter für Wellenlängen größer als 600 nm für Fura-rot.
- Um die Überwachung Stimulus-induzierten Änderungen in der Fluoreszenz-Signal, das ein Maß für die intrazelluläre Ca2 +-Konzentration sind, starten einer der Fura-roten beladenen Gehirnschnitte mit einem Aufnahme-Kammer (dh Warner Instruments RC-27 Bad-Kammer) transferiert Dies kann zum Konfokalmikroskop Setup (3A, B) angebracht werden.
- Sichern Sie die Hirnschnitt mit einer Harfe (3C), die Scheibe auf Grund der Perfusion Geschwindigkeit des Bades zu bewegen verhindern (oxygenierten extrazellulären Lösung, siehe Schritt 1.1). Die Harfe (slice Halter) aus einer parallelen Anordnung von Nylonfäden (voneinander getrennt durch ~ 1 mm) aufgereiht auf gemachteine U-Form Silber oder Platin Rahmen. Die Temperatur der Badlösung in diesem Schritt sollte mindestens Raumtemperatur. Wenn höhere Temperaturen erforderlich sind, muss darauf geachtet werden, gegebenenfalls nach Kondensation an Mikroskoplinsen und Bewegung der Fokusebene durch Schaltungsteile im Mikroskop zu verhindern.
- Versorgen die Scheibe für 10 min mit sauerstoffreichem extrazellulären Lösung ein Überschuss der extrazellulären Ca 2 +-Indikator-Farbstoff zu entfernen. Der Durchfluss der Perfusion sollte ~ 100 ul / s (Tipps in Bezug auf eine entsprechende Perfusionssystem siehe 9) eingestellt werden.
- Schauen Sie sich die Scheibe durch das Mikroskop bei geringer Vergrößerung, notieren Sie sich die Ausrichtung der Scheibe für Ihre Unterlagen und finden Sie Ihr Interessengebiet in der Scheibe, in unserem Fall der Hypothalamus-Bereich im Gehirn.
- Wechseln Sie zu hohe Vergrößerung und finden Sie die Zelle von Interesse in der Scheibe durch das Sammeln von GFP Bilder und gleichzeitig die Überprüfung der Fluoreszenzintensität des Fura-rotSignal (4A-C). Zellen in der Nähe der Oberfläche könnte beschädigt werden oder tot ist. Daher sollten die Zellen in einer Tiefe von mehr als 10 um liegt zum Abbilden ausgewählt werden. Wir konnten zuverlässig messen Zellen bis zu einer Tiefe von 40 bis 50 um, wonach begonnen die Signalstärke zu fallen. Beachten Sie, dass die Fura-Rot-Signal von Zellen in Ruhe mit niedrigen Ca 2 +-Konzentration relativ hohe Fluoreszenzintensitäten haben. Diese hohe Fluoreszenzintensität ist in diesem Fall nicht ein Zeichen von abgestorbenen Zellen. Das GFP-Signal kann verwendet werden, um eine Drift oder Bewegung des Gewebeschnitts oder als Indikator für Veränderungen der intrazellulären pH 10 zu detektieren.
- Einstellen der Laserleistung auf einen Wert, der Messungen in der Änderung des Fura-rote Fluoreszenz Intensität ermöglicht und verhindert, Bleichen der beiden Fluorophore. Daher kann mit der niedrigsten Laserleistung gestartet und neu einstellen müssen ein ausreichendes Signal-Rausch-Verhältnis durch Ändern Schwarzwert (Offset), Detektoröffnung, Verstärkung und Laser Graufilter erhaltens. Außer für die Laserleistung, sollte der gleiche für das GFP-Signal erfolgen.
- Start, um Bilder mit Raten zwischen 0,5 zu erwerben - 2 Hz, um die Fura-Rot und GFP-Signale zu sammeln. Die Akquisition dürfte auf die erwartete Rate der Ca 2 +-Signal optimiert werden. Spannungsabhängigen Ca 2 +-Spikes können schneller und kürzer als Transienten Aktivierung einiger Signaltransduktionskaskaden erfordern Aktivierung verschiedener Botenstoffe verursachen. Die Länge der Bildaufnahme sollte sich für den Zweck des Experiments. Das GFP-Signal wird über die Zeit zu bestimmen, wenn eine Bewegung des Hirnschnittkultur aufgetreten.
- Während der Akquisition und dem Experiment haben alle Abtastkopf Einstellungen konstant gehalten werden, um zuverlässige Ergebnisse, die verglichen werden aufnehmen können.
- Die Veränderungen in der Fluoreszenz über die Zeit kann unter Verwendung verschiedener mathematischer Programme, dh ImageJ (NIH, Bethesda, MD werden; http:/ / Rsb.info.nih.gov / ij /), Igor Pro (Wavemetrics) oder MatLab (The MathWorks). Durch die umlaufende Somata eines GFP-markierten Neuronen, die die Region von Interesse (ROI), kann diese exakt gleichen Region für Änderungen in der Ca 2 + analysiert werden unter Verwendung der Fura-roten Fluoreszenz Signal über die Zeit.
Ca 2 +-Signale können als beliebige Fluoreszenzeinheiten oder als Werte (AF / F) der relativen Änderung in der Fluoreszenzintensität (AF) normiert auf den Fluoreszenzbasismesswert (F) dargestellt werden. Dieses Verfahren führt zu einem negativen Ablenkung, wenn die intrazelluläre Ca2 +-Konzentration steigt mit Fura-Rot als Ca 2 +-Indikatorfarbstoff. Um die Interpretation der Ergebnisse zu erleichtern, empfehlen wir die Multiplikation der &Dgr; F / F-Werte mit -1 bis positive Fluoreszenz-Signale zu erhalten, um einen Anstieg der Ca 2 + (4C) anzuzeigen.
Die Ergebnisse zwischen Neuronen der Amplitude und Frequenz des Ca vergleiche 2 +-Signale werden üblicherweise analysiert. Dennoch haben einige Ca 2 +-Signale nicht mit einer Regelstudienzeit oder vergleichbare Amplituden auftreten. Einige Signale könnten stark von stochastischen Prozessen in der Zelle beeinflusst werden. So zu quantifizieren die gesamte Änderung Ca 2 + in einer bestimmten Zelle und einen Vergleich der Ca 2 + zu ermöglichen Reaktionen zwischen den Neuronen in verschiedenen Hirnregionen, die Analyse der Fläche unter der-Kurve (AUC) ist besser geeignet. Dieses Maß für die Menge an Ca 2 + umfasst jede anfängliche Ca 2 + Transienten, zweiten Phasen und erlitten erhöhte Ca 2 +-Antworten und Schwingungen. In diesem Fall sollte darauf geachtet werden, um die gleiche Zeitdauer zu analysieren, um den Vergleich zwischen den Neuronen zu ermöglichen.
6. Repräsentative Ergebnisse
So starten Charakterisierung Gonadotropin-Releasing-Hormon-Rezeptor (GnRHR) exprimierenden Neuronen im Hypothalamus nutzten wir transgene Mäuse, die ausdrückliche GFP nach Cre-vermittelte Anresion in GnRHR-exprimierenden Neuronen 4,11. GFP fluoreszierende Nervenzellen wurden in verschiedenen Hirnregionen, einschließlich des Hypothalamus identifiziert. Um die physiologischen Eigenschaften dieser GnRHR Neuronen untersuchen wir zunächst Ca 2 + aufgezeichneten Signalen in hypothalamischen Scheiben mit einem konfokalen Mikroskop. Ersten erhielten wir koronalen Hirnschnitten aus diesen Mäusen unter Verwendung des oben beschriebenen Protokolls. Abbildung 1 zeigt die erforderlichen Werkzeuge, Werkstoffe und Schritte für Ausschneiden eines Mäusehirn. Die koronalen Hypothalamus Hirnschnitten geschnitten wurden (Abbildung 2) und dann nach den Schritten in Punkt 4 des Protokolls geladen. Einzel Hirnschnitt den entsprechenden Bereich in einer Aufnahme Kammer platziert, gesichert mit einer Harfe (Abbildung 3) und dann abgebildet mit einem konfokalen Mikroskop (siehe Schritte 5,1-5,9). Abbildung 4 zeigt ein Beispiel aus zwei einzelnen koronalen Hirnschnitten Identifizierung einzelner GnRHR-τGFP Zellkörper, die Fluoreszenz in Ruhe nach loading die Hirnschnittkultur mit fura-red/AM und das fusionierte konfokalen Bild anzeigt, dass das GFP-Neuron hatte Fura-roten ausreichend Untersuchung zur Stimulus-induzierten Ca 2 +-Signale ermöglichen genommen in diesen Zellen. Verwendung unserer Protokoll wir zunächst geprüft, ob GnRHR Neuronen ähnlichen Ca2 +-Signale zu nutzen Stimulus für Detektion in verschiedenen Bereichen des Hypothalamus als Reaktion auf direkte Aktivierung mit GnRH (4E). Allerdings unterschieden sich diese Signale in ihrer Wellenform je Reizstärke und Gehirn Bereich 4. Um die Änderung der Dynamik der Ca 2 +-Antworten zu quantifizieren, die Fläche-under-the-Kurve (AUC) kann als Maß für die Erhöhung der intrazellulären Ca 2 + (4E) 4 berechnet. Studien sind zurzeit im Gange, um die molekularen Grundlagen der Ca 2 + Wellen und Schwingungen, ihre Abhängigkeit von Geschlecht und hormonellen Status des Tieres zu untersuchen, und ob sie moduliert werden kanndurch andere natürliche Reize.
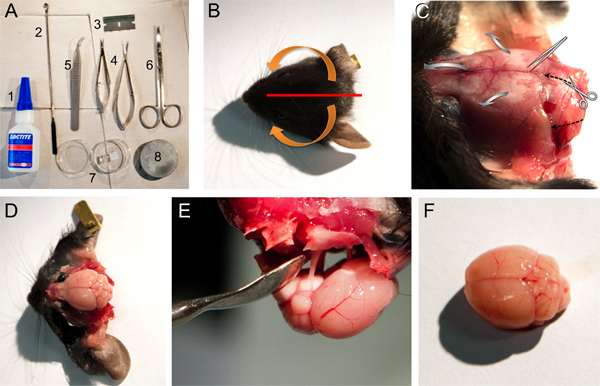
Abbildung 1. Werkzeuge, Materialien und Schritte für Ausschneiden eines Maushirn. A. Werkzeuge und Materialien für Gehirn Dissektion verwendet: 1, Loctite 406 Sekundenkleber, 2, micro Löffel Spatel, 3, single Rasierklinge, 4, kleine und mittlere Feder Schere; 5, stumpfen Pinzette, 6, Schere, 7, Petrischale mit Agar Gelblock, 8, Grundplatte zur Montage Gehirn in Mikrotom. BF. Bilder von einigen Schritten in Punkt 2 des Protokolls beschrieben. B. Photograph einer Maus den Kopf, die die Schneidposition der Kopfhaut (rote Linie) und Pfeile (orange), die die Richtung der Haut vom Knochen sollte gezogen werden (siehe Schritt 2,4). C. Photograph der Maus den Kopf, nachdem die Haut entfernt wird, die die knöchernen Strukturen (siehe Schritt 2,4) gezogen. Schneidrichtung des Scherenelementes und die Richtung zum Aufbrechen des Schädels mit den stumpfen Pinzette ist entweder mit dem schwarzen angedeutetgestrichelten Pfeile oder grau breite Pfeile sind. D. Foto von Gehirn der Maus nach Beseitigung der verschiedenen knöchernen Strukturen (siehe Schritt 2,5 bis 2,7). E. Fotografie der Entfernung des Gehirns noch an dem Schädel mittels der Hirnnerven verbunden. F. Foto von einem relativ unbeschädigt Maushirn.

Abbildung 2. Schneiden von koronalen Hypothalamus Abschnitte Gehirn der Maus. A. Fotografieren, das die Position des einzigen Rasierklinge zum Eliminieren des Cerebellums (siehe Schritt 3.1). B. Positionieren des Agargel Block in Relation zum Gehirn auf die Grundplatte des Mikrotoms geklebt (siehe Schritt 3.2). C. Schneiden von koronalen Hirnschnittkultur (beachte hier die Position des Gehirns und Gelblock Positionen in Bezug auf die Schneidklinge des Mikrotoms; siehe Schritt 3.4.). d, dorsal; v, ventral.

Abbildung 3. Gehirnscheibe in Aufnahme Kammer positioniert. A, B. Übersicht (A) und höheren Vergrößerung (B) eines Warner Instruments RC-27 offenen Bad Ableitkammer gibt einen breiten Zugang zu den Bereichen des Hypothalamus koronalen Hirnschnittkultur (siehe Schritt 5.1). C U-förmigen Metall Harfe mit parallelen Anordnungen von Nylonfäden, die die Scheibe in Position in der Aufnahme Kammer halten (siehe Schritt 5.2) wird.
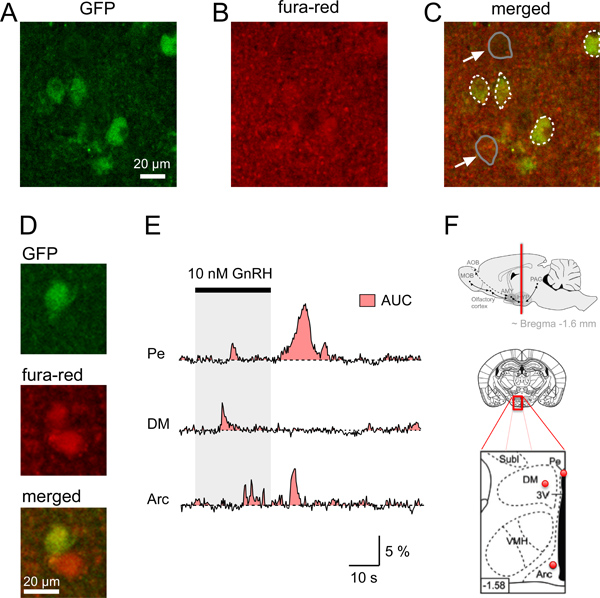
Abbildung 4. Ca 2 +-Signale in τGFP Neuronen der Maus Hypothalamus Hirnschnitten. AD. Identifizierung eines GFP Neuron und gleichzeitigen Erwerb des Fura-rote Fluoreszenz in koronalen Maus Hirnschnitten. A. Konfokales Bild eines koronalen Hirnschnitten identifizieren GnRHR-τGFP Neuronen (grün). B. relativ gleichmäßige Fluoreszenz-Signal (rot) der Bereich des Gehirns in A nach dem Laden des Gehirns Scheibe mit fura-red/AM beobachtet gezeigt. C. Zusammengeführt Bild zeigt den neuNeuronen in einer geladenen mit dem Ca 2 +-Indikatorfarbstoff (gelblich) dargestellt. Grenzen von GFP Neuron Somata in gestrichelten weißen Linien angedeutet, während Beispiele von zwei nicht-GFP Somata (Pfeile) in graue Linien angedeutet. D. Beispiel eines GFP und nicht-GFP-Neuron mit höheren Mengen an roter Fluoreszenz im Vergleich zum Hintergrund. E. Beispiele für somatische Stimulus-induzierten Ca 2 +-Antworten aus den einzelnen GFP-markierten Neuronen in verschiedenen hypothalamischen Hirnarealen (Pe, periventrikuläre Kern; DM, dorsomedial Hypothalamus; Arc, arcuatus). Area-under-the-Kurve (AUC) wird durch die rote Fläche dargestellt. Die deutliche Ca 2 +-Signale zwischen GnRHR-exprimierenden Neuronen aus verschiedenen hypothalamischen Kerne im Vergleich mit der AUC als Schätzung für die gesamte Änderung Ca 2 + in einer bestimmten Zelle im gleichen Zeitraum. F. Schematische Zeichnungen und Diagramm, welches die Position der GFP-markierten Neuronen in AE analysiert Oben:. Standort eines koronalen Gehirn sbschnitt mit hypothalamischen Hirnregionen (rote Linie) Mittlere und untere Tafel:. Schematische Darstellung eines Gehirns Scheibe (Mitte) und die Vergrößerung seiner roten eingerahmten Bereich (unteres Bild), die mit roten Punkten die ungefähre Position der aufgezeichneten GFP-markierten Neuronen aus Die Pe, DM und Arc in E gezeigt; schwarze Fläche im unteren Bereich, Schema: 3 rd Ventrikels. Beiden unteren Diagramme werden aus Paxinos und Franklin 12 angepasst. Lower left corner Zahl zeigt den Abstand (mm) von Bregma.
Diskussion
Eine wichtige Frage in den Neurowissenschaften ist es zu verstehen, wie das Gehirn soziale Informationen verarbeitet. Eine vorherrschende Quelle von Informationen, die für die gesellschaftliche Anerkennung wird durch Geruchs-oder Pheromone Signale kodiert. Der Nachweis dieser Signale durch neuronale Populationen in der Nase und der Erkennung der Signale im Gehirn, insbesondere der Hypothalamus, eine wichtige Rolle spielen in vielen sozialen Prozesse und Einfluss Hormone und andere neuroendokrine Faktoren 13-16.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken unseren Kollegen, die in der Arbeit beteiligt hier zusammengefasst. Diese Arbeit wurde durch Fördermittel der Deutschen Forschungsgemeinschaft (SFB 894), der DFG Schwerpunktprogramm 1392 "Integrative Analyse des Geruchssinns" und von der Volkswagen-Stiftung (TLZ) unterstützt. TLZ ist eine Lichtenberg Professor der Volkswagen-Stiftung.
Materialien
| Name | Company | Catalog Number | Comments |
| Name | Firma | Cat. Nr. | |
| Agar | Sigma | A1296 | |
| Fura-red/AM | Invitrogen | F-3021 | |
| Pluronic F-127 | Sigma | P2443 | |
| Dimethylsulfoxid | Fisher Scientific | BP231 | |
| Vibrierende-Blade Mikrotom Hyrax V 50 | Zeiss | 9770170 | |
| Kühlgerät CU 65 für Mikrotom Hyrax V 50 | Zeiss | 9920120 | |
| O 2 / CO 2 Inkubator, CB210-UL | Binder | 0019389 | |
| Super Kleber, Loctite 406TM | Henckel | 142580 | |
| Doppelspatel, Löffelform | Bochem | 3182 | |
| Mikrolöffel Spatel, Löffel Form | Bochem | 3344 | |
| Federschere, Moria-Vannas-Wolff - 7mm Blades | Fine Science Tools | 15370-52 | |
| Federschere, Vannas - 3mm Blades | Fine Science Tools | 15000-00 | |
| Wagner Scissors | Fine Science Tools | 14071-12 | |
| Medical Forceps, Dumont 7b | Fine Science Tools | 11270-20 | |
| Große rechteckige Open Bath Chamber (RC-27) | Warner Instruments | 64-0238 | |
| Konfokalen Mikroskop BioRad Radiance 2100 | Zeiss | na |
Referenzen
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten