Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Les réponses de calcium dans les neurones d'imagerie GFP-marqués de hypothalamiques tranches de cerveau de souris
Dans cet article
Erratum Notice
Résumé
Dans ce protocole, nous mettons à jour les progrès récents de l'imagerie Ca 2 + Signaux des neurones GFP-marqués dans les tranches de tissus du cerveau en utilisant un rouge fluorescent Ca 2 + Indicateur de colorant.
Résumé
Malgré une augmentation considérable de nos connaissances sur les mécanismes qui sous-tendent l'encodage de l'information dans le cerveau, une question centrale concernant les mesures précises moléculaires ainsi que l'activité des neurones spécifiques dans multi-fonctionnel des noyaux de zones du cerveau comme l'hypothalamus reste. Ce problème comprend l'identification des composants moléculaires impliqués dans la régulation des cascades de transduction du signal neurohormone différentes. Des élévations des intracellulaire de Ca 2 + jouent un rôle important dans la régulation de la sensibilité des neurones, tant au niveau de la transduction du signal et sur les sites synaptiques.
De nouveaux outils ont vu le jour pour aider à identifier les neurones dans la myriade de neurones du cerveau en exprimant la protéine fluorescente verte (GFP) sous le contrôle d'un promoteur particulier. Pour surveiller à la fois spatialement et temporellement stimulus induit par Ca 2 + dans les réponses des neurones marqués GFP, un non-fluorescente verte Ca 2 + colorant indicateur needs à être utilisé. En outre, la microscopie confocale est une méthode préférée de neurones individuels d'imagerie dans des tranches de tissu en raison de sa capacité de visualiser des neurones dans des plans distincts de profondeur dans le tissu et pour limiter l'extérieur de la mise au point de fluorescence. La ratiométrique Ca 2 + indicateur fura-2 a été utilisée en combinaison avec GFP-1 marqué neurones. Toutefois, le colorant est excité par le rayonnement ultraviolet (UV). Le coût du laser et de la profondeur de pénétration limitée optique de la lumière UV empêché son utilisation dans de nombreux laboratoires. En outre, fluorescence de la GFP peut interférer avec les signaux de fura-2 2. Par conséquent, nous avons décidé d'utiliser un rouge fluorescent Ca 2 + colorant indicateur. L'énorme changement Strokes de fura-rouge permet une analyse de la fluorescence multicolore rouge en combinaison avec la GFP en utilisant une longueur d'onde d'excitation unique. Nous avons eu de bons résultats précédemment en utilisant le fura-rouge en combinaison avec GFP-étiqueté neurones olfactifs 3. Les protocoles de tranches de tissus olfactifs semble fonctionner eQually bien dans les neurones hypothalamiques 4. Fura-rouge à base de Ca 2 + imagerie a également réussi à combiner avec pancréatiques GFP-β-cellules marqués et étiquetés GFP-récepteurs exprimés dans des cellules HEK 5,6. Une petite bizarrerie de fura-rouge, c'est que son intensité de fluorescence à 650 nm diminue une fois l'indicateur fixe le calcium 7. Par conséquent, la fluorescence des neurones au repos avec une faible concentration de Ca 2 + a une intensité relativement élevée. Il est à noter, que les autres rouges Ca 2 + indicateurs de colorants existent ou sont en cours d'élaboration, qui pourraient donner de meilleurs résultats ou améliorés dans les neurones du cerveau et de régions différentes.
Protocole
1. Préparation de la solution et gel d'agarose
- Préparer la solution extracellulaire selon le tableau avec de l'eau bidistillée. Le pH sera ~ 7,3 après 10 min d'aération avec carbogène (95% O 2/5% CO 2), l'osmolarité de 300 mOsm 8. Si une osmolarité supérieure est nécessaire, il peut être ajustée en ajoutant plus de glucose (1 mM est égal à 1 mOsm). La solution est filtrée deux fois en utilisant un filtre à membrane de 0,2 um pour éliminer les particules de poussière et d'éventuelles contaminations bactériennes.
| Nom du réactif | Abréviation | Mol. poids | Conc. | Entreprise | Cat. N ° |
| De chlorure de sodium | NaCl | 58,44 g / mole | 120 mM | VWR | 27810 |
| NaHCO 3 | 84,01 g / mol | 25 mM | Merck | 106329 | |
| Le chlorure de potassium | KCl | 74,55 g / mole | 5 mM | Merck | 104936 |
| BES * | C 6 H 15 NO S 5 | 213,25 g / mol | 5 mM | Sigma | 14853 |
| Le sulfate de magnésium anhydre | MgSO 4 | 120,37 g / mol | 1 mM | Sigma | M7506 |
| Chlorure de calcium dihydraté | CaCl * 2H 2 O | 147,02 g / mol | 1 mM | Merck | 102382 |
| D (+)-glucose monohydraté | C 6 H 12 O 8 * H 2 O | 198,17 g / mol | 10 mM | Merck | 108342 |
*N, N-bis (2-hydroxyéthyl)-2-acide aminoethansulfonic
- La solution est conservée à 4 ° C, mais elle doit être aérée avec carbogène (95% O 2/5% CO 2) pendant 10 minutes avant utilisation.
- À ce temps, préparez aussi 1 cm 3 blocs de gélose pour stabiliser le cerveau au cours de la procédure de coupe (voir étape 3). Tout d'abord, dissoudre 4% (p / v) d'agar (Sigma) dans de l'eau doublement distillée en chauffant la solution à environ 60 ° C. La solution d'agar dissous chauffée est versée dans un moule carré de Pétri à une hauteur de 1 cm. Après refroidissement et le durcissement, le gel d'agar 4% est découpé en blocs de 1 cm 3. Ces blocs peuvent être conservés jusqu'à 4 semaines à 4 ° C.
2. Dissection du cerveau de souris
S'il vous plaît assurez-vous que toutes les procédures expérimentales chez l'animal sont effectuées conformément aux lignes directrices établies par les comités de protection des animaux de leurs institutions respectives.
- Avant sacrificing l'animal, assurez-vous que les blocs de gel d'agar est prêt à l'emploi.
- Anesthésier la souris avec l'isoflurane (1-4% d'isoflurane dans de l'oxygène à l'aide d'un vaporisateur de précision pendant environ 1 min). Il est important de prévenir les dommages hypoxie et donc neuronale. Un inconvénient de l'isoflurane est le coût et la logistique de l'aide vaporisateurs de précision. Une surdose mortelle dans un système ouvert pourrait être une alternative, puisque la souris seront sacrifiées. La sécurité est dans ce cas un sérieux problème. L'isoflurane doit être directement évacué hors de la chambre. Par conséquent, une overdose dans un système ouvert doit être effectuée sous une hotte pour vapeur chimique.
- Euthanasier la souris par décapitation après contrôle de la profondeur de l'anesthésie en testant le réflexe de pied arrière. Ce réflexe pincée pédale ou la patte est effectuée par une patte pincer fermement ou de l'orteil entre ses doigts pour provoquer une réaction de retrait par l'animal. Un animal qui montre un réflexe n'est pas à un niveau chirurgical d'anesthésie et certainement pas dansun état d'euthanasier.
- Après décapitation, couper le cuir chevelu avec une lame de rasoir simple arête centrale dans le sens sagittal, de l'os frontal de la protubérance occipitale externe. Déplacer les deux parties du cuir chevelu, de la première extrémité caudale médiane dans la direction latérale rostrale, puis vers le bas en direction ventrale (figure 1A-C).
- Faire deux latérales et une coupe rostrale dans le foramen magnum avec une paire de ciseaux petit ressort (voir le sens de coupe des flèches noires en pointillés dans la figure 1C). Soigneusement cliver le crâne de mediocaudal à rostrale latérale avec le forceps émoussé (voir larges flèches grises sur la figure 1C). Chez les animaux âgés d'une petite incision à la suture sagittale est utile et souvent nécessaire pour éviter d'endommager les couches corticales du cerveau.
- En ce moment, les os occipital, pariétal et interpariétales doit être détaché. S'il est toujours présente, la dure-mère doit être soigneusement retiré avec une pince pour éviter d'endommager le BRain à l'étape suivante.
- Otez l'os squamosal, le foramen ethmoïdal antérieur et frontal (figure 1D).
- Le cerveau peut désormais facilement être enlevé en utilisant une spatule cuillère inversée micro et couper les nerfs crâniens (figure 1E).
3. Tranchage coupes coronales hypothalamique du cerveau de la souris
- Placer le cerveau, sur sa face ventrale sur une surface résistant à la coupe et enlever le cervelet avec une lame de rasoir bord unique (figure 2A). Cette surface coupe droite sera la base pour le montage du cerveau sur une plaque pour permettre le tranchage des coupes de cerveau coronale.
- Collez le cerveau avec la section coupée sur la plaque de base du microtome (Zeiss, Hyrax V50) en utilisant de faibles quantités d'un durcissement rapide de haute performance de l'adhésif cyanoacrylate colle (Loctite 406, figure 1A). En outre, colle un bloc de 1 cm 3 gélose (voir 1.5) à la face ventrale du cerveau (voir «v» dans Figure 2B) sur le socle du microtome (Zeiss, Hyrax V50) pour supporter et fixer le cerveau tout trancher. Assurez-vous de ne pas utiliser trop de colle, d'échapper à la colle qui traverse entre le cerveau et le bloc de gel causant des problèmes dans l'élimination des tranches de tissu après la coupe. Le bloc de gel se trouve sur le côté opposé de la lame de coupe de microtome (figure 2B).
- Après quelques secondes, le lien a séché, mettre la plaque dans le bain de votre microtome rempli de 6 ° C à froid oxygéné (95% O 2/5% CO 2) solution extracellulaire (voir 1.1).
- Utilisez appropriée à basse vitesse trancher et couper 300 um d'épaisseur. Dans le cas de notre microtome, on utilise une fréquence de 60 Hz, une amplitude de 0,8 mm et une vitesse de 0,8 mm / s (figure 2C). Les tranches de cerveau coronale sont soit recueillies directement après chaque coupe ou peut être laissé dans le bain jusqu'à ce que l'ensemble du cerveau a été sectionnée. Les tranches de cerveau coronale sont soigneusement transfeRRED dans un bécher avec une solution froide extracellulaire oxygéné. Différents outils ont été conçus pour effectuer le transfert (par exemple en plastique coupe large ou pipettes Pasteur en verre ou spatules larges cuillère). Cela dépend de l'expérimentateur qui est préféré. Plus important encore, les tranches doivent être traités de façon appropriée pour minimiser les dommages.
- Si le microtome peut être programmé pour couper des tranches automatiquement, vous pouvez commencer à préparer le Ca 2 + indicateur colorant solution de chargement en ce moment. Dans le cas contraire, il est recommandé que la préparation de cette solution est effectuée avant que le cerveau a pris fin le tranchage de minimiser les délais pour la mesure de Ca 2 + dans les neurones des réponses, à savoir avant de commencer l'étape 2.
4. Préparation du Ca 2 + Indicator Solution de colorant de charge
Une étape cruciale dans les neurones de chargement demeure souvent la santé des cellules qui dépend de la quantité de dommages induits par la vitesse et dela procédure de dissection. Une autre étape essentielle semble être l'utilisation de Pluronic frais F-127 solution (voir 4.1). Il est recommandé de faire cette solution en laboratoire et de ne pas utiliser une solution premade auprès d'un fournisseur. Selon la température, l'humidité et la durée de vie en rayon du Pluronic F-127 solution, nous avons constaté la dégradation des neurones olfactifs et le cerveau au cours de la Ca 2 + chargement procédure.
- Préparer le Pluronic 20% (p / v) F-127 (Sigma) dans du diméthylsulfoxyde (DMSO) par l'addition de Pluronic F-127 de poudre au-dessus de la solution de DMSO. Directement soniquer cette solution sans vortex préalable ou mélange. À moins de 2 min sonication Pluronic F-127 sera dissoute. 100 ul Pluronic F-127 solutions sont préparées chaque semaine.
- Prenez un tube de 50 g de cellules perméables fura-red/AM (Invitrogen, AM, ester acétoxyméthyl) et ajouter 5 ul Pluronic 20% F-127 solution. Mélanger la solution en utilisant la pointe de la pipette.
- Ajouter 45 ul soluti extracellulairele (voir 1.1) pour le mélange et vortex sous peu.
- Ajouter un montant supplémentaire de 325 ul de solution extracellulaire et soniquer le tube pendant 3 min.
- Après sonication ajouter 1,156 ml oxygénée (95% O 2/5% CO 2) solution extracellulaire pour obtenir votre dernière Ca 2 + indicateur de charge de colorant solution (30 fura-red/AM uM, DMSO 0,33% et 0,065% Pluronic F-127) . Stocker le tube dans un endroit sombre jusqu'à son utilisation (voir 4.8).
- Transférer les tranches de cerveau coronale sur une plaque à 6 puits de culture cellulaire (BD Falcon) rempli oxygénée (95% O 2/5% CO 2) solution extracellulaire (jusqu'à six tranches par puits).
- Sucer la solution oxygénée extracellulaire des chambres de la plaque à 6 puits en prenant soin de ne pas endommager les tranches de cerveau.
- Distribuer directement 750 ul de la solution de Ca 2 + indicateur de chargement colorant à chaque puits. Les tranches de cerveau devraient être couverts par la solution contenant fura-red/AM (chargement immersion).
- Incubate les tranches dans un O 2 / CO 2 incubateur de culture cellulaire (O 2: 23,5%; CO 2: 5%) pendant 45 à 60 min à 37 ° C.
- A la fin de la période d'incubation, remplacer le Ca 2 + indicateur colorant solution de chargement par une nouvelle solution extracellulaire oxygénée pour éviter de surcharger les cellules avec du fura-rouge et d'influencer d'une manière subtile le Ca 2 + mesure par l'action de chélation du colorant. Les tranches sont ensuite tenus dans l'O 2 / CO 2 incubateur (voir le point précédent pour les réglages) jusqu'à leur utilisation et sont viables jusqu'à à 3-6 h.
5. Microscopie et analyse
Dans ce protocole, l'intensité de fluorescence de la GFP, qui identifie la cellule d'intérêt, et de la Ca 2 + colorant indicateur est mesuré simultanément dans des tranches de cerveau. Ainsi, le microscope confocal doit être équipé du laser correcte, filtres et deux tubes photomultiplicateurs à collecter les deux emissisur les signaux. GFP et le changement de l'intensité de fluorescence du fura-rouge peut être mesurée à l'aide d'une longueur d'onde d'excitation de 488 nm unique. Émission de fluorescence de fluorophores peuvent être recueillies à l'aide d'un filtre 522/DF35 nm pour la GFP et un filtre passe-haut pour les longueurs d'onde supérieures à 600 nm pour le fura-rouge.
- Pour commencer la surveillance de stimulation induits par des changements dans le signal de fluorescence, qui sont une mesure de la concentration intracellulaire de Ca 2 +, l'une des tranches de cerveau fura-rouges chargés sont transférés à une chambre d'enregistrement (c.-à-Warner Instruments RC-27 Chambre de bain ouverte) qui peut être monté sur l'installation microscope confocal (figure 3A, B).
- Fixez la tranche de cerveau avec une harpe (figure 3C) pour empêcher la tranche à se déplacer en raison de la vitesse de perfusion de la solution de bain (oxygéné solution extracellulaire; voir l'étape 1.1). La harpe (porte-tranche) est constitué d'un réseau parallèle de fils de nylon (séparés les uns des autres par ~ 1 mm) enfilées surune médaille d'argent en forme de U ou le cadre platine. La température de la solution de bain de cette étape devrait être la température ambiante au moins. Si des températures plus élevées, des soins appropriés doit être prise pour éviter la condensation sur les lentilles de microscope et le mouvement du plan de mise en raison du déplacement des pièces dans le microscope.
- Perfuser la tranche pendant 10 min avec une solution extracellulaire oxygénée pour enlever tout excédent de Ca 2 + colorant indicateur. Le débit de la perfusion doit être ajusté à ~ 100 (conseils concernant un système de perfusion appropriée voir 9) pl / s.
- Regardez la tranche à travers le microscope à faible grossissement, prenez note de l'orientation de la tranche pour vos dossiers et trouvez votre domaine d'intérêt dans la tranche, dans notre cas, la zone de l'hypothalamus dans le cerveau.
- Changer à fort grossissement et de trouver la cellule d'intérêt pour la tranche en collectant des images GFP et en même temps contrôler l'intensité de fluorescence du fura-rougesignal (Figure 4A-C). Cellules proches de la surface pourrait être endommagée ou morte. Par conséquent, les cellules situées à une profondeur de plus de 10 um doit être sélectionné pour l'imagerie. Nous pourrions mesurer de manière fiable les cellules jusqu'à une profondeur de 40-50 um, après quoi la force du signal a commencé à baisser. Rappelez-vous que le signal de fura-rouge des cellules au repos avec une faible concentration de Ca 2 + ont rapport des intensités de fluorescence. Cette haute intensité de fluorescence est dans ce cas pas un signe de cellules mortes. Le signal de la GFP peut être utilisé pour détecter une éventuelle dérive ou d'un mouvement de la tranche de tissu ou d'indicateur de changement de pH intracellulaire 10.
- Régler la puissance du laser à une valeur qui permet la mesure de la variation de fura-rouge intensité de fluorescence et empêche la décoloration des deux fluorophores. Par conséquent, commencer par le plus faible puissance laser et ajuster pour obtenir un rapport signal-sur-bruit en changeant le niveau de noir (offset), ouverture de détecteur, le gain et filtre de densité neutre lasers. Sauf pour la puissance du laser, la même chose devrait être fait pour le signal de la GFP.
- Commencer à acquérir des images à des taux compris entre 0,5 - 2 Hz pour recueillir le fura-rouge et les signaux de GFP. Le taux d'acquisition devrait être optimisé pour le taux prévu de le Ca 2 + signal. Voltage-dépendant de Ca 2 + pointes transitoires peuvent causer plus rapides et plus courtes que l'activation de certaines cascades de transduction de signaux qui nécessitent une activation des différents seconds messagers. La longueur de l'acquisition de l'image doit être approprié aux fins de l'expérience. Le signal de la GFP dans le temps permettra de déterminer si un mouvement de la tranche de cerveau s'est produite.
- Lors de l'acquisition et de l'expérience, tous les paramètres de la tête de balayage doivent être maintenus constants à enregistrer des résultats fiables qui peuvent être comparés.
- Les changements dans la fluorescence au cours du temps peut être analysée en utilisant différents programmes de mathématiques, c.-à-ImageJ (NIH, Bethesda, MD, http:/ / Rsb.info.nih.gov / ij /), Igor Pro (Wavemetrics) ou Matlab (The MathWorks). En encerclant le corps cellulaire d'un neurone GFP-étiqueté indiquant la région d'intérêt (ROI), cette région exacte même chose peut être analysé les changements de Ca 2 + en utilisant le signal de fluorescence fura-rouge au fil du temps.
Ca 2 + signaux peuvent être présentées comme unités arbitraires de fluorescence ou en tant que valeurs (AF / F) de la variation relative de l'intensité de fluorescence (AF) normalisée par rapport à la fluorescence de base (F). Cette procédure entraîne une déviation négative lorsque les intracellulaire de Ca 2 + augmentation de la concentration en utilisant le fura-rouge comme le Ca 2 + colorant indicateur. Pour faciliter l'interprétation des résultats, nous recommandons multipliant les valeurs de Af / F avec -1 pour obtenir des résultats positifs signaux de fluorescence pour afficher une hausse de Ca 2 + (figure 4C).
Pour comparer les résultats entre les neurones, l'amplitude et la fréquence du Ca 2 + signaux sont généralement analysées. Pourtant, certains signaux Ca + 2 ne se produit pas avec une période régulière ou amplitudes comparables. Certains signaux peuvent être fortement influencées par des processus stochastiques au sein de la cellule. Ainsi, pour quantifier la variation totale de Ca 2 + dans une cellule donnée et pour permettre la comparaison de Ca 2 + réponses entre les neurones dans différentes régions du cerveau, l'analyse de l'aire sous la courbe (AUC) est plus approprié. Cette mesure de la quantité de Ca 2 + englobe toute initial Ca 2 + transitoires, les deuxièmes phases et soutenue élevées de Ca 2 + des réponses et des oscillations. Dans ce cas, les soins devraient être prises pour analyser la même période de temps pour permettre la comparaison entre les neurones.
6. Les résultats représentatifs
Pour commencer à caractériser récepteur de l'hormone de libération des gonadotrophines (RGnRH) exprimant neurones dans l'hypothalamus nous avons utilisé des souris transgéniques qui expriment la GFP après Cre médiée par excisionsion dans RGnRH-neurones exprimant 4,11. GFP neurones fluorescents ont été identifiés dans différentes zones du cerveau, y compris l'hypothalamus. Pour étudier les propriétés physiologiques de ces neurones RGnRH, nous avons enregistré des signaux Ca 2 + dans les tranches hypothalamiques l'aide d'un microscope confocal. Tout d'abord, nous avons obtenu des tranches de cerveau de ces souris coronales en utilisant le protocole décrit ci-dessus. Figure 1 illustre le besoin d'outils, le matériel et les étapes pour exciser un cerveau de souris. Les coupes coronales du cerveau hypothalamiques ont été coupés (figure 2), puis chargé selon la procédure décrite dans le point 4 du protocole. Tranche de cerveau unique de la zone appropriée sont placés dans une chambre d'enregistrement, fixé avec une harpe (figure 3), puis imagées par un microscope confocal (voir les étapes 5.1 à 5.9). Figure 4 montre un exemple de deux tranches de cerveau coronale individuels d'identification unique corps cellulaires RGnRH-τGFP, la fluorescence au repos après loading la tranche de cerveau avec fura-red/AM et l'image fusionnée confocale indiquant que le neurone GFP avait pris fura-rouge suffisamment pour permettre à l'enquête de stimulation induite par le Ca 2 + des signaux dans ces cellules. En utilisant notre protocole, nous avons d'abord testé si les neurones utilisent RGnRH similaires Ca 2 + pour la détection des signaux de stimulation dans différentes zones de l'hypothalamus en réponse à l'activation directe avec la GnRH (figure 4E). Cependant, ces signaux diffèrent dans leur forme d'onde en fonction de la force de stimulation et 4 zones du cerveau. Afin de quantifier l'évolution de la dynamique des Ca 2 + réponses, l'aire sous la courbe (AUC) peut être calculée comme une mesure de l'augmentation de la concentration intracellulaire de Ca 2 + (figure 4E) 4. Des études sont actuellement en cours pour étudier les bases moléculaires qui sous-tendent les vagues Ca + 2 et des oscillations, leur dépendance sur le sexe et le statut hormonal de l'animal, et si elles peuvent être moduléespar d'autres stimuli naturels.
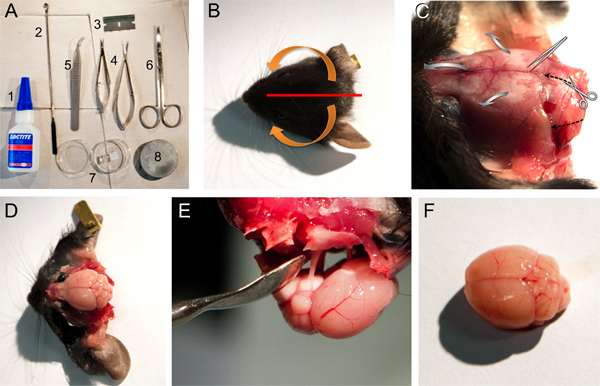
Figure 1. Outils, le matériel et les étapes pour exciser un cerveau de souris. A. Outils et matériaux utilisés pour la dissection du cerveau: 1, Loctite 406 superglue, 2, spatule cuillère micro, 3, seule lame de rasoir, des ciseaux, 4 ressorts de petites et moyennes entreprises; 5, forceps émoussé, 6, 7, ciseaux, boîte de Pétri contenant de la gélose gel de bloc, 8, plaque de base pour le montage dans le cerveau microtome. BF. Images de certaines étapes devraient être décrits au point 2 du protocole. Photo B. d'une tête de souris indiquant la position de découpe du cuir chevelu (ligne rouge) et des flèches (orange) indiquant la direction de la peau doit être retirée de l'os (voir l'étape 2.4). Photographie C. de la tête de la souris après la peau est arrachée montrant les structures osseuses (voir l'étape 2,4). Le sens de coupe des ciseaux et la direction pour rompre le crâne avec les forceps émoussé est indiquée par la couleur noire, soitpointillés flèches ou gris flèches larges, respectivement. Photographie D. du cerveau de souris après avoir éliminé les structures osseuses diverses (voir l'étape 2,5 à 2,7). Photographie E. de l'élimination du cerveau toujours connecté au crâne par l'intermédiaire des nerfs crâniens. Photographie F. d'un cerveau de souris relativement intact.

Figure 2. Le découpage des coupes coronales hypothalamiques du cerveau de souris. A. Photographier indiquant la position de la lame de rasoir bord unique pour éliminer le cervelet (voir l'étape 3,1). B. La position de bloc en gélose par rapport au cerveau collée sur la plaque de base du microtome (voir l'étape 3,2). C. coupe de tranches de cerveau coronale (notons ici l'emplacement du cerveau et des positions du bloc de gel à l'égard de la lame de coupe du microtome; voir l'étape 3.4.). d, dorsale, v, ventrale.

Figure 3. De section de cerveau positionné dans la chambre d'enregistrement. B. A, Vue d'ensemble (A) et un plus fort grossissement (B) d'une Warner Instruments RC-27 chambre de bain enregistrement ouvert donner un large accès aux zones hypothalamiques de la tranche de cerveau coronale (voir étape 5.1). C. harpe métallique en forme de U contenant rangées parallèles de fils de nylon qui possèdent la tranche en position dans la chambre de l'enregistrement (étape 5,2).
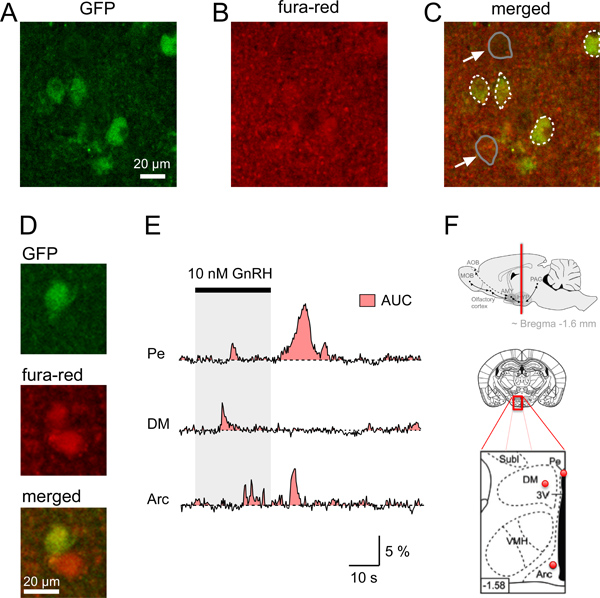
Figure 4. Signaux Ca 2 + dans les neurones τGFP des tranches de cerveau de souris. Hypothalamiques AD. Identification d'un neurone GFP et l'acquisition simultanée de la fluorescence fura-rouge en tranches coronales de cerveau de souris. A. Image confocale d'une tranche de cerveau coronale identifier RGnRH-τGFP neurones (en vert). B. signal de fluorescence relativement uniforme (rouge) de la zone du cerveau montre une observés après le chargement de la tranche de cerveau avec fura-red/AM. C. Fusion image montrant la neurons représenté sur Colorant chargé avec le Ca 2 + indicateur (jaunâtre). Limites de la GFP neurone somata sont indiqués en pointillés blancs, tandis que les exemples de deux non-GFP somata (flèches) sont indiqués dans les lignes grises. D. Exemple de GFP et non-GFP neurone avec des montants plus élevés de fluorescence rouge par rapport à l'arrière-plan. E. Exemples de stimuli somatiques induites par le Ca 2 + réponses individuelles GFP-taggés neurones dans différentes régions du cerveau (hypothalamus Pe, le noyau périventriculaire; DM, l'hypothalamus dorso; Arc, noyau arqué). L'aire sous la courbe (AUC) est représenté par la zone rouge. Le distincte Ca 2 + des signaux entre les neurones exprimant RGnRH de noyaux hypothalamiques différents peuvent être comparés à l'aide de l'AUC comme une estimation de la variation totale de Ca 2 + dans une cellule donnée au cours de la même période. F. dessins schématiques et schéma indiquant l'emplacement des neurones GFP-taggés analysés en AE supérieure du panneau:. Emplacement d'un coronale du cerveau section contenant régions du cerveau hypothalamiques (ligne rouge) Moyen et le panneau inférieur:. Schéma d'une coupe de cerveau (au milieu) et de l'agrandissement de sa zone encadrée rouge (en bas) avec des points rouges indiquant la position approximative des neurones enregistrés GFP-marqués de Pe, DM et de l'Arc montré dans E; zone noire dans le schéma panneau inférieur: 3 ème ventricule. La baisse des diagrammes deux sont adaptés de Paxinos et Franklin 12. Nombre inférieur gauche indique la distance (mm) entre bregma.
Discussion
Une question majeure en neurosciences est de comprendre comment le cerveau traite l'information sociale. Une source prédominante de l'information nécessaire à la reconnaissance sociale est codé par des signaux olfactifs ou phéromones. La détection de ces signaux par des populations neuronales dans le nez et la reconnaissance des signaux dans le cerveau, en particulier l'hypothalamus, jouent un rôle essentiel dans de nombreux processus sociaux et les hormones influencent et d'autres facteurs neuroe...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous remercions nos collègues qui ont participé aux travaux résumés ici. Ce travail a été soutenu par des subventions de la Deutsche Forschungsgemeinschaft (SFB 894), «l'analyse intégrative de l'olfaction» du DFG Schwerpunktprogramm 1392 et par la Fondation Volkswagen (TLZ). TLZ est professeur Lichtenberg de la Fondation Volkswagen.
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Entreprise | Cat. N ° | |
| Gélose | Sigma | A1296 | |
| Fura-red/AM | Invitrogen | F-3021 | |
| Pluronic F-127 | Sigma | P2443 | |
| Le diméthylsulfoxyde | Fisher Scientific | BP231 | |
| Vibrante de la lame de microtome Hyrax V 50 | Zeiss | 9770170 | |
| Dispositif de refroidissement CU 65 pour Microtome Hyrax V 50 | Zeiss | 9920120 | |
| O 2 / CO 2 incubateur, CB210-UL | Liant | 0019389 | |
| Super colle, Loctite 406TM | Henckel | 142580 | |
| Spatules doubles, forme cuillère | Bochem | 3182 | |
| Spatules Microspoon, forme cuillère | Bochem | 3344 | |
| Ciseaux Spring, Moria Vannas-Wolff - Lames 7mm | Outils Fine Science | 15370-52 | |
| Ciseaux Spring, Vannas - Lames 3mm | Outils Fine Science | 15000-00 | |
| Ciseaux Wagner | Outils Fine Science | 14071-12 | |
| Pince médicale, 7b Dumont | Outils Fine Science | 11270-20 | |
| Grande Chambre rectangulaire Open Bath (RC-27) | Warner Instruments | 64-0238 | |
| Confocale Radiance BioRad Microscope 2100 | Zeiss | na |
Références
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon