É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Respostas de imagem de cálcio nos neurônios GFP-tagged fatias de cérebro de rato Hipotalâmicos
Neste Artigo
Erratum Notice
Resumo
Neste protocolo, atualizar o progresso recente na imagem Ca 2 + Sinais de neurónios GFP-tagged em fatias de cérebro de tecido, utilizando um vermelho fluorescente Ca 2 + Corante indicador.
Resumo
Apesar de um aumento enorme no nosso conhecimento sobre os mecanismos subjacentes a codificação de informação no cérebro, a questão central sobre os passos precisos moleculares, bem como a actividade de neurónios específicos em multi-funcional núcleos de áreas cerebrais, tais como o hipotálamo permanecem. Este problema abrange a identificação dos componentes moleculares envolvidos na regulação de vários neuro-hormonais cascatas de transdução de sinal. Elevações de Ca 2 + intracelular desempenham um papel importante na regulação da sensibilidade de neurónios, quer ao nível de transdução de sinal e em locais sinápticos.
Novas ferramentas surgiram para ajudar a identificar os neurónios a miríade de neurónios do cérebro por expressar a proteína fluorescente verde (GFP) sob o controlo de um promotor particular. Para monitorar tanto espacialmente e temporalmente estímulo induzido Ca 2 + respostas em GFP-tagged neurônios, um não-verde fluorescente Ca 2 + indicador corante needs a ser utilizado. Além disso, a microscopia confocal é um método preferido de neurónios individuais de imagem em fatias de tecido devido à sua capacidade de visualizar os neurónios em planos distintos de profundidade dentro do tecido e para limitar fora de foco fluorescente. O Ca 2 + raciométrica indicador fura-2 tem sido utilizado em combinação com GFP-tagged neurônios 1. No entanto, o corante é excitada por luz ultravioleta (UV). O custo do laser e a profundidade de penetração limitada óptico da luz UV pode prejudicar a sua utilização em muitos laboratórios. Além disso, a GFP fluorescente pode interferir com os sinais de fura-2 2. Por isso, decidimos usar um vermelho fluorescente Ca 2 + corante indicador. A mudança Strokes enorme de fura-vermelho permite multicolor análise da fluorescência vermelha em combinação com GFP utilizando um comprimento de onda de excitação único. Tivemos bons resultados anteriormente usando fura-vermelho em combinação com GFP-tagged neurônios olfativos 3. Os protocolos para os cortes de tecidos olfactivos parecia estar a trabalhar eQually bem em neurônios do hipotálamo 4. Fura-vermelho base de Ca 2 + da imagem foram também combinados com sucesso com GFP-tagged β pancreáticas e células GFP-tagged receptores expressos em células HEK 5,6. Uma peculiaridade pouco de fura-vermelho é que a sua intensidade de fluorescência a 650 nm diminui uma vez que o indicador se liga de cálcio 7. Assim, a fluorescência de neurónios de repouso com baixa concentração de Ca + 2 tem intensidade relativamente alta. Note-se, que os outros vermelhos Ca 2 + indicadoras de corantes existem ou estão sendo desenvolvidos atualmente, que poderia dar melhores resultados ou melhores em neurônios e áreas diferentes do cérebro.
Protocolo
1. Preparação da solução de gel de agarose e
- Preparar a solução extracelular de acordo com a tabela, com água bi-destilada. O pH será ~ 7,3 após 10 minutos de arejamento com carbogénio (95% O2 / 5% CO 2), a osmolaridade de 300 mOsm 8. Se um maior osmolaridade é necessário, ele pode ser ajustado pela adição de mais glucose (1 mM é igual a 1 mOsm). A solução é filtrada duas vezes, utilizando um filtro de membrana de 0,2 ^ m a eliminar as partículas de poeira e de possíveis contaminações bacterianas.
| Nome do reagente | Abreviatura | Mol. peso | Conc. | Companhia | Gato. N ° |
| Cloreto de sódio | NaCl | 58,44 g / mol | 120 mM | VWR | 27810 |
| Sódio | NaHCO3 | 84,01 g / mol | 25 mM | Merck | 106329 |
| Cloreto de potássio | KCl | 74,55 g / mol | 5 mM | Merck | 104936 |
| BES * | C 6 H 15 NO S 5 | 213,25 g / mol | 5 mM | Sigma | 14853 |
| Sulfato de magnésio, anidro | MgSO4 | 120,37 g / mol | 1 mM | Sigma | M7506 |
| Di-hidrato de cloreto de cálcio | CaCl * 2H 2 O | 147,02 g / mol | 1 mM | Merck | 102382 |
| D monohidrato de (+)-Glucose | C 6 H 12 O 8 * H 2 O | 198,17 g / mol | 10 mM | Merck | 108342 |
*N, N-Bis (2-hidroxietil)-2-ácido aminoethansulfonic
- A solução é armazenada a 4 ° C, mas deve ser arejada com carbogénio (95% O2 / 5% CO 2) durante 10 min antes da utilização.
- Neste momento, a preparação também 1 cm 3 blocos de gel de agar para estabilizar o cérebro durante o processo de corte (ver etapa 3). Primeiro, dissolve-se 4% (w / v) de agar (Sigma) em água duplamente destilada, aquecendo a solução a aproximadamente 60 ° C. A solução de agar dissolvido aquecida é despejada em uma placa de Petri quadrado a uma altura de 1 cm. Após o arrefecimento e o endurecimento, o gel de agar de 4% é cortado em blocos de 1 cm 3. Estes blocos podem ser armazenados durante mais de 4 semanas a 4 ° C.
2. Dissecção do cérebro do rato
Certifique-se de que todos os procedimentos experimentais em animais são realizados de acordo com as diretrizes estabelecidas pelas comissões de protecção dos animais das respectivas instituições.
- Antes sacrificing o animal, certifique-se os blocos de gel de agar estão prontas para utilização.
- Anestesiar o rato com isoflurano (1-4% de isoflurano em oxigénio utilizando um vaporizador de precisão para cerca de 1 min). É importante para evitar danos e, portanto, a hipoxia neuronal. Uma desvantagem é o custo do isoflurano e logística da utilização de vaporizadores de precisão. Uma overdose fatal em um sistema aberto pode ser uma alternativa, já que o mouse vai ser sacrificado. Segurança no trabalho é, neste caso, uma preocupação séria. O isoflurano deve ser diretamente expelido para fora do quarto. Portanto, uma dose excessiva de um sistema aberto deve ser realizado numa campânula de fumos químicos.
- Eutanásia do rato por decapitação após monitorização da profundidade da anestesia, testando o reflexo do pé traseiro. Este reflexo pitada pedal ou pata é realizada por firmemente beliscar uma pata ou do dedo do pé entre os dedos para eliciar uma resposta de retirada do animal. Um animal que mostra um reflexo não é a um nível cirúrgico de anestesia e definitivamente não emum estado para eutanásia.
- Após a decapitação, cortou o couro cabeludo com uma lâmina de barbear única aresta central no sentido sagital, do osso frontal à protuberância occipital externa. Mover as duas partes do couro cabeludo, em primeiro lugar a partir da extremidade caudal medial na direcção lateral rostral, em seguida, para baixo em direcção ventral (Figura 1A-C).
- Fazer dois laterais e um corte em rostral do forame com uma tesoura pequena mola (ver para o corte de direcção as setas pretas a tracejado na Figura 1C). Cuidadosamente apegar fora do crânio de mediocaudal a rostral lateral com uma pinça sem corte (ver grandes setas cinzas na Figura 1C). Em animais mais velhos, um pequeno corte na sutura sagital é útil e frequentemente necessário para evitar danificar as camadas corticais do cérebro.
- Neste momento, os ossos interparietal, occipital e parietal deve ser destacada. Se ainda estiver presente, a dura-máter devem ser cuidadosamente removidos com pinças para evitar danos no brain no passo seguinte.
- Tire o osso esquamosal, o forame etmoidal e frontal (Figura 1D).
- O cérebro pode agora ser facilmente removido usando um espátula colher invertida micro e cortando os nervos cranianos (Figura 1E).
3. Corte coronal Seções hipotalâmica do cérebro do rato
- Coloque o cérebro do seu lado ventral sobre uma superfície resistente ao corte e remoção do cerebelo com uma única lâmina de barbear borda (Figura 2A). Esta superfície de corte rectilíneo será a base para a montagem do cérebro em uma placa para permitir o corte de secções coronais de cérebro.
- Cola do cérebro com a secção de corte na placa de base do micrótomo (Zeiss, Hyrax V50), utilizando baixas quantidades de uma cura rápida de elevado desempenho adesivo de cianoacrilato supercola (Loctite 406, Figura 1A). Além disso, a cola de 1 cm 3 de um bloco de gel de agar (ver 1.5) no lado ventral do cérebro (ver 'v' em Figura 2B) sobre a placa de base do micrótomo (Zeiss, Hyrax V50) para apoiar e fixar o cérebro, enquanto o corte. Certifique-se de não usar muita cola, para evitar que atravessa cola entre o cérebro eo bloco gel causando problemas na remoção de fatias de tecido após o corte. O bloco de gel será localizado no lado oposto da lâmina de corte a partir do micrótomo (Figura 2B).
- Após alguns segundos, a ligação ter secado, colocar a placa no seu banho de micrótomo cheios de 6 ° C a frio oxigenada (95% O2 / 5% CO 2) solução extracelular (ver 1.1).
- Use baixa velocidade apropriada cortar e cortar 300 mm de espessura. No caso do nosso micrótomo, usamos uma frequência de 60 Hz, uma amplitude de 0,8 mm e uma velocidade de 0,8 mm / s (Figura 2C). As fatias cerebrais coronais são recolhidas directamente ou depois de cada corte ou pode ser deixada no banho até que todo o cérebro foi seccionado. As fatias cerebrais coronais são cuidadosamente transferred para um copo com solução oxigenada fria extracelular. Várias ferramentas foram concebidas para executar a transferência (por exemplo, corte de plástico larga ou pipetas de Pasteur de vidro ou espátulas colher grandes). Ela depende do experimentador, que é o preferido. Mais importante ainda, as fatias devem ser manuseados de forma adequada para minimizar os danos.
- Se o micrótomo pode ser programado para cortar fatias automaticamente, você pode começar a preparar o Ca 2 + indicador solução corante neste momento. De outra forma, recomenda-se que a preparação desta solução é executada antes do cérebro ter terminado o corte para minimizar os atrasos para medir as respostas de Ca 2 + nos neurónios, isto é, antes de iniciar a etapa 2.
4. Preparação do Indicador de Ca 2 + da solução corante
Um passo crítico em neurónios de carga permanece muitas vezes a saúde das células que depende da quantidade de danos induzidos pela ea velocidade deo procedimento de dissecção. Outro passo essencial parece ser a utilização de Pluronic F-127 fresco solução (ver 4.1). Ele tem sido recomendada para tornar esta solução no laboratório e não utilizar uma solução de premade de um fornecedor. Dependendo da temperatura, a humidade e a vida de prateleira do Pluronic F-127, solução observou-se a degradação dos neurónios olfactivos e cérebro durante o Ca 2 + carregamento procedimento.
- Prepare o Pluronic a 20% (w / v) de F-127 (Sigma) em dimetil sulfóxido (DMSO), adicionando o Pluronic F-127 em pó na parte superior da solução de DMSO. Diretamente sonicate esta solução sem vórtice antes ou mistura. Dentro de 2 min sonicação o Pluronic F-127 será dissolvida. 100 ul de Pluronic F-127 soluções são preparadas semanalmente fresco.
- Tomar um tubo de 50 ug de células-permeável fura-red/AM (Invitrogen; AM, éster acetoximetilo) e adicionam-se 5 ul de 20% de Pluronic F-127 de solução. Misturar a solução com a ponta de sua pipeta.
- Adicionar 45 ul soluti extracelular(veja 1.1) à mistura e vortex-lo em breve.
- Adicionar uma solução de 325 ul adicionais extracelular e sonicar o tubo durante 3 min.
- Após sonicação adicionar 1,156 ml oxigenada (95% O2 / 5% CO 2) solução extracelular para obter o seu final de Ca 2 + indicador solução de carga de corante (30 fura-red/AM uM, DMSO 0,33% e 0,065% de Pluronic F-127) . Armazenar o tubo em um lugar escuro, até que uso (ver 4.8).
- Transferir as fatias cerebrais coronais de uma placa de cultura de 6 poços células (BD Falcon) preenchido com uma solução de (95% de O2 / 5% CO 2) oxigenado extracelular (até seis fatias por poço).
- Sugar a solução oxigenada extracelular a partir das câmaras do placa de 6 poços com cuidado para não danificar as fatias de cérebro.
- Pipetar directamente 750 uL do indicador de Ca 2 + solução de corante a cada poço. As fatias de cérebro devem ser cobertos pela solução contendo fura-red/AM (carregamento de imersão).
- Incubatos e as fatias de uma O 2 / CO 2 células incubadora de cultura (O 2: 23,5%; CO 2, 5%) durante 45 a 60 min a 37 ° C.
- No final do tempo de incubação, a substituir Ca 2 + indicador solução corante por solução oxigenado fresco extracelular para evitar a sobrecarga das células com fura-vermelho e influenciar de uma forma subtil o Ca 2 + medida através da acção quelante do corante. As fatias são então sendo mantido no O 2 / CO 2 incubadora (ver ponto anterior para as configurações) até o uso e são viáveis por até 3-6 horas.
5. Microscopia e Análise
Neste protocolo, a intensidade de fluorescência de GFP, a qual identifica a célula de interesse, e do Ca 2 + corante indicador será medido simultaneamente em fatias de cérebro. Assim, o microscópio confocal deve ser equipado com o laser correcta, os filtros e os dois tubos fotomultiplicadores para recolher o emissi doisem sinais. GFP e a alteração na intensidade da fluorescência da fura-vermelho pode ser medida utilizando um comprimento de onda de excitação único de 488 nm. Emissão de fluorescência a partir de fluoróforos podem ser recolhidas utilizando um filtro 522/DF35 nm para GFP e um filtro de passagem longa para comprimentos de onda superiores a 600 nm para o fura-vermelho.
- Para iniciar a monitorização estímulo induzidas alterações no sinal de fluorescência, que são uma medida da concentração intracelular de Ca + 2, um dos fura-vermelhos fatias cerebrais carregados são transferidas para uma câmara de gravação (isto é, Warner Instruments RC-27 Câmara Bath Aberto) que pode ser montado sobre a instalação de microscópio confocal (Figura 3A, B).
- Fixar a fatia do cérebro com uma harpa (Figura 3C), para evitar a fatia para mover devido à velocidade de perfusão da solução de banho (solução extracelular oxigenado; ver passo 1.1). A harpa (detentor fatia) é feito de uma matriz de fios de nylon paralelos (separados uns dos outros por ~ 1 mm) amarradas emuma de prata forma de U ou quadro de platina. A temperatura da solução de banho em que este passo deve ser, pelo menos, à temperatura ambiente. Se as temperaturas mais elevadas são necessárias, o cuidado apropriado tem que ser tomado para evitar a condensação nas lentes do microscópio e do movimento do plano de foco devido a movimentação das peças do microscópio.
- Perfundir a fatia de 10 min com uma solução extracelular oxigenado para remover qualquer excesso de Ca extracelular corante indicador 2 +. A taxa de fluxo de perfusão deve ser ajustada para ~ 100 (pontas a respeito de um sistema de perfusão adequada ver 9) uL / s.
- Olhe para a fatia através do microscópio com pequeno aumento, anote a orientação da fatia de seus registros e descobrir sua área de interesse na fatia, no nosso caso, a área do hipotálamo no cérebro.
- Alterar a alta ampliação e encontrar a célula de interesse na fatia através da recolha de imagens com GFP e, simultaneamente, verificar a intensidade da fluorescência da fura-vermelhosinal (Figura 4A-C). Células perto da superfície pode ser danificado ou morto. Portanto, as células localizadas a uma profundidade de mais do que 10 um deve ser seleccionado para a imagem latente. Poderíamos medir confiavelmente células até uma profundidade de 40-50 um, após o que a força do sinal começou a cair. Lembre-se que o sinal de fura-vermelho de células em repouso com baixa concentração de Ca + 2 tem relação altas intensidades de fluorescência. Esta alta intensidade da fluorescência é neste caso não é um sinal de células mortas. O sinal de GFP pode ser utilizado para detectar qualquer desvio ou movimento da fatia de tecido ou como indicador para as alterações do pH intracelular 10.
- Ajustar a potência do laser para um valor que permite a medição da mudança de fura-vermelho e a intensidade da fluorescência impede branqueamento dos dois fluoróforos. Por conseguinte, começar com a menor potência de laser e ajuste para obter uma razão sinal-para-ruído suficiente, alterando o nível de preto (offset), detector de abertura, o ganho do laser e do filtro de densidade neutras. Exceto para a potência do laser, o mesmo deve ser feito para o sinal de GFP.
- Começa a adquirir imagens com taxas entre 0,5 - 2 Hz para recolher o fura-vermelho e sinais de GFP. A taxa de aquisição deve ser otimizado para a taxa esperada de Ca 2 + sinal. Voltagem-dependente Ca 2 + podem causar picos transientes mais rápidas e mais curto do que a ativação de algumas cascatas de transdução de sinais que requeiram ativação de vários segundos mensageiros. O comprimento da aquisição de imagem deve ser apropriado para o objectivo da experiência. O sinal de GFP ao longo do tempo irá ajudar a determinar se qualquer movimento da fatia cerebral ocorreu.
- Durante a aquisição eo experimento, todas as configurações de digitalização de cabeça tem que ser mantida constante para gravar resultados confiáveis que podem ser comparados.
- As alterações na fluorescência ao longo do tempo podem ser analisados utilizando-se diferentes programas matemáticos, isto é ImageJ (NIH, Bethesda, MD; http:/ / Rsb.info.nih.gov / ij /), Igor Pro (Wavemetrics) ou MatLab (The MathWorks). Cercando o somata de um neurónio GFP-tagged indicando a região de interesse (ROI), esta mesma região pode ser analisado para alterações no Ca2 + utilizando o fura-vermelho do sinal de fluorescência ao longo do tempo.
Ca 2 + os sinais podem ser apresentadas como unidades de fluorescência arbitrárias ou como valores (Af / F) da mudança relativa na intensidade de fluorescência (Af) normalizados para a linha de base de fluorescência (F). Este procedimento resulta em uma deflexão negativa quando os intracelulares de Ca 2 + aumenta de concentração utilizando fura-vermelho como o corante indicador de Ca 2 +. Para facilitar a interpretação dos resultados, recomenda-se multiplicando os valores Af / F com -1 a obter sinais de fluorescência positiva para apresentar um aumento no Ca 2 + (Figura 4C).
Para comparar os resultados entre os neurônios a amplitude e frequência da Ca 2 + sinais são geralmente analisadas. No entanto, alguns sinais de Ca 2 + não ocorrer com um período regular ou amplitudes comparáveis. Alguns sinais pode ser fortemente influenciado por processos estocásticos dentro da célula. Assim, para se quantificar a alteração total no Ca 2 + em uma determinada célula e para permitir a comparação das respostas de Ca 2 + entre os neurónios em diferentes regiões do cérebro, a análise da área sob a curva (AUC) é mais adequada. Esta medida para a quantidade de Ca 2 + engloba qualquer Ca 2 + inicial fases transitórias, segundo elevados e sustentados de Ca 2 + respostas e oscilações. Neste caso, o cuidado deve ser tomado para analisar o mesmo período de tempo para permitir a comparação entre os neurónios.
6. Resultados representativos
Para iniciar a caracterização gonadotrofina receptor do hormônio liberador (GnRHR) expressando neurônios no hipotálamo que uso de camundongos transgênicos que expressam GFP após Cre mediada exciSion em GnRHR expressando neurônios 4,11. Neurônios fluorescentes GFP foram identificados em várias áreas do cérebro, incluindo o hipotálamo. Para investigar as propriedades fisiológicas desses neurónios GnRHR, primeiro gravado Ca 2 + em fatias hipotalâmicas sinais utilizando um microscópio confocal. Em primeiro lugar, foi obtida a partir de fatias de cérebro coronais estes ratos usando o protocolo acima descrito. Figura 1 ilustra a necessidade de ferramentas, materiais e passos para a excisão de um cérebro de rato. As fatias de cérebro hipotalâmicos coronais foram cortadas (Figura 2) e, em seguida, carregada de acordo com as etapas do ponto 4 do protocolo. Fatia cerebral único da área apropriada são colocados numa câmara de registo, fixada com um harpa (Figura 3) e, em seguida, fotografada utilizando um microscópio confocal (ver passos 5,1-5,9). A Figura 4 mostra um exemplo de dois individuais fatias cerebrais coronais de identificação único GnRHR-τGFP corpos celulares, a fluorescência em repouso após loading a fatia de cérebro com fura-red/AM e a imagem mesclada confocal indicando que o neurónio GFP tinham tomado fura-vermelho suficientemente para permitir que a investigação do estímulo induzido por Ca 2 + os sinais nessas células. Usando nosso protocolo inicialmente testado se os neurônios utilizam GnRHR semelhantes Ca 2 + para a detecção de sinais de estímulo em diferentes áreas do hipotálamo em resposta à ativação direta com GnRH (Figura 4E). No entanto, estes sinais diferem na sua forma de onda de acordo com a força do estímulo e 4 área do cérebro. Para quantificar a alteração na dinâmica das duas respostas de Ca +, a área-sob-a-curva (AUC) pode ser calculado como uma medida para o aumento do Ca 2 + intracelular (Figura 4E) 4. Estudos estão em andamento para investigar a base molecular subjacente aos Ca 2 + e ondas oscilações, sua dependência de sexo e status hormonal do animal, e se eles podem ser moduladapor outros estímulos naturais.
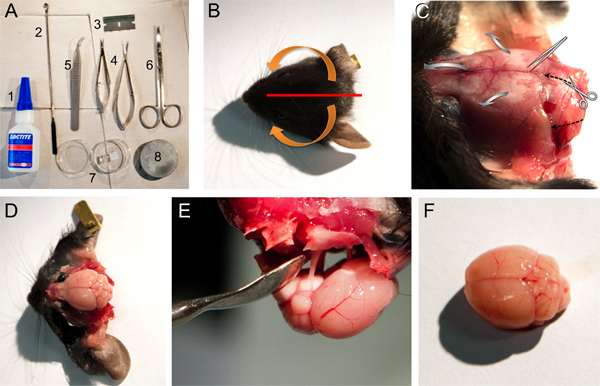
Figura 1. Ferramentas de material, e as etapas para extirpar um cérebro de camundongo. A. Ferramentas e materiais utilizados para dissecação do cérebro: 1, Loctite Super Bonder 406, 2, espátula colher micro, 3, lâmina de barbear única aresta, 4, tesoura pequena mola e médias empresas; 5, pinças contundentes, 6, tesouras, 7, placa de petri contendo agar gel bloco, 8, placa de base para montagem no cérebro micrótomo. BF. Imagens de alguns passos a serem descritos no ponto 2 do protocolo. B. A fotografia de uma cabeça de rato, indicando a posição de corte do couro cabeludo (linha vermelha) e setas (laranja) indicando a direção a pele deve ser puxado para fora do osso (ver passo 2.4). C. Fotografia da cabeça de rato depois que a pele é puxada para fora mostrando as estruturas ósseas (ver passo 2.4). Direcção de corte da tesoura e da direcção para a ruptura aberta do crânio com a pinça sem corte é indicado tanto com o pretotracejada setas ou cinza setas largas, respectivamente. D. Fotografia do cérebro do rato depois de eliminar as estruturas ósseas diferentes (veja o passo 2,5-2,7). E. Fotografia da remoção do cérebro ainda ligado ao crânio através dos nervos cranianos. F. A fotografia de um cérebro de camundongo relativamente intacta.

Figura 2. Coronais corte de seções hipotálamo do cérebro do rato. A. Fotografar que indica a posição da lâmina da navalha único para eliminar o cerebelo (ver passo 3.1). B. Posição do bloco de gel de agar em relação ao cérebro colado na placa de base do micrótomo (ver passo 3.2). C. corte da fatia cerebral coronal (note aqui a localização do cérebro e posições gel bloco em relação à lâmina de corte do micrótomo; veja o passo 3.4.). d, dorsal; v, ventral.

Figura 3. Fatia cerebral posicionado na câmara de gravação. A, B. Visão geral (A) e uma ampliação maior (B) de um Instruments RC-27 Warner câmara de registo aberto banho dando amplo acesso a áreas do hipotálamo da fatia cerebral coronal (ver passo 5.1). Harpa de metal em forma de U C. contendo disposições paralelas de fios de nylon, que detêm a fatia na posição na câmara de gravação (veja o passo 5.2).
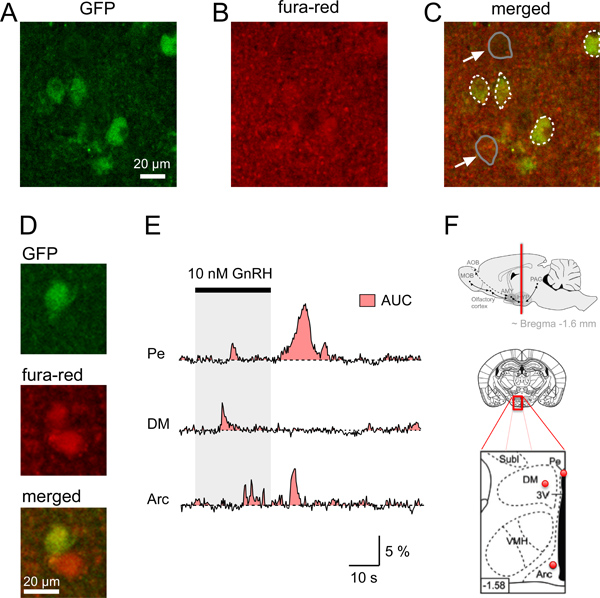
Figura 4. Ca 2 + sinais em neurônios τGFP de fatias de cérebro de rato. Hipotalâmicos AD. Identificação de um neurónio GFP e aquisição simultânea da fluorescência fura-vermelho em fatias de cérebro de rato coronais. A. imagem confocal de uma fatia do cérebro coronal identificar GnRHR-τGFP neurônios (verde). B. sinal relativamente uniforme de fluorescência (vermelho) de a área do cérebro mostra a observada após o carregamento de uma fatia do cérebro com fura-red/AM. C. Merged imagem mostrando a neunios descrito em A carregada com o Ca 2 + corante indicador (amarelada). Limites da GFP neurónio somata são indicadas em linhas tracejadas brancas, ao passo que exemplos de dois somata não-GFP (setas) são indicadas em linhas a cinzento. D. Exemplo de uma GFP e GFP não-neuronal com maiores quantidades de fluorescência vermelha em comparação com o fundo. E. Exemplos de estímulo somático induzida pelo Ca 2 + respostas individuais GFP-tagged neurônios em diferentes áreas do cérebro (hipotálamo Pe núcleo periventricular, hipotálamo, DM dorsomedial; Arc, núcleo arqueado). Área-sob-a-curva (AUC) é representada pela área vermelha. O distinto de Ca 2 + os sinais entre os neurónios que expressam GnRHR de núcleos hipotalâmicos diferentes podem ser comparados utilizando a AUC como uma estimativa para a variação total de Ca2 + numa célula de dados durante o mesmo período. Desenhos esquemáticos e F. diagrama indicando a localização dos neurónios GFP-tagged analisados no painel superior AE:. Localização de um coronal do cérebro sexão contendo regiões do cérebro hipotalâmicos (linha vermelha) médio e inferior do painel:. Desenho esquemático de uma fatia do cérebro (meio) e de ampliação de sua área vermelha em caixa (painel inferior) com pontos vermelhos indicando a posição aproximada dos neurônios registrados GFP-marcadas a partir o Pe, DM e Arc mostra a E; área preta no esquema painel inferior: 3 º ventrículo. Menores dois diagramas são adaptadas de Paxinos e Franklin 12. Número canto inferior esquerdo indica a distância (mm) de Bregma.
Discussão
Uma questão importante em neurociência é compreender como o cérebro processa a informação social. A principal fonte de informações necessárias para o reconhecimento social é codificada por sinais olfativos ou pheromonal. A detecção destes sinais por populações neuronais no nariz e ao reconhecimento dos sinais no cérebro, especialmente o hipotálamo, desempenham um papel fundamental em muitos processos sociais e de hormonas e de outros factores de influência neuroendócrinos 13-16. Um obstácul...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos aos nossos colegas que participaram do trabalho aqui resumidas. Este trabalho foi financiado por doações do Deutsche Forschungsgemeinschaft (SFB 894), "análise integrativa do olfato" o DFG Schwerpunktprogramm 1392 e pela Fundação Volkswagen (TLZ). TLZ é professor Lichtenberg da Fundação Volkswagen.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Companhia | Gato. N ° | |
| Agar | Sigma | A1296 | |
| Fura-red/AM | Invitrogen | F-3021 | |
| Pluronic F-127 | Sigma | P2443 | |
| Dimetilsulfóxido | Fisher Scientific | BP231 | |
| Vibratório-Blade Microtome Hyrax V 50 | Zeiss | 9770170 | |
| Dispositivo de arrefecimento CU 65 para Micrótomo Hyrax V 50 | Zeiss | 9920120 | |
| O 2 / CO 2 Incubadora, CB210-UL | Encadernador | 0019389 | |
| Super cola, Loctite 406TM | Henckel | 142580 | |
| Espátulas duplas, forma colher | Bochem | 3182 | |
| Espátulas Microspoon, forma colher | Bochem | 3344 | |
| Tesoura de mola, Moria-Vannas-Wolff - Lâminas 7 milímetros | Belas Science Tools | 15370-52 | |
| Tesoura de mola, Vannas - Lâminas 3 milímetros | Belas Science Tools | 15000-00 | |
| Wagner Tesoura | Belas Science Tools | 14071-12 | |
| Médico Fórceps, 7b Dumont | Belas Science Tools | 11270-20 | |
| Câmara de banho grande retangular Aberto (RC-27) | Warner Instruments | 64-0238 | |
| Radiance BioRad Confocal Microscope 2100 | Zeiss | nd |
Referências
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados