Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изображениями кальция Ответы на GFP с метками нейроны гипоталамуса фрагменты мозга мыши
В этой статье
Erratum Notice
Резюме
В этом протоколе, мы обновляем последние достижения в области обработки изображений Ca 2 + Сигналы GFP с метками нейронов в мозговой ткани срезов при использовании красного флуоресцентного Са 2 + Индикатор красителя.
Аннотация
Despite an enormous increase in our knowledge about the mechanisms underlying the encoding of information in the brain, a central question concerning the precise molecular steps as well as the activity of specific neurons in multi-functional nuclei of brain areas such as the hypothalamus remain. This problem includes identification of the molecular components involved in the regulation of various neurohormone signal transduction cascades. Elevations of intracellular Ca2+ play an important role in regulating the sensitivity of neurons, both at the level of signal transduction and at synaptic sites.
New tools have emerged to help identify neurons in the myriad of brain neurons by expressing green fluorescent protein (GFP) under the control of a particular promoter. To monitor both spatially and temporally stimulus-induced Ca2+ responses in GFP-tagged neurons, a non-green fluorescent Ca2+ indicator dye needs to be used. In addition, confocal microscopy is a favorite method of imaging individual neurons in tissue slices due to its ability to visualize neurons in distinct planes of depth within the tissue and to limit out-of-focus fluorescence. The ratiometric Ca2+ indicator fura-2 has been used in combination with GFP-tagged neurons1. However, the dye is excited by ultraviolet (UV) light. The cost of the laser and the limited optical penetration depth of UV light hindered its use in many laboratories. Moreover, GFP fluorescence may interfere with the fura-2 signals2. Therefore, we decided to use a red fluorescent Ca2+ indicator dye. The huge Stokes shift of fura-red permits multicolor analysis of the red fluorescence in combination with GFP using a single excitation wavelength. We had previously good results using fura-red in combination with GFP-tagged olfactory neurons3. The protocols for olfactory tissue slices seemed to work equally well in hypothalamic neurons4. Fura-red based Ca2+ imaging was also successfully combined with GFP-tagged pancreatic β-cells and GFP-tagged receptors expressed in HEK cells5,6. A little quirk of fura-red is that its fluorescence intensity at 650 nm decreases once the indicator binds calcium7. Therefore, the fluorescence of resting neurons with low Ca2+ concentration has relatively high intensity. It should be noted, that other red Ca2+-indicator dyes exist or are currently being developed, that might give better or improved results in different neurons and brain areas.
протокол
1. Приготовление раствора и в агарозном геле
- Подготовка внеклеточной решение в соответствии с таблицей с двойным дистиллированной воды. РН будет ~ 7,3 через 10 мин аэрации с карбогена (95% O 2/5% CO 2), осмолярность 300 мосм 8. Если выше осмолярность не требуется, его можно регулировать, добавляя больше глюкозы (1 мМ равна 1 мосм). Раствор фильтруют дважды, используя 0,2 мкм мембранный фильтр для устранения пыли и возможного бактериального загрязнения.
| Название реагента | Сокращение | Мол. вес | Конц. | Компания | Кат. N ° |
| Хлористый натрий | NaCl | 58,44 г / моль | 120 мМ | VWR | 27810 |
| Натрия гидрокарбонат | NaHCO 3 | 84,01 г / моль | 25 мМ | Merck | 106329 |
| Хлористый калий | KCl | 74,55 г / моль | 5 мМ | Merck | 104936 |
| BES * | C 6 H 15 NO 5 S | 213,25 г / моль | 5 мМ | Сигма | 14853 |
| Сульфат магния, безводный | MgSO 4 | 120,37 г / моль | 1 мМ | Сигма | M7506 |
| Дигидрата хлорида кальция | CaCl * 2H 2 O | 147,02 г / моль | 1 мМ | Merck | 102382 |
| D (+)-Глюкоза моногидрат | C 6 H 12 O 8 * H 2 O | 198,17 г / моль | 10 мМ | Merck | 108342 |
*N, N-бис (2-гидроксиэтил)-2-aminoethansulfonic кислоты
- Раствор хранят при 4 ° C, но должна быть газированной с карбогена (95% O 2/5% CO 2) в течение 10 минут перед использованием.
- В это время подготовить и 1 см 3 блоков агар гель для стабилизации мозга во время резки процедуры (см. шаг 3). Во-первых, растворить 4% (вес / объем) агар (Sigma) в дважды дистиллированной воде при нагревании раствора примерно до 60 ° C. Нагретая агара растворяют раствор выливают в чашку Петри площадь на высоте 1 см. После охлаждения и затвердевания, 4% геле агара разрезают на блоки 1 см 3. Эти блоки могут быть сохранены в течение 4 недель при температуре 4 ° C.
2. Препарирование мозга мыши
Пожалуйста, убедитесь, что все животные экспериментальные процедуры выполняются в соответствии с руководящими принципами, установленными животных комитетов соответствующих учреждений.
- Перед SACRificing животное, убедитесь, что блоки гель агара готовы к использованию.
- Anesthetize мыши с изофлурана (1-4% изофлурана в кислороде, используя точность испарителя в течение примерно 1 мин). Это важно для предотвращения гипоксии и, следовательно, повреждению нейронов. Недостатком изофлуран стоимость и материально-технического обеспечения с использованием высокоточных испарители. Смертельной передозировки в открытой системе может быть альтернативой, так как мыши будут принесены в жертву. Охрана труда и безопасность в этом случае вызывает серьезную озабоченность. Изофлурана должны быть непосредственно вентилироваться из комнаты. Таким образом, передозировка в открытой системе должна быть выполнена в химическом вытяжном шкафу.
- Усыпить мыши путем обезглавливания после мониторинга глубины анестезии при тестировании рефлекса задних ног. Этот рефлекс педали или лапу щепотку осуществляется крепко зажимая лапы или ноги между пальцами, чтобы вызвать вывода ответа животного. Животное, которое показывает рефлекс не на уровне хирургической анестезии и определенно не всостоянии усыпить.
- После обезглавливания, разрезать кожу головы с одним лезвием края централизованно в сагиттальном направлении, от лобной кости к внешним затылочного бугра. Переместите две части кожи головы, первый из медиальной хвостового конца в ростральной поперечном направлении, затем вниз в направлении вентральной (рис. 1А-C).
- Сделайте две боковые и одна ростральной сокращение затылочного отверстия с небольшим ножницами весной (см. для резки направлении черной пунктирными стрелками на рис 1С). Осторожно расщеплять от черепа из mediocaudal к боковым ростральной с тупым пинцетом (см. широкие серые стрелки на рисунке 1С). В старых животных небольшой разрез на сагиттального шва является полезным и часто необходимо, чтобы избежать повреждения слоев коры головного мозга.
- В этот момент затылочной, interparietal и теменных костей должна быть отсоединена. Если еще присутствует, твердой мозговой оболочки должна быть тщательно удалены с помощью щипцов, чтобы предотвратить повреждение брайн в следующем шаге.
- Уберите чешуйчатой кости, передней решетчатой и лобной отверстия (рис. 1D).
- Мозг теперь могут быть легко удалены с помощью перевернутого микро-шпатель ложку и отделяя черепных нервов (рис. 1E).
3. Нарезка Корональные гипоталамуса разделы мозга мыши
- Поместите мозга на его вентральной стороне на порезостойкие поверхности и удаления мозжечка с одним лезвием бритвы края (рис. 2A). Это прямая поверхность разреза будет основой для монтажа головного мозга на тарелку чтобы нарезка корональных разделов мозга.
- Клей мозга с разрезом раздел на плите из микротома (Zeiss, Hyrax V50) с использованием малых количеств быстрого отверждения высокой производительности цианакрилатный клей суперклей (Loctite 406; рис. 1А). Кроме того, клей 1 см 3 геле агара блока (см. п. 1.5) на вентральной стороне мозга (см. 'V' в Рисунок 2B) на опорной плите из микротома (Zeiss, Hyrax V50), чтобы поддержать и закрепить мозга в то время как нарезка. Убедитесь в том, чтобы не использовать слишком много клея, чтобы обойти этот клей проходит между мозгом и гель блоков вызывает проблемы при удалении срезы тканей после разреза. Гель блок будет расположен на противоположной стороне лезвия из микротома (рис. 2В).
- Через несколько секунд связь высохнет, положите пластину в ванну вашей микротома заполнен 6 ° C холодным кислородом (95% O 2/5% CO 2) внеклеточной решение (см. 1.1).
- Используйте соответствующие низкой скорости нарезки и нарезать толщиной 300 мкм ломтиками. В случае, если наши микротома, мы используем частотой 60 Гц, амплитудой 0,8 мм и скоростью 0,8 мм / с (рис. 2). Корональной кусочков мозга, либо собранные непосредственно после каждого пореза или можно оставить в ванной, пока весь мозг был разрез. Корональной кусочков мозга тщательно transferred в стакан с холодным кислородом внеклеточной решение. Различные инструменты были разработаны, чтобы выполнить передачу (например, сокращение широкой пластиковой или стеклянной пипетки Пастера или широкий шпатель ложка). Это зависит от экспериментатора который является предпочтительным. Самое главное, что кусочки должны быть обработаны соответствующим образом минимизировать ущерб.
- Если микротома может быть запрограммирована на автоматическое нарезать кусочками, можно начинать готовить Ca 2 + индикатор загрузки красителя решение на данный момент. В противном случае, рекомендуется, что подготовка этого решения выполняется до мозга нарезки закончился свести к минимуму задержки для измерения Ca 2 + ответы в нейронах, а именно перед началом шага 2.
4. Подготовка Ca 2 + раствора индикатора загрузки краска
Важным шагом в загрузке нейронов остается часто на здоровье клеток, которые зависят от количества повреждений, вызванных и скоростьвскрытие процедуры. Другим важным шагом представляется использование свежих Pluronic F-127 решения (см. 4.1). Она в настоящее время рекомендуется делать это решение в лаборатории, а не использовать готовые решения от поставщика. В зависимости от температуры, влажности и шельфа жизни Pluronic F-127 решение, мы отметили ухудшение обоняния и нейронов головного мозга во время Ca 2 + процедура загрузки.
- Подготовьте 20% (вес / объем) Pluronic F-127 (Sigma) в диметилсульфоксид (ДМСО), добавив Pluronic F-127 порошок на верхней части растворе ДМСО. Непосредственно разрушать ультразвуком это решение без предварительной вихрь или перемешивания. В течение 2 мин ультразвуком Pluronic F-127 будет распущен. 100 мкл Pluronic F-127 растворы готовят свежую раз в неделю.
- Принимать по одной трубе 50 мкг клеточной проницаемой fura-red/AM (Invitrogen; AM, ацетоксиметил эфир) и добавить 5 мкл 20% Pluronic F-127 решение. Смешайте решение с помощью кончика пипетки.
- Добавить 45 мкл внеклеточной solutiна (см. п. 1.1) в смесь и вихревые это в ближайшее время.
- Добавить еще 325 мкл внеклеточный раствор и разрушать ультразвуком трубку в течение 3 мин.
- После обработки ультразвуком добавить 1,156 мл кислородом (95% O 2/5% CO 2) внеклеточной решение, чтобы получить окончательное Ca 2 + индикатор загрузки красителя решения (30 мкМ fura-red/AM, 0,33% ДМСО и 0,065% Pluronic F-127) . Храните трубу в темное место до использования (см. 4.8).
- Передача короны кусочки мозга 6-а культура клеток пластины (BD Falcon), заполненный кислородом (95% O 2/5% CO 2) внеклеточный раствор (до шести ломтиков на лунку).
- Отсасывать кислородом внеклеточный раствор из палат 6-луночный планшет, стараясь не повредить мозг ломтиками.
- Внесите 750 мкл непосредственно Са 2 + индикатор загрузки красителя решение в каждую лунку. Срезах мозга должны быть покрыты раствором, содержащим fura-red/AM (погружение нагрузки).
- Incubatе ломтики в O 2 / CO 2 инкубаторе культуры клеток (O 2: 23,5%; CO 2: 5%), от 45 до 60 мин при 37 ° C.
- В конце инкубационного периода, заменить Ca 2 + индикатор загрузки красителя решение по свежим кислородом внеклеточной решение, чтобы предотвратить перегрузку клеток с фура-красный и влияния в тонкий способ Ca 2 + измерения с помощью действий хелатирующие на красителе. Ломтиками, затем держат в O 2 / CO 2-инкубаторе (см. предыдущий пункт для настройки) до использования и являются жизнеспособными в течение 3-6 часов.
5. Микроскопии и анализа
В этом протоколе, интенсивность флуоресценции GFP, который определяет ячейку интерес, и Са 2 + индикатор краситель будет измеряться одновременно в срезах мозга. Таким образом, конфокальной микроскопии должны быть оборудованы правильный лазер, фильтры и две трубки фотоумножителя собрать два emissiна сигналы. GFP и изменение интенсивности флуоресценции фура-красный может быть измерена с помощью одной длине волны возбуждения 488 нм. Выбросы флуоресценции от флуорофоров могут собираться с помощью 522/DF35 нм фильтр для GFP и длинный фильтр для длин волн больше 600 нм для фура-красный.
- Чтобы начать мониторинг стимул-индуцированные изменения в сигнал флуоресценции, которые являются мерой внутриклеточные концентрации Са 2 +, одна из фура-красный загруженных кусочки мозга передается в записи камеры (т.е. Warner Instruments RC-27 с открытой камерой Bath) , который может быть установлен на конфокальной микроскопии установки (рис. 3а, б).
- Закрепить среза мозга с арфой (рис. 3), чтобы предотвратить срез двигаться из-за перфузии скорость ванну решение (окисленные внеклеточной решение; см. п. 1.1). Арфа (часть держателя) изготовлен из массива параллельных нейлоновых нитей (отделены друг от друга на ~ 1 мм), нанизанные насеребро U форме или платины кадра. Температура воды в ванне решение на этот шаг должен быть по крайней мере комнатной температуре. Если требуются более высокие температуры, соответствующее внимание должно быть принято, чтобы предотвратить образование конденсата на линзах микроскопа и движения плоскости фокуса из-за смещения деталей в микроскоп.
- Заливать срез в течение 10 мин с кислородом внеклеточный раствор для удаления излишков внеклеточной Ca 2 + краситель индикатор. Расход перфузии должны быть скорректированы до ~ 100 мкл / с (советы относительно соответствующей системы перфузии см. 9).
- Посмотрите на срез под микроскопом при малом увеличении, обратите внимание на ориентацию среза для ваших записей и найти интересующую вас область в срезе, в нашем случае гипоталамической области головного мозга.
- Изменения к большим увеличением и найти ячейку интерес в срезе по сбору GFP изображений и одновременно проверяя интенсивность флуоресценции фура-красныйсигнал (рис. 4A-C). Клетки вблизи поверхности могут быть повреждены или мертвым. Таким образом, клетки, расположенные на глубине более 10 мкм должна быть выбрана для работы с изображениями. Мы могли бы надежно измерить клетки до глубины 40-50 мкм, после чего мощность сигнала начал падать. Помните, что фура-красный сигнал клеток в состоянии покоя с низкой концентрации Са 2 + имеют относительно высокой интенсивности флуоресценции. Такая высокая интенсивность флуоресценции в данном случае не является признаком мертвых клеток. Сигнал GFP может быть использован для обнаружения дрейфа или движение ткани ломтик или в качестве индикатора для изменения внутриклеточного рН 10.
- Регулировка мощности лазера до значения, что позволяет проводить измерения в изменении фура-красной флуоресценции и предотвращает обесцвечивание двух флуорофоров. Таким образом, начать с самой низкой мощности лазера и настроить для получения достаточной сигнал-шум за счет изменения уровня черного (смещение), детектор диафрагмы, усиления и лазерной фильтр нейтральной плотностис. Кроме мощность лазера, то же самое должно быть сделано для сигнала GFP.
- Начать получать изображения со скоростью от 0,5 - 2 Гц для сбора фура-красный и GFP сигналов. Приобретение ставка должна быть оптимизирована с ожидаемой скоростью Ca 2 + сигнал. Потенциал-зависимых Са 2 + шипами может привести к быстрым и коротким переходным, чем активация некоторых каскадов передачи сигнала требует активации различных вторичных мессенджеров. Длина захвата изображения должны соответствовать цели эксперимента. GFP сигнала во времени поможет определить, есть ли движение среза мозга не произошло.
- Во время приобретения и эксперимент, все настройки сканирования головы должны быть постоянными для записи надежных результатов, которые могут быть сопоставлены.
- Изменения в флуоресценции с течением времени могут быть проанализированы с помощью различных математических программ, т.е. ImageJ (NIH, Bethesda, MD; HTTP:/ / Rsb.info.nih.gov / ц /), Игорь Pro (Wavemetrics) или MatLab (MathWorks). По окружающих somata из GFP с метками нейрона с указанием область интереса (ROI), это точно такой же регионе могут быть проанализированы изменения в Ca 2 + использование фура-красного флуоресцентного сигнала с течением времени.
Ca 2 + сигналы могут быть представлены в виде произвольных единицах флуоресценции или значения (f / F) относительного изменения интенсивности флуоресценции (ΔF), нормированная к базовому флуоресценции (F). Эта процедура приводит к отрицательным отклонением, когда внутриклеточные концентрации Са 2 + увеличивает использование фура-красные, как Ca 2 + краситель индикатор. Чтобы облегчить интерпретацию результатов, мы рекомендуем умножения f / F значений от -1 до получения положительных сигналов флуоресценции для отображения рост Ca 2 + (рис. 4в).
Для сравнения результатов между нейронами амплитуды и частоты Ca 2 + сигналы обычно анализируются. Тем не менее, некоторые Ca 2 + сигналы не происходят с регулярной период или сопоставимой амплитуды. Некоторые сигналы могут быть под сильным влиянием случайных процессов внутри клетки. Таким образом, для количественной оценки общего изменения Ca 2 + в данной клетке и дать возможность сравнения Ca 2 + ответы между нейронами в различных регионах мозга, анализ площади под кривой (AUC) является более целесообразным. Эта мера на сумму Ca 2 + включает в себя любые начальные Ca 2 + преходящее, второй фаз и устойчивый повышенный Ca 2 + ответы и колебания. В этом случае следует позаботиться, чтобы проанализировать тот же период времени для того, чтобы сравнение между нейронами.
6. Представитель Результаты
Для начала характеризующих гонадотропин-рилизинг-гормон-рецептор (GnRHR), выражающая нейронов в гипоталамусе мы использовали трансгенных мышей, экспрессирующих GFP после Cre-опосредованной возбужденияния в GnRHR-экспрессирующих нейронов 4,11. GFP флуоресцентные нейроны были обнаружены в различных областях мозга, включая гипоталамус. Для изучения физиологических свойств этих GnRHR нейронов, мы сначала записали Ca 2 + сигналы в гипоталамус ломтики помощью конфокальной микроскопии. Во-первых, мы получили корональной кусочков мозга от этих мышей с использованием описанного выше протокола. Рисунке 1 показаны необходимые инструменты, материалы и шаги для вырезания мозга мыши. Корональных гипоталамус ломтики мозга были сокращены (рис. 2), а затем загружаются в соответствии с шагами в пункте 4 протокола. Одноместный срез мозга соответствующей области помещаются в записи камеры, крепится с арфой (рис. 3), а затем отображаемого помощью конфокальной микроскопии (см. шаги 5.1-5.9). Рисунок 4 показывает пример двух отдельных корональных ломтики мозга установления единых GnRHR-τGFP клеточных тел, флуоресценции на отдых после Loadinг среза мозга с fura-red/AM и объединенный конфокальной изображения о том, что GFP нейрона заняли фура-красные достаточно включить исследование стимул-индуцированной Ca 2 + сигналов в этих клетках. Используя наши протокола мы изначально проверяли, действительно ли GnRHR нейроны используют похожие Ca 2 + сигналов для обнаружения стимула в различных областях гипоталамуса в ответ на прямой активации с ГнРГ (рис. 4E). Тем не менее, эти сигналы отличаются по своим сигнала в зависимости от силы раздражителя и 4 области мозга. Для количественной оценки изменений в динамике Ca 2 + ответы, площади под кривой (AUC) может быть рассчитана как мера для увеличения внутриклеточного Ca 2 + (рис. 4E) 4. Исследования осуществляются в настоящее время для исследования молекулярной основы, лежащие в основе Ca 2 + волн и колебаний, их зависимости от пола и гормонального статуса животных, и могут ли они быть модулированнымдругие природные раздражители.
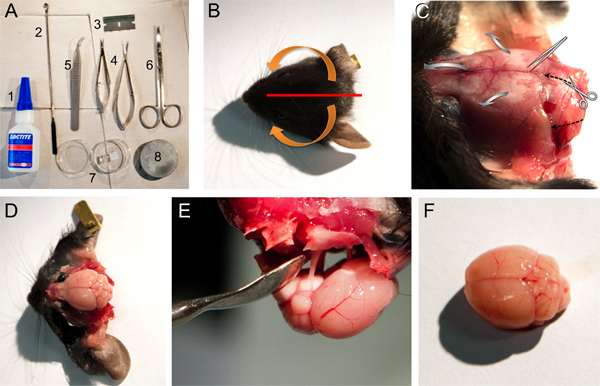
Рисунок 1. Инструменты, материалы и шаги для вырезания мозга мыши. A. Инструменты и материалы, используемые для рассечения мозга: 1, Loctite 406 клей, 2, микро шпателем ложки, 3, одно лезвие края, 4, малый и средний ножницы весной, 5, тупой пинцет, 6, ножницы, 7, чашки Петри, содержащей агар Гель блоков, 8, базовая пластина для монтажа мозга в микротоме. BF. Изображения некоторые шаги, описанные в пункте 2 протокола. B. Фотография мышь головы с указанием позиции резки волосистой части головы (красная линия) и стрелки (оранжевый), указывающий направление кожу следует оторвалась от кости (см. п. 2.4). С фотографией мыши головой после кожи оторвался показывает костных структур (см. п. 2.4). Резка направление ножниц и направление за нарушение открытой череп с тупой пинцет указывается либо с чернымпунктирными стрелками или серые широкие стрелки, соответственно. D. Фотография мозга мышей после устранения различных костных структур (см. шаг 2,5 - 2,7). Е. Фотография вынос мозга по-прежнему подключен к черепу через черепных нервов. F. Фотография относительно неповрежденный мозг мыши.

Рисунок 2. Нарезка из корональных участков гипоталамуса головного мозга мыши. A. Сфотографируйте, указывающие положение одним лезвием бритвы края для устранения мозжечка (см. п. 3.1). В. Позиция гель агара блока по отношению к мозгу наклеиваются на плиту из микротома (см. п. 3.2). C. резки корональных срез головного мозга (отметим здесь расположение головного мозга и гель блок должности в связи с лезвием из микротома, см. шаг 3.4.). г спины, V, вентральный.

Рисунок 3. Среза мозга расположены в записи камеры., B. Обзор (А) и большим увеличением (B) из Warner Instruments RC-27 с открытой камерой запись ванна дает широкий доступ к гипоталамической области корональных срез головного мозга (см. п. 5.1). С U-образной металлической арфы содержащие параллельные массивы из нейлона темы, которые будет проводить срез в положении в записи камеры (см. п. 5.2).
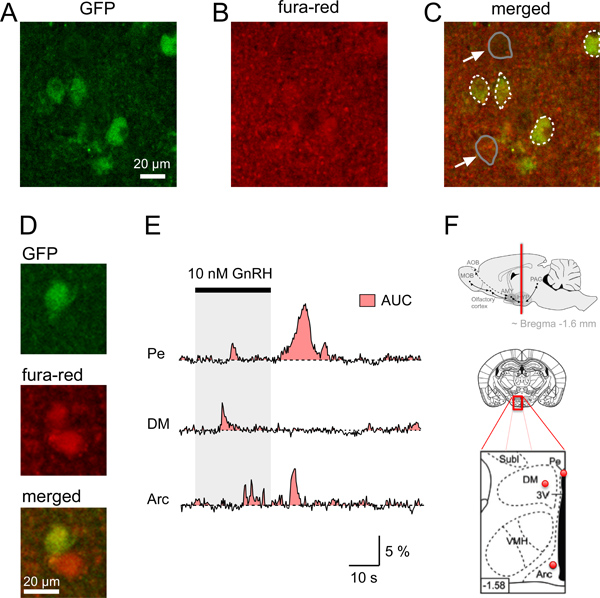
Рисунок 4. Ca 2 + сигналов в τGFP нейронов гипоталамуса мыши кусочки мозга. Нашей эры. Определение GFP нейрона и одновременное приобретение фура-красной флуоресценции в корональных ломтики мозга мыши. А. конфокальной изображения корональных срез мозга выявления GnRHR-τGFP нейроны (зеленый). B. Относительно равномерное флуоресцентного сигнала (красный) области мозга показаны на наблюдалась после загрузки среза мозга с fura-red/AM. C. Объединенные изображение, показывающее нейтроновадроны изображенные на загружается с Ca 2 + индикатор красителя (желтоватый). Границы GFP нейрона somata указаны в пунктирные белые линии, в то время как примеры двух не-GFP somata (стрелки) указаны в серых линий. D. Пример GFP и не-GFP нейронов с более высоким количеством красной флуоресценции по сравнению с фоном. E. Примеры соматических стимул-индуцированной Ca 2 + ответы от отдельных GFP с метками нейронов в различных областях мозга гипоталамус (Pe, перивентрикулярной ядра, DM, дорсомедиального гипоталамуса; Arc, дугообразные ядра). Площади под кривой (AUC) изображается красной зоне. Различных Ca 2 + сигналов между GnRHR-экспрессирующих нейронов из различных ядрах гипоталамуса могут быть сравнены с использованием AUC, как оценка общего изменения Ca 2 + в данной клетке за тот же период. F. схемы и диаграммы с указанием расположения GFP с метками нейронов проанализированы в AE Верхняя панель: Местоположение. Корональной мозга сперегиба содержащие гипоталамической областях мозга (красная линия) средние и нижние панели. Схематическое изображение среза мозга (в центре) и увеличения его красной коробке область (нижняя панель) с указанием красными точками примерное положение записанных GFP с метками нейронов Пе, DM и Триумфальной показан на E; черная область в нижней панели схеме: 3-го желудочка. Нижние две диаграммы взяты из Paxinos и Франклин 12. Нижний левый угол число указывает расстояние (мм) от брегмы.
Обсуждение
Главный вопрос в неврологии, чтобы понять, как мозг обрабатывает социальную информацию. Основным источником информации, необходимой для социального признания кодируется обонятельный или феромонов сигналов. Обнаружение этих сигналов популяций нейронов в носу и признание сигналы в мо...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим наших коллег, которые принимали участие в работе приведены здесь. Эта работа была поддержана грантами от Deutsche Forschungsgemeinschaft (SFB 894), «Интегративная анализа обоняния" DFG Schwerpunktprogramm 1392 и Фондом Фольксваген (TLZ). TLZ является профессор Лихтенберг от Volkswagen Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Компания | Кат. N ° | |
| Агар | Сигма | A1296 | |
| Fura-red/AM | Invitrogen | F-3021 | |
| Pluronic F-127 | Сигма | P2443 | |
| Диметилсульфоксид | Fisher Scientific | BP231 | |
| Вибрационный-Blade Микротом Hyrax V 50 | Zeiss | 9770170 | |
| Охлаждающее устройство CU 65 для Микротом Hyrax V 50 | Zeiss | 9920120 | |
| O 2 / CO 2 инкубаторе, CB210-UL | Связующее вещество | 0019389 | |
| Супер-клей, Loctite 406TM | Хенкель | 142580 | |
| Двухместный шпатели, ложки форму | Bochem | 3182 | |
| Microspoon шпатели, ложки форму | Bochem | 3344 | |
| Весна Ножницы, Мория-Vannas-Вольфа - 7 мм Лезвия | Средства изобразительных наук | 15370-52 | |
| Весна Ножницы, Vannas - 3 мм Лезвия | Средства изобразительных наук | 15000-00 | |
| Вагнер ножницы | Средства изобразительных наук | 14071-12 | |
| Медицинские щипцы, Дюмон 7b | Средства изобразительных наук | 11270-20 | |
| Большие прямоугольные ванны с открытой камерой (RC-27) | Warner Instruments | 64-0238 | |
| Конфокальный микроскоп Сияние BioRad 2100 | Zeiss | не доступно |
Ссылки
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены