A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل ديناميات البروتين عن طريق صرف الهيدروجين الطيف الكتلي
In This Article
Summary
التشكل البروتين وديناميات هي المفتاح لفهم العلاقة بين بنية البروتين ووظيفته. تبادل الهيدروجين مقرونا عالية الدقة قياس الطيف الكتلي هو طريقة تنوعا لدراسة ديناميكية بتكوين جزئي للبروتينات وكذلك تميز البروتين يجند والبروتين البروتين التفاعلات، بما في ذلك واجهات الاتصال والآثار تفارغي.
Abstract
تعتمد جميع العمليات الخلوية على وظيفة البروتينات. على الرغم من أن وظيفة بروتين معين هو نتيجة مباشرة لتسلسل الأحماض الأمينية فريدة من نوعها، ويتحقق ذلك إلا من خلال للطي سلسلة ببتيد في ترتيب ثلاثي الأبعاد تحديدا واحدة أو أكثر شيوعا في مجموعة متكاملة من التشكل interconverting. التحقيق في العلاقة بين التشكل البروتين وظيفتها لذا فمن الضروري لفهم كامل لكيفية البروتينات هي قادرة على الوفاء تنوعها كبير من المهام. احتمال واحد لدراسة التغيرات متعلق بتكوين البروتين يخضع بينما تتقدم من خلال دورة وظيفية لها هو الهيدروجين H-1/2 H-الصرف بالاشتراك مع عالية الدقة قياس الطيف الكتلي (HX-MS). HX-MS هو أسلوب تنوعا والقوية التي تضيف بعدا جديدا إلى المعلومات التي حصلت عليها الهيكلية مثل البلورات. يتم استخدامه لدراسة البروتين للطي والتي تتكشف، ملزم من مول الصغيرةبروابط ecule، البروتين البروتين التفاعلات، والتغيرات متعلق بتكوين مرتبطة انزيم الحفز، وallostery. بالإضافة إلى ذلك، يستخدم HX-MS في كثير من الأحيان عندما كمية البروتين محدودة جدا أو بلورة البروتين ليست مجدية. ونحن هنا نقدم بروتوكول عام لدراسة ديناميات البروتين مع HX-MS ووصف كمثال كيفية الكشف عن واجهة التفاعل من اثنين من البروتينات في مجمع.
Introduction
ارتفع عدد هياكل الكريستال من البروتينات والمجمعات البروتين بسرعة في السنوات الأخيرة. ما يقدمونه لقطات لا تقدر بثمن للتنظيم الهيكلية لهذه البروتينات وتوفير أساس لتحليل هيكل وظيفة. ومع ذلك، فإن ديناميات البروتينات والتغيرات متعلق بتكوين جزئي، والتي هي ضرورية لمهامهم، ونادرا ما كشفت عنه البلورات بالأشعة السينية. البرد electronmicroscopy، من ناحية أخرى، قادرة على التقاط مجمعات البروتين والبروتين في التشكل مختلفة ولكن بصفة عامة لا يمكن حل التغييرات متعلق بتكوين وصولا الى المستوى الثانوي هيكل 1. ديناميات بتكوين جزئي للبروتينات في الحل في التفاصيل الذرية لا يمكن حلها إلا عن طريق الرنين المغناطيسي، ولكن هذا الأسلوب لا يزال يقتصر على البروتينات ذات أحجام صغيرة نسبيا (عادة ≤ 30 كيلو دالتون) ويحتاج تركيزات عالية من البروتينات (≥ 100 ميكرومتر)، الذي يعيق التجارب مع oligomerization أو تجميع البروتينات عرضة 2. أسلوب واحدقادرة على سد بين عالية الدقة البلورات بالأشعة السينية والبرد electronmicroscopy والذي لا يقتصر حسب حجم البروتين أو تركيز أميد الهيدروجين H-1/2 H-الصرف (HX) في تركيبة مع مطياف الكتلة (MS). في السنوات الأخيرة تطورت هذه الطريقة إلى أداة تحليلية قيمة لتحليل ديناميات البروتين، والبروتين للطي، والاستقرار البروتين والتغيرات متعلق بتكوين 3-5. الأساس الجزيئي لهذه الطريقة هي طبيعة عطوب من الهيدروجين أميد العمود الفقري في البروتينات، والتي سوف تبادل مع ذرات الديوتيريوم عندما يتم وضع البروتين في D 2 O الحل. يتم قياس زيادة لاحقة في البروتين الشامل على مر الزمن مع ارتفاع القرار-MS.
في الببتيدات غير منظم قصيرة HX يعتمد فقط على درجة الحرارة، وتركيز محفز (OH -، H 3 O + أي درجة الحموضة، انظر الشكل 3) وسلاسل الأحماض الأمينية الجانب المخلفات المجاورة بسبب الاستقرائي، والقطآثار alytic والفراغية. هذه التأثيرات الجوهرية على سعر الصرف الكيميائية ك الفصل تم كميا بأناقة من قبل باي وآخرون. 6 والبرنامج متاح (مجاملة Z. تشانغ)، الذي يحسب ك الفصل لكل الأحماض الأمينية داخل ببتيد تعتمد على درجة الحموضة ودرجة الحرارة. في الرقم الهيدروجيني محايدة ودرجات الحرارة المحيطة ك ch غير في الترتيب من 10 1 -10 3 ثانية -1. في البروتينات مطوية HX يمكن أن تكون 2-9 أوامر من حجم أبطأ ويرجع ذلك أساسا إلى الرابطة الهيدروجينية في هيكل الثانوية وبدرجة طفيفة بسبب الوصول المحدود للرطب OH - الأيونات إلى داخل البروتين مطوية بإحكام. لذا HX في البروتينات الأم تورط تتكشف، وتبادل الكيميائية جزئية أو العالمية وطوي ثانية إلى الدولة الأم وفقا للمعادلة (1) وفقا لأسعار الصرف المرصودة ك OBS تعتمد على المرجع سعر الافتتاح ك، سعر الإقفال ك البنود وتبادل الكيميائية الذاتية راالشركة المصرية للاتصالات ك الفصل وفقا لمعادلة (2).
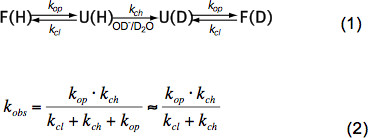
في ظل ظروف الدولة الأم ك المرجع هو أصغر بكثير من الفصل ك ويمكن إهمالها في المقام. هناك نوعان من أنظمة الصرف المدقع دعا EX1 EX2 و. إذا كانت البنود ك هو أصغر بكثير من الفصل ك (EX1) معدل احظ تساوي عمليا إلى سعر الافتتاح وHX يسمح الملاحظة المباشرة للتتكشف من عنصر هيكلي. مثل هذا النظام الصرف، حيث جميع البروتونات أميد الصرف في آن واحد على افتتاح العنصر الهيكلي، ويمكن ملاحظتها بسهولة في MS قبل توزيع ذات النسقين من قمم النظير 7. إذا ك البنود هو أكبر بكثير من الفصل ك (EX2) معدل وحظ يتناسب مع ك الفصل حيث ثابت التناسب يساوي التوازنات-تتكشف للطي المستمر K = ش ك المرجع / ك البنود. في ظل هذه الظروف، فإن العديد من افتتاح واختتام الأحداث ضرورية قبل كل تبادل البروتونات أميد لدوتيرونس، مما يؤدي إلى زيادة تدريجية في متوسط كتلة بينما يبقى توزيع النظائر تقريبا نفس. النظام EX2 يسمح تحديد الطاقة خالية من تتكشف ΔG u و بالتالي استقرار عنصر هيكلي. تحت شرط الدولة الأم النظام EX2 هو الأكثر شيوعا. زيادة درجة الحموضة وإضافة وكلاء chaotropic يمكن تحويل آلية الصرف لEX1. وبالتالي، HX-MS يمكن استخدامها لاستكشاف الحرارية وكذلك المعلمات الحركية للطي البروتين والتغيرات متعلق بتكوين.
كما ذكر أعلاه HX هو جوهرها ودرجة الحموضة ودرجة الحرارة تعتمد وتبادل عمر النصف للبروتون يتعرض المذيبات تماما من مجموعة أميد العمود الفقري ما بين 5-400 ميللي ثانية في درجة الحموضة الفسيولوجية (الرقم الهيدروجيني 7.6) و 30 درجة مئوية، ولكن 10 دقيقة ل> 15 ساعة بمتوسط> 2 ساعة في درجة الحموضة 2.9 و 0 °C (ما عدا البروتون من أول العمود الفقري أميد السندات من ببتيد، والتي تتبادل مع حياة نصف من كاليفورنيا. 1-2 دقيقة). في ظل هذه الظروف تبادل بطيئة فمن الممكن لهضم العينة باستخدام البروتياز (مثل البيبسين) التي تنشط في ظل هذه الظروف، مع من فقدان جميع المعلومات الواردة في دوتيرونس يدمج. منذ إدخال الهضم المعوية في ظل ظروف تبادل بطيئة، وليس فقط حركية HX العام للبروتينات كامل طول يمكن تحليلها ولكن يمكن أن تكون مترجمة إلى HX مناطق محددة 8،9. يقتصر القرار المكانية حاليا لحجم الشظايا الناتجة الهضمية، والتي هي بشكل عام بين 10-30 المخلفات. ومع ذلك، يمكن تداخل شظايا إنشاؤها نظرا لطبيعة غير محددة من الانقسام قبل البيبسين يؤدي إلى زيادة في القرار المكانية. بالإضافة إلى ذلك، تم العثور على العديد من البروتياز الأخرى أن تكون نشطة في ظل ظروف إخماد، ومع ذلك، أقل كفاءة بكثير من البيبسين 10. مزيد من increaذاتها من القرار المكانية ويمكن الوصول عن طريق تجزئة الببتيدات في الطور الغازي من قبل الأساليب التي حافظت على نمط معالجة بالديوتريوم مثل أسر الإلكترون تفارق (تنمية الطفولة المبكرة)، ونقل الإلكترون تفارق (المفتشون) والأشعة تحت الحمراء multiphoton تفارق (IRMPD) 11-13. هذه التقنيات منع فقدان القرار المكانية بسبب الهجرة داخل الجزيء بروتون ("الهرولة")، والذي لوحظ من قبل الناجم عن الاصطدام تفارق (CID) تقنية تجزئة الأكثر استخداما. ومع ذلك، وهذه الأساليب تتطلب التحسين لكل الببتيد الفردية وبالتالي لا تزال صعبة للغاية.
وقد استخدم HX-MS لتحليل البروتين يجند والبروتين البروتين التفاعلات بما في ذلك التجمع الفيروسية قفيصة 14-17. البروتين تتكشف وطوي ثانية وكذلك تم التحقيق في درجة الحرارة الناجمة عن التغيرات متعلق بتكوين 7،18،19. الفسفرة واحد من الأحماض الأمينية المتصلة بتكوين طفرة يغير 16،20 وnucleotوالتغيرات الناجمة عن بيئة تطوير متكاملة تحليل 21،22. وبالتالي، فإن هذا الأسلوب يبدو مناسبة بشكل مثالي لتحليل التجمع وديناميات الآلات الجزيئية. مرشح واحد جذاب، الذي هو آلية من المصلحة العامة كبيرة، هو مجمع كوصي Hsp90.
Protocol
1. عينات إعداد المخازن المؤقتة والبروتين
- إعداد H 2 O العازلة. استخدام Hsp90 عازلة معيار (40 ملي HEPES / كوه، ودرجة الحموضة 7.5، 50 ملي بوكل، 5 ملي MgCl 2، 10٪ الجلسرين) كما H 2 O العازلة.
ملاحظة: إذا كان مدال العينة قبل التحليل، واستخدام المخزن المؤقت لغسيل الكلى كما H 2 O العازلة. فمن الضروري أن O العازلة D 2 يختلف عن O العازلة H 2 فقط في النظائر الهيدروجين. مخازن متقلبة مثل NH 4 CO 3 أو 4 NH-خلات العازلة أو مكونات ليست مناسبة! - إعداد D 2 O العازلة تجفيد من Hsp90 عازلة معيار باستخدام مكثف فراغ. بعد التبخر كاملة من H 2 O إضافة النقي D 2 O إلى أنبوب للوصول إلى الحجم الكلي الأولية (على سبيل المثال 1 مل العازلة مع 15٪ الجلسرين تتطلب إضافة 850 ميكرولتر D 2 O). تكرار التبخر الكامل للالعازلة وتنحل كوم العازلة / الملح* مكونات في D 2 O 2X.
- إعداد العازلة إخماد (0.4 M KH 2 PO 4 / H 3 PO 4 درجة الحموضة 2.2).
ملاحظة: لتحسين كفاءة الجهاز الهضمي هضم البروتينات مستقرة جدا ويمكن أن يضاف 4 M جوانيداين هيدروكلوريد و 0.5 M تريس (2-carboxyethyl) الفوسفين (TCEP، حمض الهيدروكلوريك). - إعداد 100٪ العينة الضابطة (6 M جوانيداين هيدروكلوريد، D 2 O). إضافة جوانيداين هيدروكلوريد لقسامة Hsp90 للوصول إلى تركيز النهائي من 6 M. تماما تتبخر H 2 O من العينة وإضافة D 2 O إلى أنبوب للوصول إلى الحجم الكلي الأولية (على سبيل المثال 100 عينة ميكرولتر مع 10٪ الجلسرين تتطلب إضافة من 90 ميكرولتر D 2 O). تكرار التبخر الكامل للالعازلة وتنحل العناصر العازلة / الملح في D 2 O.
ملاحظة: يطلب من 20-100 بمول من العينة لكل الحقن. إعداد ما يكفي من العينة لديهم السيطرة 100٪ عن كل يوم من التجارب HX-MS. - إعداد 50 بمول Hsp90 في 5 ميكرولتر العازلة Hsp90 القياسية.
ملاحظة: مطلوب مبلغ 20-100 بمول من عينة لكل نقطة من البيانات الخام. حجم العينة في رد فعل هو 1-5 ميكرولتر من الناحية المثالية. ضبط تركيز لتناسب هذه المتطلبات. أي العازلة يمكن استخدامها طالما أنها لا تحتوي على المنظفات أو المكونات المتطايرة.
2. إعداد يجمد البيبسين على ألدهيد المنشط الخرز
- حل 80 ملغ البيبسين الطازجة في 2 مل 50 ملي سيترات الصوديوم (الرقم الهيدروجيني 5).
- حل 20 ملغ من الصوديوم cyanoborohydride، التعامل مع الرعاية (سامة جدا!) في 1 مل 2 M نا 2 SO 4 وإضافة إلى حل البيبسين.
- احتضان الخليط لمدة 10 دقيقة في درجة حرارة الغرفة في حين تهييج بلطف (شاكر مثل النفقات العامة).
- إضافة 600 ملغ الخرز مع مجموعات ألدهيد يجمد إلى الخليط واحتضان لمدة 5-10 دقائق في درجة حرارة الغرفة.
- إضافة 2.2 مل من 2 M نا 2 SO4 (الرقم الهيدروجيني 5) في 100 ميكرولتر مأخوذة كل دقيقة أكثر من 3 ساعة واحدة إلى الملح ببطء والبيبسين. المزيج بلطف العينة بين الإضافات في النفقات العامة شاكر في درجة حرارة الغرفة.
- احتضان حبات البيبسين في 4 درجات مئوية لمدة 14-16 ساعة / بين عشية وضحاها في شاكر في سماء المنطقة.
- إخماد رد فعل عن طريق إضافة 1 مل من 1 M ايثانول والحضانة في درجة حرارة الغرفة لمدة 2 ساعة.
- تدور باستمرار الخرز في أنبوب 50 مل الصقر في 500 دورة في الدقيقة، وتجاهل طاف و resuspend حبات في حمض الفورميك بنسبة 0.1٪. كرر هذه الخطوة 2X. بعد الخطوة الطرد المركزي الماضي، تجاهل طاف وحجم التقدير من الخرز. إضافة حجم يعادل حمض الفورميك بنسبة 0.1٪ وتخزينها في 4 درجات مئوية.
3. إعداد الأعمدة لأميد الهيدروجينية الصرف
- استخدام الأعمدة الحرس مع القطر الداخلي من 1 ملم لمحاصرة الأعمدة ومع 2 مم للأعمدة البيبسين.
- فك جانب واحد من العمود حارس وإزالة عامل التصفية. المسمار بإحكام التعبئة نتائج موجودةش على النهاية المفتوحة للعمود. استخدام محول 1/16 بوصة وأنابيب إرفاق حقنة فارغة (5 مل) للمخرج الجزء السفلي من العمود. تأكد من إصلاحه الغاز محكم إلى العمود الحراسة.
- تطبيق بضع قطرات من الطين مادة حبة على رأس القمع. سحب المكبس من المحاقن لامتصاص الطين من خلال القمع في العمود الحراسة. تطبيق المزيد من الطين المواد خرزة على القمع ومواصلة الإجراء حتى يتم تعبئة العمود الحرس تماما مع المواد حبة. إزالة القمع والتصفية ووضع عصابة على مرشح نهاية مفتوحة. المسمار بإحكام الغطاء العمود على العمود حارس وإزالة المحقنة من الجانب الآخر. إغلاق طرفي أعمدة الحرس مع المقابس لتجنب تجفيف المواد العمود.
4. إنشاء نظام للصرف الهيدروجين الطيف الكتلي (HX-MS)
- ربط العمود فخ مع نظام HPLC (الشكل 1). تتوازن العمود عن طريق تحديد معدل تدفقضخ ألف إلى 0.4 مل / دقيقة مع حمض الفورميك بنسبة 0.1٪ كما المذيبات. لا ربط العمود البيبسين ولا العمود التحليلية حتى الآن.
- معايرة مطياف الكتلة وتوصيل مخرج HPLC لمصدر مطياف الكتلة.
5. تحديد المدى الديناميكي للنقد
- إعداد عالى النقاء المذيبات A (حمض الفورميك بنسبة 0.1٪ في الماء) وعالى النقاء المذيبات B (حمض الفورميك بنسبة 0.1٪ في أسيتونتريل)؛ هي المذيبات الجاهزة متوفرة تجاريا. تطهير مضخات HPLC. إعداد اللوني وطرق قياس الطيف الكتلي في برنامج التحكم عن طريق اختيار البرنامج مع التدرج خطوة بعد خطوة تحلية قصيرة. لكامل طول استخدام Hsp90 خطوة تحلية 1-2 دقيقة تليها تبديل صمام 6 من ميناء DESALT / LOAD لأزل وخطوة متدرجة من 90٪ المذيبات المذيبات A/10٪ إلى 5٪ B المذيبات المذيبات A/95٪ B. قبل حقن تعيين صمام حقن لتحميل وصمام 6 الميناء لDESALT موقف / LOADING.
مذكرة: لا تستخدم البيبسين أو عمود التحليلية خلال هذه التجربة. - إعداد 100-200 بمول من Hsp90 في 1-10 ميكرولتر H 2 O العازلة واحتضان لمدة 10 دقيقة في 30 درجة مئوية. إضافة درجة حرارة تعديلها D 2 O عازلة لتبرزي حجم عينة تصل إلى 100 ميكرولتر واحتضان بالضبط لفترة محددة من الزمن (مثلا 10 ثانية و 100 ثانية، 1،000 ثانية). إضافة 100 ميكرولتر العازلة إخماد وتخلط بواسطة pipetting صعودا وهبوطا. حقن العينة 200 ميكرولتر في منفذ حقن صمام الحقن مع حقنة هاميلتون. بدء تشغيل البرنامج اللوني وتبديل صمام حقن حقن في الموقف. بعد 2 دقيقة تبديل صمام 6 من ميناء DESALT / LOADING إلى أزل. كرر هذا لا يقل عن ثلاث نقاط الوقت.
- كرر الخطوة 5.2 ولكن إضافة 2-3X تتجاوز Sti1 إلى عينة Hsp90 قبل احتضان لمدة 10 دقيقة عند 30 درجة مئوية.
- تحديد الجماهير بروتين كامل طول بواسطة deconvolution الأطياف في برنامج مطياف الكتلة. حساب عدد incorporatإد دوتيرونس بمقارنة الوزن الجزيئي للبالطول Hsp90 مع كتلة وحظ بعد كل شوط (على سبيل المثال 10 ثانية و 100 ثانية، 1،000 ثانية).
- رسم دوتيرونس أدرجت لHsp90 في غياب وجود Sti1 (المحور الصادي) مقابل الوقت (محور س). تحديد نقطة في الوقت النطاق الديناميكي حيث الفرق بين كل من المنحنيات هي القصوى. استخدام هذه القيمة لفترة حضانة في D 2 O عند تحديد واجهة Hsp90-Sti1 وديناميكية على مستوى الببتيد.
6. تحديد هضمية الببتيدات عن طريق MS / MS الأطياف
- ربط العمود البيبسين والعمود التحليلي إلى النظام.
- إعداد المعلمات للاللوني وقياس الطيف الكتلي في برنامج التحكم عن طريق اختيار نوع التدرج وطريقة قياس الطيف الكتلي. اختيار التدرج طويلة (على سبيل المثال أكثر من 90 دقيقة) لضمان القرار الكروماتوغرافي جيدة. تمكين MS / MS الأطياف على مطياف الكتلة.
ملاحظة: resolu جيدنشوئها على هبلك ودقة عالية الشامل لها الأولوية القصوى في هذه الخطوة. - إعداد 100-200 بمول من Hsp90 في 100 ميكرولتر H 2 O العازلة. إضافة 100 ميكرولتر العازلة إخماد وتخلط بواسطة pipetting صعودا وهبوطا. حقن العينة 200 ميكرولتر في منفذ حقن صمام الحقن مع حقنة هاميلتون. بدء تشغيل البرنامج اللوني وتبديل صمام حقن حقن في الموقف. بعد 2 دقيقة تبديل صمام 6 من ميناء DESALT / LOADING إلى أزل الموقف.
ملاحظة: إذا كان البروتين أكثر من واحد هو أن يتم تحليلها في HX-MS (أي البروتين البروتين واجهات التفاعل) الببتيدات لكل من البروتين يجب أن تحدد بشكل فردي. - تحديد الببتيدات الهضمية من Hsp90 من خلال البحث في قاعدة البيانات (أي التميمة) لالببتيدات الناتجة عن ذلك.
ملاحظة: من الممكن استخدام قاعدة بيانات مخصصة كما ان الهدف هو تحديد العديد من الببتيدات الهضمية ممكن، ويتم تحليل مع البروتين النقي. سوف نقاء العينة حافي أن تؤخذ بعين الاعتبار. - كرر هذه الخطوة دون MS / MS ومع التدرج التي سيتم استخدامها للتجربة HX الفعلية. لHsp90 وSti1 استخدام التدرج 10 دقيقة من 90٪ المذيبات المذيبات A/10٪ إلى 45٪ B المذيبات المذيبات A/55٪ B.
ملاحظة: تدرجات عادة ما تكون بين 5-15 دقيقة وتعتمد بشكل كبير على تعقيد نموذج ومواصفات النظام HX. - تحديد أوقات الإبقاء على الببتيدات الهضمية المحددة في 6.4 في الانحدار المستخدمة في 6.5 وإنشاء قائمة تضم 1.) تسلسل الببتيد 2.) الببتيد ولاية تهمة و 3.) الوقت الاحتفاظ. وسوف تستخدم هذه لتعريف كل الببتيد بعد التجارب HX.
ملاحظة: يجب أن تدرك أن الببتيدات مع وجود اختلافات صغيرة م / ض، متطابقة ولاية تهمة ومتطابقة الوقت الاحتفاظ يمكن أن تكون مصدرا للغموض.
7. تحديد البروتين البروتين واجهات التفاعل
- إعداد التدرج وطريقة قياس الطيف الكتلي في سوفتواري السيطرةه. استخدام التدرج الخطي 10 دقيقة من 90٪ المذيبات المذيبات A/10٪ إلى 45٪ B المذيبات A/55٪ B. المذيبات تحميل طريقة قياس الطيف الكتلي الذي هو الأمثل للكشف عن الجماهير بين 300-1،500 م / ض، على الرغم من أن معظم سيكون الببتيدات أدناه 1،000 م / ض. ضبط صمام الحقن في موقف LOAD، صمام 6 ميناء في LOADING / تحلية الموضع. ضبط معدل تدفق المضخة التحميل إلى 0.4 مل / دقيقة.
ملاحظة: طول ونوع من التدرج تعتمد عينة، ويمكن أن يكون الأمثل. يعد تحسين التدرجات حل اللوني ولكن تقليل إدماج دوتيرونس في البروتينات بسبب الخلفية الصرف. الطرق المختارة تحتاج إلى أن تكون واحدة لجميع التجارب ليتم مقارنتها. - للإشارة unexchanged إعداد 20-100 بمول من Hsp90 في 100 ميكرولتر H 2 O العازلة. إضافة 100 ميكرولتر العازلة إخماد الجليد الباردة، ماصة صعودا وهبوطا مرتين وحقن العينة في صمام حقن HPLC. بدء تشغيل البرنامج اللوني وجنوب غرب فوراحكة صمام الحقن في موقف حقن. بعد 2 دقيقة تبديل صمام 6 من ميناء DESALT / LOADING إلى أزل الموقف. للقيام بذلك Hsp90 وSti1 بشكل فردي وعلى خليط من البروتينات.
- إعداد 20-100 بمول من Hsp90 في حجم 1-5 ميكرولتر. إضافة درجة حرارة تعديلها D 2 O عازلة لتبرزي حجم عينة تصل إلى 100 ميكرولتر واحتضان بالضبط لفترة محددة من الزمن (مثلا 30 ثانية؛ لديناميات بتكوين رؤية ملاحظة). إضافة 100 ميكرولتر من العازلة إخماد الجليد الباردة، ماصة صعودا وهبوطا مرتين وبسرعة حقن 200 ميكرولتر في صمام حقن HPLC. بدء فورا في برنامج اللوني وتبديل صمام حقن حقن في الموقف. بعد 2 دقيقة تبديل صمام 6 من ميناء DESALT / LOADING إلى أزل الموقف. القيام بذلك بشكل فردي لكل من البروتين، لتحديد إدماج دوتيرون في كل الببتيد في غياب البروتين التفاعل.
ملاحظة: عند دراسة ديناميات conformational التغييرات، كرر التجربة مع أوقات مختلفة من الحضانة Hsp90 في D 2 O العازلة. محاولة لتغطية فترة زمنية واسعة من خلال اختيار الأوقات الحضانة غاريثمي (على سبيل المثال 10 ثانية، 30 ثانية و 100 ثانية، 300 ثانية، 1،000 ثانية، الخ). يجب أن يكون D 2 O العازلة والعازلة عينة متطابقة تماما فيما عدا النظائر الهيدروجين. - إعداد مبلغ مساو من 100٪ العينة الضابطة (20-100 بمول) وإضافة D 2 O عازلة لتبرزي حجم عينة تصل إلى 100 ميكرولتر. إضافة 100 ميكرولتر من العازلة إخماد الجليد الباردة، ماصة صعودا وهبوطا مرتين وبسرعة حقن 200 ميكرولتر في صمام حقن HPLC. بدء فورا في برنامج اللوني وتبديل صمام حقن حقن في الموقف. بعد 2 دقيقة تبديل صمام 6 من ميناء DESALT / LOADING إلى أزل الموقف.
- لتحديد سطح التفاعل مزيج Hsp90 مع وجود فائض لا يقل عن 2 أضعاف من Sti1 لتحويل التوازن للدولة منضمة (انظر ملاحظة)، واحتضانفي درجة الحرارة المطلوبة حتى تشكيل معقدة هو في حالة توازن. إضافة درجة حرارة تعديلها D 2 O عازلة لتبرزي حجم عينة تصل إلى 100 ميكرولتر واحتضان بالضبط لفترة محددة من الزمن (مثلا 30 ثانية). إضافة 100 ميكرولتر من العازلة إخماد الجليد الباردة، ماصة صعودا وهبوطا مرتين وبسرعة تحقن صمام حقن HPLC. بعد 2 دقيقة تبديل صمام 6 من ميناء DESALT / LOADING إلى أزل الموقف. تكرار هذه التجربة مع 20-100 بمول من Sti1 وتتجاوز Hsp90.
ملاحظة: تركيزات المطلقة تعتمد على التوازن التفكك المستمر للتفاعل. من الناحية المثالية، وبعد التخفيف إلى D 2 O تركيز البروتين المضافة في الزائدة يجب أن تكون على الأقل 10X K D (الموافق> 85٪ من البروتين أقل تركيزا ملزمة). - تحليل البيانات التي حصل عليها مع البرمجيات المناسبة واستخدام مرات الاحتفاظ تحديدها في الخطوة 6.5 لايجاد كل الببتيد في التحليل. Calculaالشركة المصرية للاتصالات النقطه الوسطى لتوزيع النظائر للبروتين unexchanged (الخطوة 7.2) وللتجارب HX (الخطوة 7.3).
ملاحظة: على الرغم من أن أنماط النظائر من الببتيدات تبادل تبدو مختلفة عن نظيراتها unexchanged، فإن كلا من المعرفة حول الدولة المسؤول عن الببتيد ودقة عالية من الكتلة مطياف الكتلة يسمح لتحديد سهلة من النقطة الوسطى. - مقارنة إدماج دوتيرونس من البروتين الهدف وحده، ومع فائض من شريك ملزمة. ويمكن القيام بذلك تلقائيا مع البرمجيات التجارية أو يدويا مع برنامج جدول بيانات. قيم العينة الضابطة 100٪ للدلالة على التبادل القصوى لكل الببتيد ويمكن استخدامها لتحديد مقدار D 2 O التسمية فقدت أثناء التجربة بسبب الصرف الظهر.
النتائج
Hsp90 هو كوصي الجزيئية في الخميرة وعضو في الأسرة كوصي Hsp90. من خلال الذهاب من خلال دورة أتباز المعقدة التي تساعد الخطوات للطي في وقت متأخر من العديد من العملاء البروتين. يتطلب كفاءة للطي نقل العملاء من HSP70 والتفاعل من Sti1/Hop المشترك كوصي. Sti1 يربط مباشرة إلى Hsp90 ويسهل العميل م...
Discussion
ملزمة من شريك إلى التفاعل البروتين حتما يسبب تغيرات في الوصول المذيب على موقع ملزمة. بالإضافة إلى ذلك، العديد من البروتينات تغيرات ديناميكية بتكوين عليها ملزمة، والتي تؤثر على مناطق أخرى من واجهة الربط الفعلي. HX-MS هو طريقة قوية لرصد هذه التغيرات وحتى قادرة على الكشف ...
Disclosures
ليس لدينا شيء في الكشف عنها.
Acknowledgements
نشكر M. بويسن للتعليق على المخطوطة. وقد تم تمويل هذا المشروع من قبل جمعية الألمانية للبحوث (SFB638 وMA 1278/4-1 لإم، والكتلة التميز: CellNetworks EXC 81/1). إم هو محقق من الكتلة التميز: CellNetworks.
Materials
| Name | Company | Catalog Number | Comments |
| maXis QTOF | Bruker | ||
| nanoAcquity UPLC | Waters Corp. | ||
| Shimadzu 10AD-VP | Shimadzu | ||
| 6-port Valve EPC6W with microelectric actuator | Valco | #EPC6W | |
| Injection valve (manual) | Rheodyne | #7725 | |
| Poros AL20 media | Applied Biosystems | #1-6029-06 | |
| Poros R2 | Applied Biosystems | #1-1118-02 | |
| Pepsin | Sigma | #P6887 | use fresh pepsin |
| Microbore (1 mm) | IDEX | #C-128 | |
| Microbore (2 mm) | IDEX | #C-130B | |
| Acquity UPLC BEH C8 Column | Waters Corp. | #186002876 | |
| Thermomixer | Eppendorf | #5355000.011 | |
| Tubing (various diameters) | IDEX | ||
| Fittings | IDEX | #PK-110 with PK-100 |
References
- Saibil, H. R. Conformational changes studied by cryo-electron microscopy. Nat. Struct. Biol. 7 (9), 711-714 (2000).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Hoofnagle, A. N., Resing, K. A., Ahn, N. G. Protein analysis by hydrogen exchange mass spectrometry. Annu. Rev. Biophys. Biomol. Struct. 32, 1-25 (2003).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass. Spectrom. Rev. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. -. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc. Rev. 40 (3), 1224-1210 (2011).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Rist, W., Jørgensen, T. J. D., Roepstorff, P., Bukau, B., Mayer, M. P. Mapping temperature-induced conformational changes in the Escherichia coli heat shock transcription factor sigma 32 by amide hydrogen exchange. The Journal of biological chemistry. 278 (51), 51415-51421 (1074).
- Englander, J. J., Rogero, J. R., Englander, S. W. Protein hydrogen exchange studied by the fragment separation method. Anal Biochem. 147 (1), 234-244 (1985).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Cravello, L., Lascoux, D., Forest, E. Use of different proteases working in acidic conditions to improve sequence coverage and resolution in hydrogen/deuterium exchange of large proteins. Rapid Commun. Mass Spectrom. : RCM. 17 (21), 2387-2393 (2003).
- Rand, K. D., Zehl, M., Jensen, O. N., Jørgensen, T. J. D. Protein hydrogen exchange measured at single-residue resolution by electron transfer dissociation mass spectrometry. Anal chem. 81 (14), 5577-5584 (2009).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Electron capture dissociation of electrosprayed protein ions for spatially resolved hydrogen exchange measurements. J. Am. Chem. Soc. 130 (35), 11574-11575 (2008).
- Yamada, N., Suzuki, E. -. I., Hirayama, K. Identification of the interface of a large protein-protein complex using H/D exchange and Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 16 (4), 293-299 (2002).
- Lee, T., Hoofnagle, A. N., et al. Docking motif interactions in MAP kinases revealed by hydrogen exchange mass spectrometry. Mol. Cell. 14 (1), 43-55 (2004).
- Hasan, A., Smith, D. L., Smith, J. B. Alpha-crystallin regions affected by adenosine 5'-triphosphate identified by hydrogen-deuterium exchange. Biochem. 41 (52), 15876-15882 (2002).
- Lanman, J., Lam, T. T., Emmett, M. R., Marshall, A. G., Sakalian, M., Prevelige, P. E. Key interactions in HIV-1 maturation identified by hydrogen-deuterium exchange. Nat. Struct. Mol. Biol. 11 (7), 676-677 (2004).
- Wang, L., Lane, L. C., Smith, D. L. Detecting structural changes in viral capsids by hydrogen exchange and mass spectrometry. Protein Sci. 10 (6), 1234-1243 (2001).
- Pan, H., Raza, A. S., Smith, D. L. Equilibrium and kinetic folding of rabbit muscle triosephosphate isomerase by hydrogen exchange mass spectrometry. J. Mol. Biol. 336 (5), 1251-1263 (2004).
- Mazon, H., Marcillat, O., Forest, E., Smith, D. L., Vial, C. Conformational dynamics of the GdmHCl-induced molten globule state of creatine kinase monitored by hydrogen exchange and mass spectrometry. Biochem. 43 (17), 5045-5054 (2004).
- Lanman, J., Lam, T. T., et al. Identification of novel interactions in HIV-1 capsid protein assembly by high-resolution mass spectrometry. J. Mol. Biol. 325 (4), 759-772 (2003).
- Rist, W., Graf, C., Bukau, B., Mayer, M. P. Amide hydrogen exchange reveals conformational changes in hsp70 chaperones important for allosteric regulation. J. Biol. chem. 281 (24), 16493-16501 (2006).
- Graf, C., Stankiewicz, M., Kramer, G., Mayer, M. P. Spatially and kinetically resolved changes in the conformational dynamics of the Hsp90 chaperone machine. EMBO J. 28 (5), 602-613 (2009).
- Lee, C. -. T., Graf, C., Mayer, F. J., Richter, S. M., Mayer, M. P. Dynamics of the regulation of Hsp90 by the co-chaperone Sti1. EMBO J. 31 (6), 1518-1528 (2012).
- Lou, X., Kirchner, M., et al. Deuteration distribution estimation with improved sequence coverage for HX/MS experiments. Bioinformatics. 26 (12), 1535-1541 (2010).
- Kreshuk, A., Stankiewicz, M., Lou, X., Kirchner, M., Hamprecht, F. A., Mayer, M. P. Automated detection and analysis of bimodal isotope peak distributions in H/D exchange mass spectrometry using HeXicon. Intl. J. mass spectrom. 302 (1-3), 125-131 (2011).
- Walters, B. T., Ricciuti, A., Mayne, L., Englander, S. W. Minimizing back exchange in the hydrogen exchange-mass spectrometry experiment. J. Am. Soc. Mass Spectrom. 23 (12), 2132-2139 (2012).
- Weis, D. D., Wales, T. E., Engen, J. R., Hotchko, M., Ten Eyck, L. F. Identification and characterization of EX1 kinetics in H/D exchange mass spectrometry by peak width analysis. J. Am. Soc. Mass Spectrom. 17 (11), 1498-1509 (2006).
- Fang, J., Rand, K. D., Beuning, P. J., Engen, J. R. False EX1 signatures caused by sample carryover during HX MS analyses. Intl. J. Mass Spectrom. 302 (1-3), 19-25 (2011).
- Deng, Y., Smith, D. L. Identification of unfolding domains in large proteins by their unfolding rates. Biochem. 37 (18), 6256-6262 (1998).
- Wales, T. E., Engen, J. R. Partial unfolding of diverse SH3 domains on a wide timescale. J. Mol. Biol. 357 (5), 1592-1604 (2006).
- Pan, Y., Piyadasa, H., O'Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by h/d exchange and covalent labeling: the glycerol facilitator. J. Mol. Biol. 416 (3), 400-413 (2012).
- Hebling, C. M., Morgan, C. R., Stafford, D. W., Jorgenson, J. W., Rand, K. D., Engen, J. R. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Anal chem. 82 (13), 5415-5419 (2010).
- Abzalimov, R. R., Kaplan, D. A., Easterling, M. L., Kaltashov, I. A. Protein conformations can be probed in top-down HDX MS experiments utilizing electron transfer dissociation of protein ions without hydrogen scrambling. J. Am. Soc. Mass Spectrom. 20 (8), 1514-1517 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved