Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El análisis de dinámica de proteínas utilizando hidrógeno Intercambio de Espectrometría de Masas
En este artículo
Resumen
Conformación de la proteína y la dinámica son claves para entender la relación entre estructura y función de proteínas. Intercambio de hidrógeno acoplada a espectrometría de masas de alta resolución es un método versátil para estudiar la dinámica conformacionales de proteínas, así como la caracterización de la proteína-ligando y proteína-proteína interacciones, incluidas las interfaces de contacto y los efectos alostéricos.
Resumen
Todos los procesos celulares dependen de la funcionalidad de las proteínas. Aunque la funcionalidad de una proteína dada es la consecuencia directa de su secuencia de aminoácidos única, que sólo se realiza por el plegamiento de la cadena de polipéptido en una única disposición tridimensional definido o más comúnmente en un conjunto de conformaciones interconverting. La investigación de la relación entre la conformación de la proteína y su función es, por tanto, esencial para una comprensión completa de cómo las proteínas son capaces de cumplir con su gran variedad de tareas. Una posibilidad para estudiar los cambios conformacionales una proteína experimenta mientras avanza a través de su ciclo funcional es hidrógeno H-1/2 H-intercambio en combinación con espectrometría de masas de alta resolución (HX-MS). HX-EM es un método versátil y robusta que añade una nueva dimensión a la información estructural obtenida por ejemplo, cristalografía. Se utiliza para estudiar el plegamiento de proteínas y el despliegue, la unión de pequeña molligandos ecule, las interacciones proteína-proteína, cambios conformacionales ligados a la catálisis enzimática y allostery. Además, HX-MS se utiliza a menudo cuando la cantidad de proteína es muy limitada o la cristalización de la proteína no es factible. Aquí les ofrecemos un protocolo general para el estudio de la dinámica de proteínas con HX-MS y describimos como un ejemplo de cómo mostrar la interfaz de interacción de dos proteínas en un complejo.
Introducción
El número de estructuras cristalinas de proteínas y complejos de proteínas aumentó rápidamente en los últimos años. Presentan instantáneas invaluables de la organización estructural de estas proteínas y proporcionan una base para el análisis de la estructura-función. Sin embargo, la dinámica de las proteínas y los cambios conformacionales, que son esenciales para sus funciones, rara vez se revelaron mediante cristalografía de rayos X. Cryo-microscopia electrónica, por otro lado, es capaz de capturar complejos de proteínas y de proteínas en diferentes conformaciones, pero en general no puede resolver cambios conformacionales a nivel de la estructura secundaria 1. Dinámica conformacional de proteínas en solución a detalles atómicos sólo pueden ser resueltas por RMN, pero este método todavía se limita a proteínas de tamaños relativamente pequeños (generalmente ≤ 30 kDa) y las necesidades de altas concentraciones de proteínas (≥ 100 micras), lo que dificulta experimentos con oligomerización o de agregación de proteínas propensas 2. Un método quees capaz de tender un puente entre la alta resolución de la cristalografía de rayos X y microscopía electrónica de crio-y que no está limitado por el tamaño de la proteína o la concentración es amida de hidrógeno-1 H / 2 H-intercambio (HX) en combinación con espectrometría de masas (MS). En los últimos años este método se ha desarrollado a una herramienta analítica valiosa para el análisis de la dinámica de proteínas, plegamiento de proteínas, estabilidad de la proteína y cambios conformacionales 3-5. La base molecular de este método es la naturaleza lábil de la cadena principal hidrógenos amida en proteínas, que se intercambio con átomos de deuterio cuando la proteína se coloca en un D2O solución. El posterior aumento de la masa de la proteína con el tiempo se mide con alta resolución de la EM.
En péptidos no estructurados cortos sólo HX depende de la temperatura, concentración de catalizador (OH -, H 3 O + es decir, pH, véase la Figura 3) y cadenas laterales de aminoácidos de residuos adyacentes debido a inductiva, gatoefectos alytic y estéricos. Estos efectos sobre el intrínseca tasa de intercambio químico K CH han sido elegantemente cuantificado por Bai et al. 6 y un programa está disponible (por cortesía de Z. Zhang), que calcula k CH para cada aminoácido dentro de un polipéptido dependiente de pH y la temperatura. A pH neutro y temperaturas ambiente K es CH en el orden de 10 1 -10 3 seg -1. En proteínas plegadas HX puede ser 2-9 ordenes de magnitud más lento debido principalmente a enlaces de hidrógeno en la estructura secundaria y en un grado menor debido al acceso restringido de hidratadas iones OH - al interior de una proteína fuertemente plegada. HX en las proteínas nativas, por tanto, implica desarrollo, intercambio químico parcial o global y replegado al estado nativo de acuerdo con la ecuación (1) y los tipos de cambio observados k obs dependen de la tasa de apertura op k, los k cl tasa de cierre y el intercambio químico intrínseca raTE CH K según la ecuación (2).
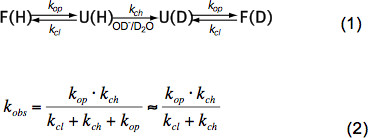
En condiciones de estado nativos K OP es mucho menor que K CH y se puede despreciar en el denominador. Hay dos regímenes cambiarios extremos llamados EX1 y EX2. Si el K CL es mucho menor que K CH (EX1) la tasa observada es prácticamente igual a la tasa de apertura y HX permite la observación inmediata del despliegue de un elemento estructural. Tal régimen de cambio, donde todos los protones amida de cambio a la vez después de la apertura del elemento estructural, es fácilmente observable en la EM por una distribución bimodal de los picos de los isótopos 7. Si k CL es mucho mayor que K CH (EX2) la tasa observada es proporcional a k CH mediante el cual la constante de proporcionalidad es igual a los equilibrios de plegado-desplegado constante K U = K OP K / cl. En estas condiciones, muchos eventos de apertura y cierre son necesarios antes de todo el intercambio de protones de amida de deuterones, dando lugar a un aumento gradual de la masa media, mientras que la distribución isotópica sigue siendo más o menos el mismo. El régimen EX2 permite la determinación de la energía libre de despliegue Delta G u y, por tanto, la estabilidad de un elemento estructural. Bajo condición de estado nativo régimen EX2 es más común. Aumento del pH y la adición de agentes caotrópicos puede cambiar el mecanismo de intercambio de EX1. Por lo tanto, HX-MS se puede utilizar para explorar termodinámico así como los parámetros cinéticos de plegamiento de la proteína y cambios conformacionales.
Como se mencionó anteriormente HX es intrínsecamente dependiente de pH y la temperatura y el cambio de la vida media de un protón completamente expuestos al disolvente del grupo amida del eje central es de entre 5-400 mseg a pH fisiológico (pH 7,6) y 30 ° C, pero 10 min a> 15 h con un promedio de> 2 horas a pH 2,9 y 0 °C (excepto para el protón de la primera enlace amida columna vertebral de un polipéptido, que intercambia con una vida media de ca. 1-2 min). Bajo tales condiciones lento intercambio es posible digerir la muestra usando proteasas (por ejemplo pepsina) que son activas en estas condiciones, con sin perder toda la información contenida en los deuterones incorporados. Desde la introducción de la digestión péptica en condiciones de intercambio lento, no sólo la cinética global HX de proteínas de longitud completa pueden ser analizados pero HX se pueden localizar en regiones específicas 8,9. La resolución espacial se limita actualmente al tamaño de los fragmentos generados pépticas, que es en general entre 10-30 residuos. Sin embargo, la superposición de fragmentos creados debido a la naturaleza no específica de la escisión por la pepsina podrían conducir a un aumento de la resolución espacial. Además, se encontraron varias otras proteasas para ser activa en condiciones de templado, sin embargo, mucho menos eficiente que la pepsina 10. Además increse de resolución espacial se puede llegar por la fragmentación de péptidos en fase gaseosa por métodos que conservan el patrón deuteración tales como la disociación de captura de electrones (ECD), la transferencia de electrones de disociación (ETD) y disociación multifotónica infrarroja (IRMPD) 11-13. Estas técnicas evitan la pérdida de la resolución espacial debido a la migración intramolecular de protones ("aleatorización"), que se observa por la disociación inducida por colisión (CID) la técnica de fragmentación más comúnmente utilizado. Sin embargo, estos métodos requieren la optimización para cada péptido individual y es por lo tanto todavía bastante difícil.
HX-MS se ha utilizado para analizar la proteína-ligando y proteína-proteína interacciones, incluyendo el montaje de la cápside viral 14-17. Proteína despliegue y replegamiento y se investigaron temperatura inducidas cambios conformacionales 7,18,19. La fosforilación y solo aminoácido conformacional relacionados mutación cambia 16,20 y nucleotSe analizaron los cambios ide-inducidos 21,22. Por lo tanto, este método parece idealmente adecuado para analizar el montaje y la dinámica de máquinas moleculares. Un candidato atractivo, cuyo mecanismo es de gran interés general, es el complejo chaperona Hsp90.
Protocolo
1. Preparación de disoluciones y Proteína muestras
- Preparar H 2 O buffer. Tampón estándar Uso Hsp90 (40 mM de HEPES / KOH, pH 7,5, KCl 50 mM, MgCl2 5 mM, glicerol al 10%) como H 2 O tampón.
Nota: Si la muestra se dializó antes del análisis, utilizar el tampón de diálisis como H 2 O tampón. Es esencial que la junta tampón D 2 difiere de la H 2 O tampón sólo en el isótopo de hidrógeno. Tampones volátiles como NH 4 CO 3 o NH 4 componentes de acetato o de amortiguamiento no son adecuados! - Preparar D2O tampón de liofilización de tampón estándar Hsp90 usando un concentrador de vacío. Después de la evaporación completa de H 2 O añadir pura D2O al tubo para alcanzar el volumen total inicial (por ejemplo, 1 ml de tampón con 15% de glicerol requiere la adición de 850 l D2O). Repita la evaporación completa de la memoria intermedia y volver a disolver el COM / tampón de salnentes en D 2 O 2x.
- Prepare el buffer de enfriamiento (0,4 M KH 2 PO 4 / H 3 PO 4 pH 2.2).
Nota: Para mejorar la eficiencia de digerido péptico de proteínas muy estables 4 M hidrocloruro de guanidina y 0,5 M Tris (2-carboxietil) fosfina (TCEP-HCl) se pueden agregar. - Preparar la muestra de control 100% (6 M hidrocloruro de guanidina, D 2 O). Añadir clorhidrato de guanidina a una alícuota de Hsp90 para llegar a una concentración final de 6 M. Completamente evaporar H 2 O de la muestra y añadir D2O al tubo para alcanzar el volumen total inicial (por ejemplo, 100 l de muestra con 10% de glicerol requieren la adición de 90 l D 2 O). Repita la evaporación completa de la memoria intermedia y volver a disolver los componentes del tampón / sal en D 2 O.
Nota: 20-100 pmol de muestra se requiere para cada inyección. Preparar suficiente muestra para tener un control del 100% para todos los días de experimentos HX-MS. - Preparar 50 pmol Hsp90 en 5 l de tampón estándar Hsp90.
Nota: Se requiere una cantidad de 20-100 pmol de muestra por cada punto de datos en bruto. El volumen de la muestra en la reacción es de 1-5 l idealmente. Ajustar la concentración para adaptarse a estos requisitos. Cualquier tampón puede ser usado, siempre y cuando que no contiene detergentes o componentes volátiles.
2. Preparación de la pepsina inmovilizada en Aldehído perlas activadas
- Disolver 80 mg de pepsina fresco en 2 ml de citrato de sodio 50 mM (pH 5).
- Disolver 20 mg de cianoborohidruro de sodio, manejar con cuidado (muy tóxico!) En 1 ml de 2 M de Na 2 SO 4 y añade a la solución de pepsina.
- Incubar mezcla durante 10 min a temperatura ambiente mientras se agita suavemente (por ejemplo, agitador de cabeza).
- Añadir 600 mg de perlas con grupos aldehído inmovilizados a la mezcla y se incuba durante 5-10 min a temperatura ambiente.
- Añadir 2,2 ml de 2 M de Na 2 SO4 (pH 5) en 100 alícuotas cada 3 minutos durante una hora a la sal lentamente a cabo la pepsina. Mezcle suavemente la muestra entre las adiciones en un agitador de arriba a temperatura ambiente.
- Incubar las perlas de pepsina a 4 ° C durante 14-16 h / durante la noche en un agitador por encima.
- Se detiene la reacción mediante la adición de 1 ml de etanolamina 1 M y la incubación a temperatura ambiente durante 2 h.
- Centrifugar las perlas en un tubo Falcon de 50 ml a 500 rpm, desechar el sobrenadante y resuspender las perlas en ácido fórmico al 0,1%. Repita este paso 2x. Después de la última etapa de centrifugación, desechar el sobrenadante y el volumen estimado de cuentas. Añadir un volumen equivalente de ácido fórmico al 0,1% y se almacenan a 4 ° C.
3. Preparación de las columnas de Amida de hidrógeno de intercambio
- Utilice columnas de guardia con un diámetro interno de 1 mm para atrapar columnas y de 2 mm para las columnas de pepsina.
- Desenrosque un lado de la columna de seguridad y retire el filtro. Atornille embalaje funnEL sobre el extremo abierto de la columna. Utilice un adaptador de 1/16 pulgadas y el tubo para conectar una jeringa vacía (5 ml) a la salida del fondo de la columna. Asegúrese de arreglarlo hermética con columna de seguridad.
- Aplicar unas pocas gotas de material de bolas de suspensión en la parte superior del embudo. Tire del émbolo de la jeringa para aspirar la suspensión a través del embudo en la columna de la guardia. Aplicar más material de bolas suspensión sobre el embudo y continuar el procedimiento hasta que la columna de seguridad está completamente lleno de material de bolas. Retire el embudo y colocar el filtro y el anillo del filtro en el extremo abierto. Atornille la tapa de la columna en la columna de seguridad y retire la jeringa del otro lado. Cierre ambos extremos de las columnas de guardia con tapones para evitar la desecación de material de la columna.
4. Configuración del Sistema de Intercambio de hidrógeno Espectrometría de Masas (HX-MS)
- Conectar la columna de la trampa con el sistema de HPLC (Figura 1). Equilibrar la columna mediante el establecimiento de la tasa de flujo debombear A a 0,4 ml / min con 0,1% de ácido fórmico como disolvente. No conecte la columna de la pepsina, ni la columna de análisis todavía.
- Calibrar el espectrómetro de masas y conectar la salida de la HPLC para la fuente del espectrómetro de masas.
5. Determinación del rango dinámico de intercambio
- Preparar ultrapura disolvente A (ácido fórmico al 0,1% en agua) y el disolvente B ultrapura (ácido fórmico al 0,1% en acetonitrilo); disolventes mixtos listos están disponibles comercialmente. Purgar las bombas de HPLC. Configuración de la cromatografía y métodos de espectrometría de masas en el software de control por la elección de un programa con un gradiente de paso después de una etapa de desalación corto. Por larga duración Hsp90 utilice un etapa de desalación 1-2 min seguido de conmutación de la válvula de 6 puertos de desalar / LOAD para eluir y un gradiente de paso de 90% A/10 solvente% de disolvente B al 5% de disolvente A/95% de disolvente B. Antes de la inyección ajusta la válvula de inyección de carga y la válvula de 6 puertos para desalar / posición de carga.
Nota: No utilice un pepsina o columna de análisis durante este experimento. - Preparar 100-200 pmol de Hsp90 en 1-10 l H 2 O tampón y se incuba durante 10 minutos a 30 ° C. Añadir temperatura ajustada D2O tampón para llevar el volumen de muestra de hasta 100 l e incubar exactamente por un período de tiempo definido (por ejemplo, 10 seg, 100 seg, 1.000 segundos). Añadir 100 l de tampón de enfriamiento y mezclar pipeteando arriba y abajo. Inyectar la muestra de 200 l en el puerto de inyección de la válvula de inyección con una jeringa Hamilton. Inicie el programa de cromatografía y cambiar la válvula de inyección en posición INJECT. Después de 2 min cambiar la válvula de 6 puertos de desalar / CARGA para eluir. Repita esto por lo menos tres puntos temporales.
- Repita el paso 5.2, pero añadir 2 a 3 veces superior a Sti1 a la muestra antes de la Hsp90 de incubar durante 10 min a 30 ° C.
- Determine las masas de proteínas de larga duración por deconvolución de los espectros en el software de la espectrometría de masas. Calcular el número de incorpoed deuterones comparando el peso molecular de la Hsp90 de longitud completa con la masa observada después de cada carrera (por ejemplo, 10 seg, 100 seg, 1.000 seg).
- Trace los deuterones incorporados para Hsp90 en ausencia y presencia de Sti1 (eje Y) frente al tiempo (eje x). Determinar el punto de tiempo en el rango dinámico en el que la diferencia entre las dos curvas es máxima. Utilice este valor para el tiempo de incubación en D 2 O en la identificación de interfaz de Hsp90-Sti1 y la dinámica en el nivel de péptidos.
6. Determinación de péptica péptidos usando espectros MS / MS
- Conectar la columna de la pepsina y la columna analítica para el sistema.
- Configurar los parámetros de la cromatografía y espectrometría de masas en el software de control por la elección de tipo de degradado y el método de espectrometría de masas. Elija un gradiente de largo (por ejemplo, más de 90 min) para asegurar una buena resolución cromatográfica. Habilitar espectros MS / MS en el espectrómetro de masas.
Nota: Buena resoluciónción en el HPLC y de alta precisión en masa tiene la más alta prioridad en este paso. - Preparar 100-200 pmol de Hsp90 en 100 l de H 2 O buffer. Añadir 100 l de tampón de enfriamiento y mezclar pipeteando arriba y abajo. Inyectar la muestra de 200 l en el puerto de inyección de la válvula de inyección con una jeringa Hamilton. Inicie el programa de cromatografía y cambiar la válvula de inyección en posición INJECT. Después de 2 min cambiar la válvula de 6 puertos de desalar / CARGA Para eluir posición.
Nota: Si más de una proteína se va a analizar en HX-EM (es decir, interfaces de interacción proteína-proteína) los péptidos para cada proteína se han determinado individualmente. - Identificar péptidos pépticas de Hsp90 buscando una base de datos (es decir, la mascota) para los péptidos resultantes.
Nota: Es posible utilizar una base de datos personalizada ya que el objetivo es determinar como muchos péptidos pépticas como sea posible y el análisis se realiza con la proteína purificada. Pureza de la muestra será hAVE a ser tenido en cuenta. - Repita este paso sin MS / MS y con el gradiente que se utilizará para el experimento HX real. Para Hsp90 y Sti1 utilizan un gradiente de 10 min desde el 90% A/10 solvente% de disolvente B al 45% de disolvente A/55% de disolvente B.
Nota: Los degradados se sitúan entre 5 a 15 min y altamente dependerá de la complejidad de la muestra y las especificaciones del sistema HX. - Tiempo de retención Determinar los tiempos de retención de los péptidos identificados pépticas en 6,4 en el gradiente utilizado en 6.5 y cree una lista que comprende 1.) Secuencia del péptido 2.) El estado de carga de péptidos y 3.). Esto se utiliza para identificar cada péptido después de los experimentos HX.
Nota: Tenga en cuenta que los péptidos con diferencias pequeñas m / z, estado de carga idéntica y tiempo de retención idéntico pueden ser una fuente de ambigüedad.
7. Identificación de las interfaces de interacción proteína-proteína
- Configure el gradiente y el método de espectrometría de masas en el control de software. Utilice un gradiente lineal de 10 min de 90% A/10% B solvente solvente de disolvente B. 45% de disolvente A/55% Carga un método de espectrometría de masas que se ha optimizado para la detección de masas entre 300-1,500 m / z, aunque la mayoría de los péptidos estarán por debajo de 1 000 km / z. Ajuste la válvula de inyección en posición de carga, la válvula de 6 puertos en la carga / DESALINIZACION Posición. Ajuste el caudal de la bomba de carga de 0,4 ml / min.
Nota: La longitud y el tipo de gradiente se muestra dependiente y puede tener que ser optimizado. Gradientes más largos mejoran la resolución de la cromatografía, pero disminuyen la incorporación de deuterones en proteínas debido al respaldo de cambio. Los métodos elegidos tienen que ser la misma para todos los experimentos que se compararán. - Para la referencia unexchanged preparar 20-100 pmol de Hsp90 en 100 l de H 2 O tampón. Añadir 100 l de tampón enfriado con hielo de enfriamiento, la pipeta arriba y abajo dos veces e inyectar la muestra en la válvula de inyección de HPLC. Inmediatamente iniciar el programa de cromatografía y swpicar la válvula de inyección en posición INJECT. Después de 2 min cambiar la válvula de 6 puertos de desalar / CARGA Para eluir posición. Haga esto por Hsp90 y Sti1 individual y de la mezcla de proteínas.
- Preparar 20-100 pmol de Hsp90 en un volumen de 1-5 l. Agregar temperatura ajustada D2O tampón para llevar el volumen de muestra de hasta 100 l e incubar exactamente por un período de tiempo definido (por ejemplo, 30 seg; para dinámica de conformación ver nota). Añadir 100 l de tampón enfriado con hielo de enfriamiento, la pipeta arriba y abajo dos veces y rápidamente inyectar los 200 l en la válvula de inyección de HPLC. Inmediatamente iniciar el programa de cromatografía y cambiar la válvula de inyección en posición INJECT. Después de 2 min cambiar la válvula de 6 puertos de desalar / CARGA Para eluir posición. Hacer esto para cada proteína individual, para determinar la incorporación de deuterones en cada péptido en ausencia de la proteína interactuar.
Nota: Cuando se estudia la dinámica de conforMational cambios, repita el experimento con diferentes tiempos de incubación de Hsp90 en D 2 O buffer. Trate de cubrir una amplia escala de tiempo eligiendo los tiempos de incubación de manera logarítmica (por ejemplo, 10 segundos, 30 segundos, 100 segundos, 300 segundos, 1.000 segundos, etc.) D2O tampón de tampón y la muestra debe ser exactamente idénticos, excepto por el isótopo de hidrógeno. - Preparar una cantidad igual de muestra de control 100% (20-100 pmol) y añadir D2O tampón para llevar el volumen de la muestra hasta 100 l. Añadir 100 l de tampón enfriado con hielo de enfriamiento, la pipeta arriba y abajo dos veces y rápidamente inyectar los 200 l en la válvula de inyección de HPLC. Inmediatamente iniciar el programa de cromatografía y cambiar la válvula de inyección en posición INJECT. Después de 2 min cambiar la válvula de 6 puertos de desalar / CARGA Para eluir posición.
- Para determinar la superficie de interacción de la mezcla de Hsp90 con un exceso por lo menos 2 veces de Sti1 para desplazar el equilibrio hacia el estado de enlace (véase la nota) e incubara la temperatura deseada hasta que la formación del complejo se encuentra en equilibrio. Añadir temperatura ajustada D2O tampón para llevar el volumen de muestra de hasta 100 l e incubar exactamente por un período de tiempo definido (por ejemplo, 30 segundos). Añadir 100 l de tampón enfriado con hielo de enfriamiento, la pipeta arriba y abajo dos veces y rápidamente inyectar en la válvula de inyección de HPLC. Después de 2 min cambiar la válvula de 6 puertos de desalar / CARGA Para eluir posición. Repita este experimento con 20-100 pmol de Sti1 y el exceso de Hsp90.
Nota: Las concentraciones absolutas dependen de la constante de equilibrio de disociación de la interacción. Idealmente, después de la dilución en D2O la concentración de la proteína añadida en exceso debe ser de al menos 10 veces la K D (correspondiente a> 85% de la proteína concentrada inferior unido). - Analizar los datos adquiridos con el software adecuado y el uso de los tiempos de retención determinados en el paso 6.5 para encontrar cada péptido en el análisis. CalculaTE el centroide de la distribución de isótopos para la proteína unexchanged (paso 7.2) y para los experimentos HX (paso 7.3).
Nota: Aunque los patrones de isótopos de péptidos intercambiados aspecto diferente de sus contrapartes unexchanged, tanto el conocimiento sobre el estado de carga del péptido y la masa de alta precisión del espectrómetro de masas permite una fácil determinación de los centroides. - Comparar incorporación de deuterones de proteína diana solo y con exceso de pareja de unión. Esto se puede hacer automáticamente con el software comercial o manualmente con un programa de hojas de cálculo. Los valores de la muestra de control de 100% denotan el intercambio máxima para cada péptido y se pueden utilizar para determinar la cantidad de D 2 O etiqueta perdió durante el experimento debido al intercambio de nuevo.
Resultados
Hsp90 es una chaperona molecular en levaduras y miembro de la familia Hsp90 chaperón. Al pasar por un ciclo complejo ATPasa asiste pasos plegables finales de muchos clientes de proteína. De plegado eficiente requiere transferencia de clientes de Hsp70 y la interacción del Sti1/Hop co-chaperona. Sti1 se une directamente a la Hsp90 y facilita cliente de unión por inhibición de la actividad ATPasa de la Hsp90. La interacción de Hsp90 con Sti1 se estudió recientemente usando HX-MS 23. Aquí presentamos los...
Discusión
La unión de una pareja de interacción de una proteína inevitablemente provoca cambios en la accesibilidad de disolvente en el sitio de unión. Además, muchas proteínas sufren cambios conformacionales a vinculantes dinámicos, que afectan a otras regiones de la interfaz de unión real. HX-MS es un método robusto para monitorear estos cambios y es incluso capaz de revelar los cambios conformacionales en proteínas en escalas de tiempo que otros métodos no pueden cubrir.
Para llevar a ca...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Damos las gracias a M. Boysen para comentarios sobre el manuscrito. Este proyecto fue financiado por la Deutsche Forschungsgemeinschaft (SFB638 y MA 1278/4-1 a MPM, y Cluster de Excelencia: CellNetworks EXC 81/1). MPM es investigador del Cluster de Excelencia: CellNetworks.
Materiales
| Name | Company | Catalog Number | Comments |
| maXis QTOF | Bruker | ||
| nanoAcquity UPLC | Waters Corp. | ||
| Shimadzu 10AD-VP | Shimadzu | ||
| 6-port Valve EPC6W with microelectric actuator | Valco | #EPC6W | |
| Injection valve (manual) | Rheodyne | #7725 | |
| Poros AL20 media | Applied Biosystems | #1-6029-06 | |
| Poros R2 | Applied Biosystems | #1-1118-02 | |
| Pepsin | Sigma | #P6887 | use fresh pepsin |
| Microbore (1 mm) | IDEX | #C-128 | |
| Microbore (2 mm) | IDEX | #C-130B | |
| Acquity UPLC BEH C8 Column | Waters Corp. | #186002876 | |
| Thermomixer | Eppendorf | #5355000.011 | |
| Tubing (various diameters) | IDEX | ||
| Fittings | IDEX | #PK-110 with PK-100 |
Referencias
- Saibil, H. R. Conformational changes studied by cryo-electron microscopy. Nat. Struct. Biol. 7 (9), 711-714 (2000).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Hoofnagle, A. N., Resing, K. A., Ahn, N. G. Protein analysis by hydrogen exchange mass spectrometry. Annu. Rev. Biophys. Biomol. Struct. 32, 1-25 (2003).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass. Spectrom. Rev. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. -. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc. Rev. 40 (3), 1224-1210 (2011).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Rist, W., Jørgensen, T. J. D., Roepstorff, P., Bukau, B., Mayer, M. P. Mapping temperature-induced conformational changes in the Escherichia coli heat shock transcription factor sigma 32 by amide hydrogen exchange. The Journal of biological chemistry. 278 (51), 51415-51421 (1074).
- Englander, J. J., Rogero, J. R., Englander, S. W. Protein hydrogen exchange studied by the fragment separation method. Anal Biochem. 147 (1), 234-244 (1985).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Cravello, L., Lascoux, D., Forest, E. Use of different proteases working in acidic conditions to improve sequence coverage and resolution in hydrogen/deuterium exchange of large proteins. Rapid Commun. Mass Spectrom. : RCM. 17 (21), 2387-2393 (2003).
- Rand, K. D., Zehl, M., Jensen, O. N., Jørgensen, T. J. D. Protein hydrogen exchange measured at single-residue resolution by electron transfer dissociation mass spectrometry. Anal chem. 81 (14), 5577-5584 (2009).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Electron capture dissociation of electrosprayed protein ions for spatially resolved hydrogen exchange measurements. J. Am. Chem. Soc. 130 (35), 11574-11575 (2008).
- Yamada, N., Suzuki, E. -. I., Hirayama, K. Identification of the interface of a large protein-protein complex using H/D exchange and Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 16 (4), 293-299 (2002).
- Lee, T., Hoofnagle, A. N., et al. Docking motif interactions in MAP kinases revealed by hydrogen exchange mass spectrometry. Mol. Cell. 14 (1), 43-55 (2004).
- Hasan, A., Smith, D. L., Smith, J. B. Alpha-crystallin regions affected by adenosine 5'-triphosphate identified by hydrogen-deuterium exchange. Biochem. 41 (52), 15876-15882 (2002).
- Lanman, J., Lam, T. T., Emmett, M. R., Marshall, A. G., Sakalian, M., Prevelige, P. E. Key interactions in HIV-1 maturation identified by hydrogen-deuterium exchange. Nat. Struct. Mol. Biol. 11 (7), 676-677 (2004).
- Wang, L., Lane, L. C., Smith, D. L. Detecting structural changes in viral capsids by hydrogen exchange and mass spectrometry. Protein Sci. 10 (6), 1234-1243 (2001).
- Pan, H., Raza, A. S., Smith, D. L. Equilibrium and kinetic folding of rabbit muscle triosephosphate isomerase by hydrogen exchange mass spectrometry. J. Mol. Biol. 336 (5), 1251-1263 (2004).
- Mazon, H., Marcillat, O., Forest, E., Smith, D. L., Vial, C. Conformational dynamics of the GdmHCl-induced molten globule state of creatine kinase monitored by hydrogen exchange and mass spectrometry. Biochem. 43 (17), 5045-5054 (2004).
- Lanman, J., Lam, T. T., et al. Identification of novel interactions in HIV-1 capsid protein assembly by high-resolution mass spectrometry. J. Mol. Biol. 325 (4), 759-772 (2003).
- Rist, W., Graf, C., Bukau, B., Mayer, M. P. Amide hydrogen exchange reveals conformational changes in hsp70 chaperones important for allosteric regulation. J. Biol. chem. 281 (24), 16493-16501 (2006).
- Graf, C., Stankiewicz, M., Kramer, G., Mayer, M. P. Spatially and kinetically resolved changes in the conformational dynamics of the Hsp90 chaperone machine. EMBO J. 28 (5), 602-613 (2009).
- Lee, C. -. T., Graf, C., Mayer, F. J., Richter, S. M., Mayer, M. P. Dynamics of the regulation of Hsp90 by the co-chaperone Sti1. EMBO J. 31 (6), 1518-1528 (2012).
- Lou, X., Kirchner, M., et al. Deuteration distribution estimation with improved sequence coverage for HX/MS experiments. Bioinformatics. 26 (12), 1535-1541 (2010).
- Kreshuk, A., Stankiewicz, M., Lou, X., Kirchner, M., Hamprecht, F. A., Mayer, M. P. Automated detection and analysis of bimodal isotope peak distributions in H/D exchange mass spectrometry using HeXicon. Intl. J. mass spectrom. 302 (1-3), 125-131 (2011).
- Walters, B. T., Ricciuti, A., Mayne, L., Englander, S. W. Minimizing back exchange in the hydrogen exchange-mass spectrometry experiment. J. Am. Soc. Mass Spectrom. 23 (12), 2132-2139 (2012).
- Weis, D. D., Wales, T. E., Engen, J. R., Hotchko, M., Ten Eyck, L. F. Identification and characterization of EX1 kinetics in H/D exchange mass spectrometry by peak width analysis. J. Am. Soc. Mass Spectrom. 17 (11), 1498-1509 (2006).
- Fang, J., Rand, K. D., Beuning, P. J., Engen, J. R. False EX1 signatures caused by sample carryover during HX MS analyses. Intl. J. Mass Spectrom. 302 (1-3), 19-25 (2011).
- Deng, Y., Smith, D. L. Identification of unfolding domains in large proteins by their unfolding rates. Biochem. 37 (18), 6256-6262 (1998).
- Wales, T. E., Engen, J. R. Partial unfolding of diverse SH3 domains on a wide timescale. J. Mol. Biol. 357 (5), 1592-1604 (2006).
- Pan, Y., Piyadasa, H., O'Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by h/d exchange and covalent labeling: the glycerol facilitator. J. Mol. Biol. 416 (3), 400-413 (2012).
- Hebling, C. M., Morgan, C. R., Stafford, D. W., Jorgenson, J. W., Rand, K. D., Engen, J. R. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Anal chem. 82 (13), 5415-5419 (2010).
- Abzalimov, R. R., Kaplan, D. A., Easterling, M. L., Kaltashov, I. A. Protein conformations can be probed in top-down HDX MS experiments utilizing electron transfer dissociation of protein ions without hydrogen scrambling. J. Am. Soc. Mass Spectrom. 20 (8), 1514-1517 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados