需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用氢交换质谱分析蛋白质动力学
摘要
蛋白质构象和动力学的关键是理解蛋白质结构与功能之间的关系。氢交换耦合用高分辨率质谱法是研究蛋白质的构象动力学以及表征蛋白质 - 配体和蛋白质之间的相互作用,其中包括接触接口和变构效应的灵活的方法。
摘要
所有的细胞过程依赖于蛋白质的功能。尽管给定的蛋白质的功能是其独特的氨基酸序列的直接后果,它仅由多肽链的折叠成一个单一的定义的三维结构或更常见为构象之间互相的合奏来实现。研究蛋白质构象与功能之间的联系是必不可少的,因此对于蛋白质如何能够履行其种类繁多的任务的完整理解。一种可能性,研究的构象变化,而 通过其官能周期进展的蛋白质经历是氢-1H / 2 H-交换与高分辨率质谱(HX-MS)的组合。 HX-MS是增加了一个新的层面,通过如结晶获得结构信息的灵活和可靠的方法。它是用来研究蛋白质折叠和展开,小摩尔结合ecule配体,蛋白质 - 蛋白质相互作用,挂酶催化的构象变化,和变构效应。此外,HX-MS通常被用于当蛋白质的量是非常有限的或蛋白质的结晶是不可行的。在这里,我们提供了一个通用协议,用于研究蛋白质动力学与HX-MS和描述,例如,如何显示两种蛋白质的相互作用界面在复杂的。
引言
蛋白和蛋白复合物的晶体结构的数量近年来迅速增加。他们提出这些蛋白质的结构组织的非常宝贵的快照,并为结构 - 功能分析的基础。然而,蛋白质和构象变化,这对于其功能必需的动力,也很少由X-射线结晶学揭示。冷冻电镜,另一方面,能够捕获蛋白和蛋白复合物在不同的构象,但一般不能解析的构象变化下降到二级结构的第1级。在原子细节的蛋白质在溶液中的构象动力学只能通过NMR来解决,但这种方法仍局限于相对较小的尺寸(通常≤30 kDa)的蛋白,并且需要高浓度的蛋白质(≥100微米),这阻碍了实验低聚或易聚集的蛋白质2。一种方法,该方法能够高分辨率X-射线晶体学和低温电镜和其之间的桥梁不是由蛋白质大小或浓度的限制是酰胺氢-1与质谱(MS)结合的H / 2 H-交换(HX)。近年来,这种方法已经发展到用于蛋白质动力学,蛋白质折叠,蛋白质稳定性和构象变化3-5的分析有价值的分析工具。该方法的分子基础是骨干酰胺氢中的蛋白质,这将与氘原子交换,当蛋白质被放置在D 2 O中的溶液中不稳定的性质。随着时间的推移随后增加蛋白质量的测量与高分辨率质谱。
总之非结构化肽HX只依赖于温度,催化剂浓度(OH - ,H 3 O +,即 pH值, 见图3)和相邻的残基,由于电感,猫氨基酸侧链alytic和空间位阻效应。在固有的化学交换率k CH这些影响已经由白等人 。6被量化的优雅和程序是可用的(礼貌Z.张),其中计算K 通道的多肽取决于pH值和温度范围内每个氨基酸。在中性pH值和温度,Ķch是在10 1 -10 3秒-1的顺序。在折叠的蛋白质HX可以是2-9个数量级慢,主要是由于在二级结构的氢键和一个较小的程度,由于水合OH的受限制的访问-离子以紧密折叠的蛋白质的内部。因此HX的天然蛋白质牵连局部或全局展开,化学交换,并根据公式折叠到天然态(1)和观察到的外汇报价K OBS依赖于开放率k 运算 ,收盘率k cl和内在化学交换RA特ķ 沟道根据等式(2)。
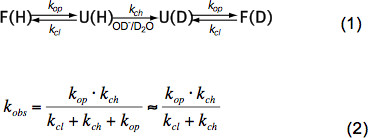
根据天然状态条件Ķ 运算比k 通道小得多,并且可以在分母被忽略。有所谓的EX1和EX2两个极端的汇率制度。如果第k CL比k 通道 (EX1)小得多所观察到的速率几乎等于开口率和HX允许直接观察的结构元件的展开的。这种汇率制度,所有的酰胺质子交换一次开盘时的结构元素,是很容易观察到在MS通过的同位素峰7双峰分布。如果k CL比k 通道大得多(EX2)所观察到的速率正比至K 通道 ,由此比例常数等于该折叠-展开平衡点常数K U = K 运 / K CL。在这些条件下,许多打开和关闭事件是必要的,在对于氘核所有的酰胺质子交换,导致平均质量逐渐提高,而同位素分布保持大致相同。该EX2制度容许展开ΔGu的自由能的决心和结构元素,因此稳定性。在自然状态条件下的EX2政权是最常见的。增加了pH值和增加离液剂的可以交流机制转移到EX1。因此,HX-MS可以用来探索热力学以及蛋白质折叠和构象变化的动力学参数。
如上面提到的HX是本质的pH和温度依赖的和骨干酰胺基的溶剂完全暴露质子交换半衰期为5-400毫秒,在生理pH值(pH值7.6)和30℃,但10分钟之间,以> 15小时用在pH值2.9,平均> 2小时,0°C(除了一种多肽,它具有交换的半衰期大约为1-2分钟的第一个骨干酰胺键的质子)。在这样慢交换条件,能够使用的蛋白酶( 如胃蛋白酶),这些活性在这些条件下,与出丢失所有包含在掺入氘核的信息来消化样品。自消化道的消化缓慢交换条件下引入,全长蛋白质不仅整体HX动力学进行分析,但HX可以将其定位于特定的区域8,9。空间分辨率目前仅限于所产生的可消化性的片段,这是在一般的10-30残基之间的尺寸。然而,通过胃蛋白酶产生由于裂解的非特异性性质重叠的碎片可能会导致增加的空间分辨率。此外,其它一些蛋白酶被发现淬火条件下有活性,但是,比胃蛋白酶10少得多的效率。进一步increa空间分辨率的本身可以通过肽在气相中的分片到达由保藏的氘化图案如电子捕获解离(ECD),电子转移解离(ETD)和红外多光子解离(IRMPD)11-13的方法。这些技术避免空间分辨率的损失是由于分子内质子迁移(“加扰”),这是由碰撞诱导解离(CID)所观察到的最常用的破碎技术。然而,这些方法需要优化每个个体肽,因而仍然非常具有挑战性。
HX-MS已经被用于分析蛋白质-配体和蛋白质之间的相互作用,包括病毒衣壳组装14-17。蛋白质变性和复性,以及温度诱导的构象变化进行了调查7,18,19。磷酸化和单个氨基酸突变相关的构象变化16,20和nucleotIDE引起的变化进行了分析21,22。因此,这种方法似乎非常适合于分析组件和分子机器的动力学。一个有吸引力的候选人,其机理是非常普遍的兴趣,是Hsp90的分子伴侣复合体。
研究方案
1。缓冲液的制备和蛋白样品
- 准备H 2 O缓冲区。用Hsp90的标准缓冲液(40mM的HEPES / KOH,pH值为7.5,50mM的氯化钾,5毫摩尔MgCl 2,10%甘油),为H 2 O的缓冲液中。
注意 :如果样品分析前透析,用透析缓冲液以H 2 O缓冲区。至关重要的是,在D 2 O缓冲器不同于H 2 O的缓冲仅在氢同位素。易失性缓冲区像NH 4 CO 3或NH 4 -乙酸酯或缓冲液组分是不适合! - 用真空浓缩器的热休克蛋白90的标准缓冲液冻干准备D 2 O缓冲区。对H 2 O完全蒸发后,加入纯D 2 O到管达到初始总容积( 如 1毫升15%甘油缓冲需要添加850微升D 2 O)。重复该缓冲器的完全蒸发,并再溶解在缓冲/盐的COMponents在D 2 O中2倍。
- 制备骤冷缓冲液(0.4M的KH 2 PO 4 / H 3 PO 4 pH值2.2)。
注意 :为了提高胃酶消化的非常稳定的蛋白质的4M盐酸胍和0.5M的Tris(2 -羧乙基)膦(TCEP-HCl中)可以被添加的效率。 - 准备100%控制样品(6M盐酸胍,D 2 O)。添加盐酸胍到热休克蛋白90等分达到6米的最终浓度从样品完全蒸发H 2 O和加入D 2 O到管达到初始总容量( 如 100微升的样品用10%的甘油需要添加90微升D 2 O)。重复该缓冲器的完全蒸发,并再溶解于D 2 O的缓冲/盐组分
注 :20-100皮摩尔样品都需要每次注射。准备足够的样本有100%控制的HX-MS实验的每一天。 - 准备50皮摩尔热休克蛋白90在5微升Hsp90的标准缓冲液。
注 :需要为每个点的原始数据的20-100皮摩尔样本的数量。样品在反应体积为1-5微升理想。调节浓度,以适应这些要求。任何缓冲可以,只要它不含有去垢剂或挥发成分使用。
2。激活珠子固定胃蛋白酶对醛制备
- 溶解80毫克新鲜胃蛋白酶在2毫升50 mM的柠檬酸钠(pH值为5)。
- 溶解20毫克氰基硼氢化钠,小心( 极毒 !)1毫升的2M的Na 2 SO 4处理,并加入到胃蛋白酶溶液。
- 孵育混合物10分钟,同时在室温下轻轻搅拌( 例如顶置搅拌器)。
- 加600毫克小珠与固定化的醛基到混合物中,并孵育在室温下5-10分钟。
- 加2.2毫升的2M的Na 2 SO4(pH值为5)中加入100μl等份,每3分钟在一小时内缓慢盐析的胃蛋白酶。轻轻混匀加入之间的样品中的塔顶搅拌器在室温下。
- 孵育珠胃蛋白酶在4℃下14-16小时/通宵在开销摇床。
- 由1毫升1M乙醇胺和在室温下孵育2小时,加入淬灭反应。
- 降速的50ml falcon管中的珠子以500rpm,弃去上清,重悬珠子中的0.1%甲酸。重复此步骤2倍。最后一步离心后,弃上清,珠估计量。添加0.1%的甲酸的等效量,并存储在4℃下
3。栏目的酰胺氢交换的制备
- 使用保护柱为1毫米用于捕集柱的内径为2 mm为胃蛋白酶列。
- 拧下保护柱的一侧,取出过滤器。紧紧螺丝包装FUNN埃尔到柱上的开口端。使用1/16英寸的适配器和管连接到附加空注射器(5ml)中,以在塔的底部出口。请确保气密固定在保护柱。
- 申请几滴浆料珠料在漏斗的顶部。拉动注射器的柱塞通过漏斗吸进浆保护柱。申请更多的浆珠材料到漏斗,并继续该过程,直到保护柱完全充满珠材料。取下漏斗,并放置过滤器和过滤器环上的开口端。拧紧螺钉,柱帽将保护柱,并从对方取出注射器。关闭保护柱的两端带插头,以避免干燥柱而出材料。
4。设置系统的氢交换质谱(HX-MS)
- 连接捕集柱与HPLC系统( 图1)。通过设定的流速平衡色谱柱A泵至0.4毫升/分钟用0.1%甲酸作为溶剂。不要连接胃蛋白酶列和分析柱呢。
- 校准质谱仪和液相色谱的出口连接到质谱仪的源。
5。交易所动态范围的确定
- 制备超纯溶剂A(0.1%甲酸的水)和超纯溶剂B(0.1%甲酸的乙腈溶液);准备的混合溶剂是市售的。清除HPLC泵。通过短的脱盐步骤之后用一个步骤梯度选择节目设置和层析和在控制软件质谱方法。对于全长Hsp90的使用1-2分脱盐工序依次切换从脱盐/负载的6通阀,以洗脱并在步梯度从90%溶剂A/10%溶剂B至5%溶剂A/95%溶剂B.注射前设置喷射阀负载和6通阀脱盐/装载位置。
注:请不要使用此实验过程中胃蛋白酶或分析柱。 - 准备100-200皮摩尔热休克蛋白90在1-10微升H 2 O缓冲区和孵育10分钟,在30°C。加温度调节D 2 O缓冲区以使样品体积高达100μl的孵育恰好为一个限定的时间段( 例如 10秒,100秒,1,000秒)。加入100μl缓冲液淬火和上下吹打混匀。将200μl的样品注入到注入阀用Hamilton注射器的注射口。启动色谱程序和切换进样阀到INJECT位置。 2分钟后切换6通阀从脱盐/ LOADING洗脱。重复此动作至少有三个时间点。
- 重复步骤5.2,但增加2-3倍过量STI1到Hsp90的样品在30℃温育10分钟之前
- 由光谱去卷积的质谱分析软件确定的全长蛋白质量。计算incorporat数通过每次运行( 例如 10秒,100秒,1,000秒)后,与观察到的质量全长HSP90的分子量比较编氘核。
- 情节缺乏和STI1(y轴)与时间(x轴)的存在为热休克蛋白90的氘核结合。确定时间点的动态范围,其中两条曲线之间的差别是最大的。确定热休克蛋白90-STI1接口和肽水平动态时使用此值在D 2 O中的孵育时间。
6。消化性溃疡肽使用MS / MS质谱测定
- 胃蛋白酶柱和分析柱连接到系统。
- 设置的参数色谱和质谱中的控制软件通过选择梯度型和质谱法。选择长梯度( 如超过90分钟),以保证良好的色谱分辨率。使MS / MS谱图上的质谱仪。
注:分辨率好化的HPLC和高的质量准确度具有最高优先级的在该步骤中。 - 准备100-200皮摩尔热休克蛋白90在100微升H 2 O缓冲区。加入100μl缓冲液淬火和上下吹打混匀。将200μl的样品注入到注入阀用Hamilton注射器的注射口。启动色谱程序和切换进样阀到INJECT位置。 2分钟后切换6通阀从脱盐/加载洗脱位置。
注意 :如果一个以上的蛋白是在HX-MS( 即蛋白质-蛋白质相互作用的界面)待分析的肽的每个蛋白质必须单独确定。 - 通过对所得到的肽搜索数据库( 即吉祥物)的Hsp90识别消化性溃疡肽。
注意 :可以使用自定义数据库作为目的是确定尽可能多的可消化性肽尽可能和分析用纯化的蛋白质进行。样品纯度会ħ等皆被考虑在内。 - 未经MS / MS和具有将被用于实际HX实验梯度重复此步骤。对热休克蛋白90和STI1用10分钟梯度从90%溶剂A/10%溶剂B至45%溶剂A/55%溶剂B。
注 :渐变通常在5-15分钟,并高度依赖于样品的复杂性和HX系统规范。 - 确定在6.5中使用的梯度6.4中确定的可消化性肽的保留时间和创建包含1的列表。)肽序列2)肽的充电状态和3。)保留时间。这将用于HX实验后,以确定各肽。
注 :请注意,肽与小M / Z的差异,相同的充电状态和相同的保留时间可以是模糊的源泉。
7。蛋白质 - 蛋白质相互作用界面的识别
- 设置在控制softwar的梯度和质谱法Ë。使用10分钟线性梯度由90%溶剂A/10%溶剂B至45%溶剂A/55%溶剂B装入已为300-1,500米/ Z之间的检测质量的最优化的质量分析方法,虽然大部分的肽将低于1,000 M / Z。将进样阀到装载位置,在加载/脱盐位置的6通阀。设置装载泵至0.4毫升/分钟的流速。
注 :长度和坡度的类型是样本相关,可能必须进行优化。较长的梯度改善色谱的分辨率,但降低氘核纳入由于背部交换蛋白。所选择的方法,需要为所有的实验进行比较是相同的。 - 对于未转换的参考准备20-100皮摩尔热休克蛋白90在100微升H 2 O缓冲区。加入100μl冰冷的淬灭缓冲液,吸管上下两次,样品注入到高效液相色谱的进样阀。立即启动色谱程序和SW痒进样阀到INJECT位置。 2分钟后切换6通阀从脱盐/加载洗脱位置。做到这一点的热休克蛋白90和STI1个别及蛋白质的混合物。
- 准备20-100皮摩尔热休克蛋白90在1-5微升的体积。加入温度调节D 2 O缓冲带来的样品体积可达100微升和孵化正是为了在规定的时间内( 如 30秒;为构象动力学见注 )。加入100μl冰冷的淬灭缓冲液,吸管上下两次,并迅速注入200微升到高效液相色谱的进样阀。立即启动色谱程序和切换进样阀到INJECT位置。 2分钟后切换6通阀从脱盐/加载洗脱位置。这样做对于每个单独的蛋白质,以确定氘掺入在不存在相互作用蛋白的每种肽。
注 :在研究构象的动态mational变化,重复实验与热休克蛋白90的不同孵育时间在D 2 O缓冲区。试图通过对数选择的孵育时间( 如 10秒,30秒,100秒,300秒1000秒, 等等 ),覆盖广泛的时间尺度。 D 2 O缓冲区和上样缓冲液必须完全一样,除了氢同位素。 - 准备100%控制样品(20〜100皮摩尔)等量,加入D 2 O缓冲带来的样品体积可达100微升。加入100μl冰冷的淬灭缓冲液,吸管上下两次,并迅速注入200微升到高效液相色谱的进样阀。立即启动色谱程序和切换进样阀到INJECT位置。 2分钟后切换6通阀从脱盐/加载洗脱位置。
- 为了确定相互作用表面的至少2倍过量STI1的转向均衡到绑定状态(见注 )和混合培养的Hsp90在所需的温度,直到复合物的形成是在平衡状态下。加温度调节D 2 O缓冲区以使样品体积高达100μl的孵育正是为了在规定的时间( 例如 30秒)期间。加入100微升冰冷的缓冲液骤冷,移液管上下两次,并迅速注入HPLC的喷射阀。 2分钟后切换6通阀从脱盐/加载洗脱位置。重复这个实验,20〜100皮摩尔STI1的和多余的热休克蛋白90的。
注意 :绝对浓度依赖于相互作用的解离平衡常数。理想情况下,稀释成D 2 O中后,加入过量的蛋白质的浓度至少应为10倍对K D(对应于约束下浓缩的蛋白质的> 85%)。 - 分析与合适的软件所获取的数据,并使用在步骤6.5中确定的滞留时间,以找到每个肽在分析中。计算使用TE为未交换蛋白(步骤7.2)和用于对HX实验(步骤7.3)的同位素分布的质心。
注意 :虽然交换肽的同位素模式看起来与他们的未转换的同行不同,两者对肽的充电状态的知识和质谱仪的高质量精度可以很容易地确定质心的。 - 比较靶蛋白的单独并用过量的结合伙伴氘核的结合。这可以自动与电子表格程序的商业软件或手动完成。 100%的对照样品的值表示的每个肽的最大交换,并且可以被用来确定D 2的实验过程中,由于回交换的o标签丢失量。
结果
热休克蛋白90是在酵母和热休克蛋白90分子伴侣家族成员分子伴侣。通过经历一个复杂的ATP酶周期它有助于后期折叠步骤很多蛋白质的客户。高效的折叠需要从Hsp70的传输客户端和共伴侣Sti1/Hop的相互作用。 STI1直接结合的Hsp90,便于客户通过抑制热休克蛋白90的ATP酶活性的结合。热休克蛋白90与STI1的相互作用采用HX-MS 23最近的研究。在这里,我们提出了相关的实验按照上述协议代表性的结果?...
讨论
一个互动的合作伙伴,一个蛋白质的结合不可避免地导致对结合位点的改变溶剂可及性。此外,许多蛋白进行结合后的动态构象变化,从而影响其他区域比实际的结合界面。 HX-MS是一种可靠的方法来监测这些变化,甚至能够在时间尺度是其他方法不能覆盖揭示蛋白质构象变化的。
为了成功执行HX-MS三点是关键:1)一个最佳的系统设置; 2)指定肽谱和解释结果时,精确的执行?...
披露声明
我们什么都没有透露。
致谢
我们感谢M.百胜对稿件的意见。该项目是由德意志研究联合会(SFB638和MA 1278/4-1到MPM,与集群卓越:CellNetworks EXC一分之八十一)。 MPM是卓越的集群调查:CellNetworks。
材料
| Name | Company | Catalog Number | Comments |
| maXis QTOF | Bruker | ||
| nanoAcquity UPLC | Waters Corp. | ||
| Shimadzu 10AD-VP | Shimadzu | ||
| 6-port Valve EPC6W with microelectric actuator | Valco | #EPC6W | |
| Injection valve (manual) | Rheodyne | #7725 | |
| Poros AL20 media | Applied Biosystems | #1-6029-06 | |
| Poros R2 | Applied Biosystems | #1-1118-02 | |
| Pepsin | Sigma | #P6887 | use fresh pepsin |
| Microbore (1 mm) | IDEX | #C-128 | |
| Microbore (2 mm) | IDEX | #C-130B | |
| Acquity UPLC BEH C8 Column | Waters Corp. | #186002876 | |
| Thermomixer | Eppendorf | #5355000.011 | |
| Tubing (various diameters) | IDEX | ||
| Fittings | IDEX | #PK-110 with PK-100 |
参考文献
- Saibil, H. R. Conformational changes studied by cryo-electron microscopy. Nat. Struct. Biol. 7 (9), 711-714 (2000).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Hoofnagle, A. N., Resing, K. A., Ahn, N. G. Protein analysis by hydrogen exchange mass spectrometry. Annu. Rev. Biophys. Biomol. Struct. 32, 1-25 (2003).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass. Spectrom. Rev. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. -. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc. Rev. 40 (3), 1224-1210 (2011).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Rist, W., Jørgensen, T. J. D., Roepstorff, P., Bukau, B., Mayer, M. P. Mapping temperature-induced conformational changes in the Escherichia coli heat shock transcription factor sigma 32 by amide hydrogen exchange. The Journal of biological chemistry. 278 (51), 51415-51421 (1074).
- Englander, J. J., Rogero, J. R., Englander, S. W. Protein hydrogen exchange studied by the fragment separation method. Anal Biochem. 147 (1), 234-244 (1985).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Cravello, L., Lascoux, D., Forest, E. Use of different proteases working in acidic conditions to improve sequence coverage and resolution in hydrogen/deuterium exchange of large proteins. Rapid Commun. Mass Spectrom. : RCM. 17 (21), 2387-2393 (2003).
- Rand, K. D., Zehl, M., Jensen, O. N., Jørgensen, T. J. D. Protein hydrogen exchange measured at single-residue resolution by electron transfer dissociation mass spectrometry. Anal chem. 81 (14), 5577-5584 (2009).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Electron capture dissociation of electrosprayed protein ions for spatially resolved hydrogen exchange measurements. J. Am. Chem. Soc. 130 (35), 11574-11575 (2008).
- Yamada, N., Suzuki, E. -. I., Hirayama, K. Identification of the interface of a large protein-protein complex using H/D exchange and Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 16 (4), 293-299 (2002).
- Lee, T., Hoofnagle, A. N., et al. Docking motif interactions in MAP kinases revealed by hydrogen exchange mass spectrometry. Mol. Cell. 14 (1), 43-55 (2004).
- Hasan, A., Smith, D. L., Smith, J. B. Alpha-crystallin regions affected by adenosine 5'-triphosphate identified by hydrogen-deuterium exchange. Biochem. 41 (52), 15876-15882 (2002).
- Lanman, J., Lam, T. T., Emmett, M. R., Marshall, A. G., Sakalian, M., Prevelige, P. E. Key interactions in HIV-1 maturation identified by hydrogen-deuterium exchange. Nat. Struct. Mol. Biol. 11 (7), 676-677 (2004).
- Wang, L., Lane, L. C., Smith, D. L. Detecting structural changes in viral capsids by hydrogen exchange and mass spectrometry. Protein Sci. 10 (6), 1234-1243 (2001).
- Pan, H., Raza, A. S., Smith, D. L. Equilibrium and kinetic folding of rabbit muscle triosephosphate isomerase by hydrogen exchange mass spectrometry. J. Mol. Biol. 336 (5), 1251-1263 (2004).
- Mazon, H., Marcillat, O., Forest, E., Smith, D. L., Vial, C. Conformational dynamics of the GdmHCl-induced molten globule state of creatine kinase monitored by hydrogen exchange and mass spectrometry. Biochem. 43 (17), 5045-5054 (2004).
- Lanman, J., Lam, T. T., et al. Identification of novel interactions in HIV-1 capsid protein assembly by high-resolution mass spectrometry. J. Mol. Biol. 325 (4), 759-772 (2003).
- Rist, W., Graf, C., Bukau, B., Mayer, M. P. Amide hydrogen exchange reveals conformational changes in hsp70 chaperones important for allosteric regulation. J. Biol. chem. 281 (24), 16493-16501 (2006).
- Graf, C., Stankiewicz, M., Kramer, G., Mayer, M. P. Spatially and kinetically resolved changes in the conformational dynamics of the Hsp90 chaperone machine. EMBO J. 28 (5), 602-613 (2009).
- Lee, C. -. T., Graf, C., Mayer, F. J., Richter, S. M., Mayer, M. P. Dynamics of the regulation of Hsp90 by the co-chaperone Sti1. EMBO J. 31 (6), 1518-1528 (2012).
- Lou, X., Kirchner, M., et al. Deuteration distribution estimation with improved sequence coverage for HX/MS experiments. Bioinformatics. 26 (12), 1535-1541 (2010).
- Kreshuk, A., Stankiewicz, M., Lou, X., Kirchner, M., Hamprecht, F. A., Mayer, M. P. Automated detection and analysis of bimodal isotope peak distributions in H/D exchange mass spectrometry using HeXicon. Intl. J. mass spectrom. 302 (1-3), 125-131 (2011).
- Walters, B. T., Ricciuti, A., Mayne, L., Englander, S. W. Minimizing back exchange in the hydrogen exchange-mass spectrometry experiment. J. Am. Soc. Mass Spectrom. 23 (12), 2132-2139 (2012).
- Weis, D. D., Wales, T. E., Engen, J. R., Hotchko, M., Ten Eyck, L. F. Identification and characterization of EX1 kinetics in H/D exchange mass spectrometry by peak width analysis. J. Am. Soc. Mass Spectrom. 17 (11), 1498-1509 (2006).
- Fang, J., Rand, K. D., Beuning, P. J., Engen, J. R. False EX1 signatures caused by sample carryover during HX MS analyses. Intl. J. Mass Spectrom. 302 (1-3), 19-25 (2011).
- Deng, Y., Smith, D. L. Identification of unfolding domains in large proteins by their unfolding rates. Biochem. 37 (18), 6256-6262 (1998).
- Wales, T. E., Engen, J. R. Partial unfolding of diverse SH3 domains on a wide timescale. J. Mol. Biol. 357 (5), 1592-1604 (2006).
- Pan, Y., Piyadasa, H., O'Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by h/d exchange and covalent labeling: the glycerol facilitator. J. Mol. Biol. 416 (3), 400-413 (2012).
- Hebling, C. M., Morgan, C. R., Stafford, D. W., Jorgenson, J. W., Rand, K. D., Engen, J. R. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Anal chem. 82 (13), 5415-5419 (2010).
- Abzalimov, R. R., Kaplan, D. A., Easterling, M. L., Kaltashov, I. A. Protein conformations can be probed in top-down HDX MS experiments utilizing electron transfer dissociation of protein ions without hydrogen scrambling. J. Am. Soc. Mass Spectrom. 20 (8), 1514-1517 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。