A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جيل من القص التصاق خريطة طريق SynVivo شبكات الاوعية الدموية الدقيقة الاصطناعية
In This Article
Summary
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
Abstract
خلية / الجسيمات فحوصات التصاق حاسمة لفهم التفاعلات البيوكيميائية المشاركة في الفيزيولوجيا المرضية المرض ولها تطبيقات هامة في السعي لتطوير علاجات جديدة. فحوصات باستخدام الظروف ثابت تفشل في التقاط الاعتماد من الالتصاق على القص، مما يحد من ترابطها مع البيئة في الجسم الحي. بالتوازي غرف تدفق وحة أن تحديد التصاق تحت تدفق السوائل الفسيولوجية تحتاج تجارب متعددة لتوليد خريطة التصاق القص. بالإضافة إلى ذلك، فإنها لا تمثل في الجسم الحي على نطاق والتشكل وتتطلب كميات كبيرة (~ مل) من الكواشف للتجارب. في هذه الدراسة، ونحن لشرح جيل من القص خريطة التصاق من تجربة واحدة باستخدام شبكة الاوعية الدموية الدقيقة القائمة على جهاز ميكروفلويديك، SynVivo-SMN. هذا الجهاز بإعادة المعقدة في الجسم الحي الأوعية الدموية بما في ذلك نطاق وهندسية، والعناصر الشكلية، وميزات تدفق والتفاعلات الخلوية فيفي المختبر الشكل، وبالتالي توفير بيئة واقعية للبيولوجيا الأساسية والبحوث التطبيقية في السلوك الخلوية، وتسليم المخدرات، واكتشاف المخدرات. وقد أظهر الفحص من خلال دراسة تفاعل 2 ميكرون المغلفة البيوتين مع الأسطح المغلفة أفيدين من الرقائق الدقيقة. يتم الحصول على مجموعة كاملة من القص التي لوحظت في الأوعية الدموية الدقيقة في فحص تمكين التصاق واحد مقابل خريطة القص للجسيمات في ظل الظروف الفسيولوجية.
Introduction
المقايسات الحالية لدراسة الخلية إلى خلية والتفاعلات خلية الجسيمات تنطوي عادة ثابتة شكل لوحة جيدا التي يتم تحضين الخلايا على جسيمات أو مصفوفات البروتين أو الخلايا الملتصقة. في نهاية فترة حضانة معينة، وكمية أعداد الجزيئات الملتصقة أو الخلايا باستخدام المجهر 1. على الرغم من هذه المقايسات توفير نظرة كبيرة في العمليات البيوكيميائية وراء هذه التفاعلات، وجود قيود المفتاح هو عدم وجود تدفق السوائل الفسيولوجية (نموذجي من دوران الأوعية الدقيقة) وتأثيره على الجسيمات الالتصاق.
للتغلب على هذا القيد، وقد وضعت في المختبر غرف تدفق في السنوات الأخيرة. والعنصر المشترك من هذه الدوائر تدفق هو جهاز شفاف perfused في انخفاض أعداد رينولدز لتتناسب معدلات القص الجدار لوحظت في الأوعية الدموية في الجسم الحي 2. وعلى غرار جدار الوعاء الدموي إما عن طريق طلاء من الجزيئات الحيوية أو نمو الخلايا على سطح واحد من تدفق جهامبر 3. جزيئات أو خلايا 4-7 8-16 ثم يتم تدفقت في في النطاق المطلوب من معدلات التدفق لقياس عدد من التمسك الجسيمات تحت مختلف معدلات القص.
ومع ذلك، فإن استخدام لوحة موازية غرف تدفق للدراسة والتحقق من صحة الظواهر البيوكيميائية غير مكلفة نوعا ما وتستغرق وقتا طويلا. ويرجع ذلك أساسا إلى حقيقة أن تجارب متعددة تحتاج إلى أن تجرى لتوليد خريطة للالقص فلويديك مقابل عدد الجسيمات / خلايا الالتزام بذلك. بالإضافة إلى ذلك، تدفق غرف لوحة تتطلب كميات كبيرة من الكواشف بسبب الحجم الكبير منها (ارتفاع> 250 ميكرون وعرض> 1 مم). أخيرا، وهذه الأجهزة لا نموذج بدقة ملامح هندسية (على سبيل المثال، التشعبات) وظروف التدفق (على سبيل المثال، تتلاقى مقابل متباينة التدفقات) التي تكون موجودة في الجسم الحي.
وقد تسارعت التطورات الحديثة في الطباعة الحجرية القائمة على التصنيع الدقيق 17-19 مجال المختبر على واحد في رقاقةالأجهزة 20-21. وكانت هذه الأجهزة دور أساسي في تطوير نسخة مصغرة من غرفة تدفق موازية لوحة ذات أبعاد في نظام ميكرومتر. التخفيض في البعد ينتج أيضا فوائد كبيرة من حيث حجم الكواشف، والخلايا أو الجسيمات المطلوبة لإجراء التجارب. ومع ذلك، وجود قيود رئيسية من الأجهزة المتوفرة حاليا هي استخدام القنوات الخطية لنموذج microvessels، والتي لا تحاكي الأوعية الدموية الدقيقة المعقدة التي لوحظت في الجسم الحي.
وقد وضعنا مؤخرا منهجية جديدة لإعادة شبكات الاوعية الدموية الدقيقة على ركائز من البلاستيك القابل للتصرف يؤدي إلى تمثيل الاصطناعية للظروف في الجسم الحي. ووصف هذه الأجهزة يتم تطوير شبكات الاوعية الدموية الدقيقة SynVivo الاصطناعية (اس ام) باستخدام PDMS تستند عملية الطباعة الحجرية الناعمة. ويمكن استخدام أجهزة SynVivo-اس ام ان للحصول على خريطة التصاق القص من الخلايا / الجسيمات التصاق 22، استهدفت الدراسة تقديم الأدوية و23 ساعةافي تم التحقق من صحة البيانات في الجسم الحي ضد 24-25. في هذه الورقة، نقدم البروتوكول الذي تمكن الجيل من الخريطة التصاق القص من تجربة واحدة في أحجام صغيرة مثل 1-5 ميكرولتر مما يؤدي إلى وفورات كبيرة من الموارد والوقت.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. فتيلة الجهاز ميكروفلويديك SynVivo-SMN
- وتتألف كل منفذ (مدخل / مخرج) من الجهاز اثنين من المنافذ المتوازية - واحد لتتدفق في الأنصاف طلاء السطح (جزيئات الالتصاق، مصفوفات النمو، الخ) و / أو خلايا للبذار والآخر لتشغيل الفحص (الشكل 1A ).
- يغرق تماما SynVivo-اس ام ان الجهاز ميكروفلويديك (الشكل 1B) في طبق بتري تحتوي منزوع الأيونات معقمة (DI) المياه ووضع الطبق في مجفف فراغ. تسمح المجفف لتشغيل حتى يتم إزالة كل من الهواء من القنوات للجهاز. هذا ينبغي أن يستغرق حوالي 15 دقيقة.
- قبل إزالة الجهاز من المياه، ووضع أنابيب Tygon (OD 0.06 "ومعرف 0.02") معبي مع الماء في كل منفذ من الجهاز مع ملقط غرامة نقطة. يجب أن يكون الأنبوب حوالي 1 بوصة في الطول. ويمكن الآن إزالة الجهاز من الماء. يبين الشكل 1C صورة ديفيتشالبريد مع الأنابيب.
2. طلاء الجهاز ميكروفلويديك مع البروتين المطلوب (على سبيل المثال، أفيدين)
- باستخدام ماصة، ضع قطرة من الماء (حوالي 100 ميكرولتر) حول قاعدة الأنبوب منفذ مدخل واحد. إزالة بعناية أنابيب تستخدم لرئيس الجهاز. فإن قطرة ماء منع الهواء من الدخول إلى الجهاز.
- تحضير حقنة 1 مل محملة أفيدين في تركيز 20 ميكروغرام / مل. ربط الحقنة إلى 24 G إبرة الفولاذ المقاوم للصدأ والأنابيب. إدراج أنابيب إلى واحدة من الموانئ مدخل الجهاز. المشبك مدخل الميناء لا تستخدم مع المشبك الفك.
- حقن أفيدين بمعدل تدفق من 1 ميكرولتر / دقيقة لمدة 10 دقيقة للسماح نضح كاملة من الجهاز. في نهاية الوقت التدفق، المشبك الأنابيب مع المشبك الفك ووضع الجهاز على 4 درجات مئوية خلال الليل.
3. يتدفق على البيروكسيديز الجسيمات لتجارب التصاق
- يسمح الجهاز لتأتي إلى درجة حرارة الغرفة. وضع الجهاز على مجهر مضان مقلوب مجهزة مرحلة الآلية وكاميرا عالية الأداء.
- يعد حل من 2 ميكرون البيروكسيديز بتركيز 5 × 10 6 الجسيمات / مل في الفوسفات عازلة المالحة (PBS). تحميل الجزيئات إلى حقنة 1 مل. يعد الثاني حقنة 1 مل من برنامج تلفزيوني فقط. تحميل كل حقنة على ضخ حقنة والاتصال الإبرة والأنابيب.
- باستخدام ماصة، ضع قطرة من الماء (حوالي 100 ميكرولتر) حول قاعدة أنابيب مدخل الميناء. إزالة بعناية أنابيب تستخدم لمعطف الجهاز. فإن قطرة ماء منع الهواء من الدخول إلى الجهاز.
- إدراج أنابيب بعناية للجسيمات البيروكسيديز وPBS من الخطوة 3.2 في كل من الموانئ مدخل ويبين الشكل 2A صورة مجموعة المتابعة.
- بدء ضخ جزيئات البيروكسيديز بمعدل تدفق 2.5 ميكرولتر / دقيقة. مراقبة مدخل الميناء على المجهر. في أول بادرةمن الجزيئات، يبدأ الموقت ويستمر تدفق لمدة 3 دقائق.
- في نهاية دقيقة 3، ووقف تدفق الجسيمات البيروكسيديز حين يحدق في وقت واحد تدفق PBS بمعدل تدفق 2.5 ميكرولتر / دقيقة. يسمح برنامج تلفزيوني في التدفق في الجهاز لمدة 3 دقائق ليغسل الجزيئات غير منضم.
4. الحصول على الصور وجعل مجال الاهتمام (الهيئة) القياسات عن طريق برامج التصوير (NIKON عناصر)
- استخدام "تفحص صورة كبيرة" وظيفة في برامج التصوير للحصول على صورة الجهاز بأكمله.
- عدد بالتتابع والتشعبات في الجهاز وإنشاء الهيئة دائرية مع ضعف القطر من القنوات. في هذه الحالة، تعيين الهيئة قطرها إلى 200 ميكرومتر منذ قطرها القناة 100 ميكرون.
- استخدام وظيفة العد الآلي في برامج التصوير لتصدير عدد من الجسيمات في كل الهيئة إلى ورقة إكسل.
- وبالمثل، استخدم ميزة العد الآلي لتصدير عدد من الجزيئات في كاملالجهاز.
5. الجسيمات تحليل الجريان عن طريق ديناميات الموائع الحسابية (CFD) نماذج
- يتم تشغيل المحاكاة CFD باستخدام البرمجيات المتاحة تجاريا (CFD-ACE +، ESI شركة) لطوبولوجيا الجهاز SynVivo-SMN. يتم تخزين النتائج في قاعدة بيانات لتحليل الملاحظات التجريبية. المعلومات مخزن نتائج المحاكاة على معدلات جدار القص، والسرعة، وتدفق الجسيمات، والتصاق في الجهاز.
- وتستخدم نتائج المحاكاة لتحديد عدد من الجزيئات التي تدخل كل الهيئة على أساس تركيز الجسيمات مدخل معين.
6. توليد القص التصاق خريطة
- حساب٪ من التصاق بتقسيم جزيئات الالتزام في التشعب من الجزيئات المتدفقة في التشعب كما هو مبين في المعادلة 6.1.
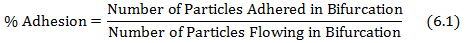
حيث يتم الحصول على عدد الجسيمات والجسيمات الالتزام المتدفقة من عrotocol الخطوات 4.3 و 5.2 على التوالي. - رسم خريطة القص التصاق باستخدام معدل القص في كل التشعب من الشبكات التي تم الحصول عليها من قاعدة البيانات في الخطوة (5.1) والقيم التصاق٪ تم الحصول عليها من المعادلة 6.1.
Access restricted. Please log in or start a trial to view this content.
النتائج
ويبين الشكل 1A التخطيطي وصورة مشرقة من حقل جهاز SynVivo-SMN. ويبين الشكل 1B الجهاز SynVivo-اس ام التي شنت على شريحة زجاجية. ويبين الشكل 1C الجهاز مع أنابيب التالية فتيلة مع الماء في مجفف فراغ.
الرقم 2A يظهر ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
بالتوازي غرف تدفق لوحة، في الوقت الذي توفر أفكارا هامة في خلية خلية وخلية الجسيمات التفاعلات، يعانون من العديد من القيود مثل ارتفاع استهلاك الكواشف والحاجة إلى أشواط تجريبية متعددة لإنشاء مخطط التصاق القص. استخدام شبكات الاوعية الدموية الدقيقة SynVivo الاصطناعية (SynVivo...
Access restricted. Please log in or start a trial to view this content.
Disclosures
رسوم النشر على هذا المقال برعاية مؤسسة البحوث CFD.
Acknowledgements
وقد تم تطوير تكنولوجيا SynVivo تحت منحة # 2R44HL076034 من NHLBI.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
References
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201(2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9(2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved