È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di Shear Adesione mappa usando SynVivo reti microvascolari sintetico
In questo articolo
Riepilogo
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
Abstract
Saggi di adesione cellulare / particelle sono fondamentali per comprendere le interazioni biochimiche coinvolte nella patofisiologia della malattia e avere importanti applicazioni nella ricerca per lo sviluppo di nuove terapie. I saggi che utilizzano condizioni statiche riescono a catturare la dipendenza di adesione su taglio, limitando la loro correlazione con l'ambiente in vivo. Camere di flusso piastra paralleli che quantificano l'adesione sotto il flusso del fluido fisiologico bisogno di più esperimenti per la generazione di una mappa adesione taglio. Inoltre, essi non rappresentano la scala in vivo e morfologia e richiedono grandi volumi (~ ml) di reagenti per esperimenti. In questo studio, abbiamo dimostrato la generazione di taglio mappa adesione da un singolo esperimento utilizzando una rete microvascolare basata dispositivo microfluidica, SynVivo-SMN. Questo dispositivo ricrea il complesso sistema vascolare vivo tra cui scala geometrica, elementi morfologici, le caratteristiche dei flussi e le interazioni cellulari in unformato in vitro, fornendo in tal modo un ambiente biologicamente realistico per ricerca di base e applicata nel comportamento cellulare, la consegna della droga, e la scoperta della droga. Il saggio è stato dimostrato studiando l'interazione dei 2 micron particelle biotina-avidina rivestite con superfici rivestite del microchip. L'intera gamma di taglio osservata nel microcircolo è ottenuta in un singolo saggio consenta adesione vs shear mappa per le particelle in condizioni fisiologiche.
Introduzione
Saggi attuali studiare per cellula-cellula e cellula-interazioni delle particelle tipicamente comportano statica formato pozzetti in cui le particelle o le cellule vengono incubate su matrici proteiche o cellule aderenti. Al termine del tempo di incubazione specificato, il numero di particelle aderenti o cellule vengono quantificati mediante microscopia 1. Anche se questi test forniscono informazioni significative sui processi biochimici che stanno dietro queste interazioni, una limitazione fondamentale è la mancanza di flusso del fluido fisiologico (tipico del microcircolo) e il suo impatto sulla adesione delle particelle.
Per superare questa limitazione, camere di flusso in vitro sono stati sviluppati negli ultimi anni. Un elemento comune di queste camere di flusso è un apparecchio trasparente perfusione a bassi numeri di Reynolds per abbinare i tassi di taglio della parete osservati nei vasi sanguigni in vivo 2. La parete del serbatoio è modellato da uno strato di biomolecole o crescita di cellule su una superficie del flusso cHamber 3. Particelle 4-7 o 8-16 cellule vengono poi scorreva dentro al campo desiderato di portate di quantificare il numero di aderire particelle sotto vari gradienti di velocità.
Tuttavia, l'utilizzo di camere di flusso piastra paralleli per studiare e validare i fenomeni biochimici è piuttosto costoso e richiede tempo. Ciò è dovuto principalmente al fatto che esperimenti multipli devono essere realizzati per generare una mappa della fluidico taglio rispetto al numero di particelle / cellule aderito. Inoltre, camere di flusso piastra richiedono grandi volumi di reagenti causa delle loro grandi dimensioni (altezza> 250 micron e larghezza> 1 mm). Infine, questi dispositivi non modellare accuratamente caratteristiche geometriche (ad esempio, biforcazioni) e condizioni di flusso (ad esempio, convergenti vs divergenti flussi) che sono presenti in vivo.
I recenti progressi nella litografia basata microfabbricazione 17-19 hanno accelerato il campo di lab-on-a-chipdispositivi di 20-21. Questi dispositivi hanno contribuito a sviluppare una versione miniaturizzata della camera di flusso a piatti paralleli con dimensioni in regime micrometro. La riduzione di dimensione produce anche vantaggi significativi in termini di volumi di reagenti, cellule o particelle richiesta per esperimenti. Tuttavia, una limitazione chiave dei dispositivi attualmente disponibili è l'uso di canali lineari per modellare microvasi, che non imitano il complesso microcircolo osservato in vivo.
Abbiamo recentemente sviluppato una nuova metodologia per ricreare le reti microvascolari su substrati di plastica usa e getta con conseguente rappresentazione sintetica delle condizioni in vivo. Questi dispositivi chiamati reti microvascolari SynVivo-sintetiche (SMN), sono sviluppate utilizzando PDMS basate processo soft-litografia. Dispositivi SynVivo-SMN possono essere utilizzati per ottenere shear mappa adesione di cellule / particella adesione 22, studio mirato consegna della droga 23 e have stato validato con i dati in vivo 24-25. In questo articolo, vi presentiamo un protocollo che consente la generazione della mappa di adesione al taglio da un singolo esperimento in volumi piccoli come 1-5 microlitri un conseguente notevole risparmio di risorse e di tempo.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Adescamento del dispositivo Microfluidic SynVivo-SMN
- Ogni porta (ingresso / uscita) del dispositivo comprende due porte parallele - una per fluire in frazioni rivestimento superficiale (molecole di adesione, matrici di crescita, ecc) e / o cellule di semina e l'altro per eseguire il test (Figura 1A ).
- Immergere completamente il dispositivo microfluidica SynVivo-SMN (Figura 1B) in una capsula di Petri contenente deionizzata sterile (DI) e posizionare il piatto in un essiccatore a vuoto. Lasciare l'essiccatore di eseguire fino a quando tutta l'aria viene rimosso dai canali del dispositivo. Questo dovrebbe durare circa 15 min.
- Prima di rimuovere il dispositivo dal acqua, mettere il tubo Tygon (diametro di 0,06 "e ID di 0,02") innescato con acqua in ogni porta del dispositivo con una pinza a punta fine. Il tubo deve essere di circa 1 pollice. Il dispositivo può essere rimosso dall'acqua. Figura 1C mostra immagine della devicoE Con il tubo.
2. Rivestimento del dispositivo Microfluidic con la proteina desiderata (ad esempio, Avidin)
- Usando una pipetta, una goccia di acqua (circa 100 ml) intorno alla base del tubo una porta di ingresso. Rimuovere con cautela il tubo utilizzato per innescare il dispositivo. La goccia d'acqua impedisce all'aria di entrare dispositivo.
- Preparare una siringa da 1 ml caricato con avidina ad una concentrazione di 20 ug / ml. Collegare la siringa un ago in acciaio inossidabile 24 G e tubi. Inserire il tubo ad una delle porte di ingresso del dispositivo. Bloccare la porta di ingresso non essere utilizzato con un morsetto mascella.
- Iniettare avidina ad un flusso di 1 ml / min per 10 min per permettere la completa perfusione del dispositivo. Alla fine del tempo di flusso, bloccare il tubo con il morsetto mascella e posizionare il dispositivo a 4 ° C per una notte.
3. Scorrere la Particelle Biotinylated per gli esperimenti di adesione
- Lasciare il dispositivoa temperatura ambiente. Posizionare il dispositivo su un microscopio invertito a fluorescenza equipaggiato con un tavolino motorizzato e una telecamera ad alte prestazioni.
- Preparare una soluzione di 2 micron particelle biotinilati ad una concentrazione di 5 x 10 6 particelle / ml in tampone fosfato salino (PBS). Caricare le particelle in una siringa da 1 ml. Preparare una seconda siringa da 1 ml di PBS solo. Caricare ogni siringa su una pompa a siringa e connettersi ago e tubo.
- Usando una pipetta, una goccia di acqua (circa 100 ml) intorno alla base del tubo di entrata. Rimuovere con cautela il tubo utilizzato per rivestire il dispositivo. La goccia d'acqua impedisce all'aria di entrare dispositivo.
- Inserire con cautela il tubo di particelle biotinilati e PBS dal punto 3.2 in ciascuna delle porte di ingresso. Figura 2A mostra l'immagine del set-up.
- Inizia iniettando particelle biotinilati ad una portata di 2,5 ml / min. Monitorare la porta di ingresso sul microscopio. Al primo segnodi particelle, avviare il timer e continuare flusso per 3 min.
- Alla fine del 3 min, fermare il flusso di particelle biotinilati contemporaneamente fissando il flusso di PBS ad una portata di 2,5 ml / min. Lasciare PBS di fluire nel dispositivo per 3 minuti per lavare via le particelle non legate.
4. Acquisizione di immagini e Fare area di interesse (AOI) Misure Utilizzo del software di imaging (NIKON Elements)
- Utilizzare la funzione "immagine di scansione grande" nel software di imaging per acquisire l'immagine dell'intero dispositivo.
- Numero sequenziale le biforcazioni nel dispositivo e creare una AOI circolare con due volte il diametro dei canali. In questo caso, impostare il diametro AOI a 200 micron in quanto il diametro del canale è di 100 micron.
- Utilizzare la funzione di conteggio automatico del software di imaging per esportare il numero di particelle in ogni AOI ad un foglio di MS Excel.
- Analogamente, utilizzare la funzione di conteggio automatico di esportare il numero di particelle nell'interadispositivo.
5. Particelle Flux Analisi Uso Computational Fluid Dynamics (CFD) Modelli
- Simulazioni CFD vengono eseguiti utilizzando il software disponibile in commercio (CFD-ACE +, ESI Inc.) per la topologia dispositivo SynVivo-SMN. I risultati sono memorizzati in un database per analizzare osservazioni sperimentali. I risultati della simulazione memorizzare le informazioni sui tassi di parete di taglio, velocità, flusso di particelle, e l'adesione nel dispositivo.
- I risultati della simulazione vengono utilizzati per determinare il numero di particelle che entrano ogni AOI basato su una determinata concentrazione di particelle in ingresso.
6. Generazione Shear adesione Map
- Calcolo della% di aderenza dividendo le particelle attaccate nella biforcazione dalle particelle che fluiscono nella biforcazione come mostrato nell'equazione 6.1.
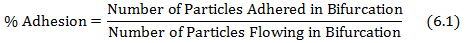
dove il numero di particelle e le particelle aderiscono scorre sono ottenuti da protocol i punti 4.3 e 5.2, rispettivamente. - Tracciare la mappa adesione shear utilizzando il gradiente di velocità ad ogni biforcazione delle reti ottenuti dal database nella fase (5.1) ed i valori di adesione% ottenuti dall'equazione 6.1.
Access restricted. Please log in or start a trial to view this content.
Risultati
La figura 1A mostra una immagine schematica campo chiaro e di dispositivo SynVivo-SMN. Figura 1B mostra il dispositivo SynVivo-SMN montato su un vetrino. Figura 1C mostra il dispositivo con la tubazione seguente priming con acqua in un essiccatore sotto vuoto.
Figura 2A mostra un'immagine della sperimentale-impostato. Figura 2B mostra un tipico dispositivo SynVivo-SMN avidina rivestite conseguente al leg...
Access restricted. Please log in or start a trial to view this content.
Discussione
Camere di flusso piastra paralleli, fornendo spunti significativi in interazioni cellula-cellula e cellula-particelle, soffrono di alcune limitazioni quali elevato consumo di reagenti e la necessità di molteplici prove sperimentali di generare una mappa adesione taglio. L'uso delle reti microvascolari SynVivo-sintetiche (SynVivo-SMNs) consente la generazione di una mappa di adesione al taglio da un singolo esperimento in condizioni che mimano le condizioni in vivo. Inoltre, si ottiene anche un rispar...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Tassa di pubblicazione per questo articolo sponsorizzato da CFD Research Corporation.
Riconoscimenti
La tecnologia SynVivo è stato sviluppato sotto concessione # 2R44HL076034 dal NHLBI.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
Riferimenti
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201(2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9(2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon