Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Génération de cisaillement d'adhésion Carte Utilisation SynVivo réseaux microvasculaires synthétique
Dans cet article
Résumé
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
Résumé
Cellules / particules tests d'adhésion sont essentielles à la compréhension des interactions biochimiques impliqués dans la physiopathologie de la maladie et des applications importantes dans la recherche pour le développement de nouveaux produits thérapeutiques. Tests utilisant des conditions statiques ne parviennent pas à capturer la dépendance de l'adhérence sur cisaillement, ce qui limite leur corrélation avec l'environnement in vivo. Parallèles chambres d'écoulement à plaques qui permettent de quantifier l'adhérence sous l'écoulement du fluide physiologique besoin de plusieurs expériences pour la génération d'une carte d'adhérence au cisaillement. En outre, ils ne représentent pas l'ampleur et de la morphologie in vivo et nécessitent de grands volumes (~ ml) de réactifs pour les expériences. Dans cette étude, nous avons démontré la génération de la carte d'adhérence au cisaillement à partir d'une seule expérience en utilisant un réseau microvasculaire basé dispositif microfluidique, SynVivo-SMN. Ce dispositif recrée le complexe dans le système vasculaire in vivo, y compris l'échelle géométrique, éléments morphologiques, les caractéristiques d'écoulement et les interactions cellulaires dans unFormat in vitro, fournissant ainsi un environnement biologiquement réaliste pour la recherche fondamentale et appliquée dans le comportement cellulaire, l'administration de médicaments, et la découverte de médicaments. Le dosage a été démontrée par l'étude de l'interaction des particules 2 um revêtue de la biotine avec des surfaces revêtues d'avidine de la micro-puce. L'ensemble de la gamme de cisaillement observée dans le système microvasculaire est obtenu en permettant à un seul essai d'adhérence par rapport à la carte de cisaillement pour les particules dans des conditions physiologiques.
Introduction
Les tests actuellement pour étudier à cellule-cellule et les interactions particule-cellulaires impliquent généralement statique format de plaque de puits dans lesquels les particules ou les cellules sont incubées sur des matrices de protéines ou de cellules adhérentes. A la fin du temps d'incubation spécifié, les nombres de particules ou de cellules adhérentes sont quantifiés en utilisant une microscopie. Même si ces tests donnent un aperçu significatif dans les processus biochimiques sous-tendent ces interactions, une limitation clé est l'absence de flux de liquide physiologique (typique de la microcirculation) et son impact sur l'adhérence des particules.
Pour surmonter cette limitation, in vitro dans les chambres d'écoulement ont été développés ces dernières années. Un élément commun de ces chambres d'écoulement est un dispositif transparent perfusé à faibles nombres de Reynolds pour correspondre à des taux de cisaillement de paroi observées dans les vaisseaux sanguins in vivo 2. La paroi de la cuve est modélisée par une ou l'autre revêtement de biomolécules ou de la croissance de cellules sur une surface de l'écoulement chambre 3. Particules 4-7 ou 8-16 cellules sont ensuite coulé dans au gamme désirée de débits de quantifier le nombre de particules adhérentes sous différents taux de cisaillement.
Cependant, l'utilisation de chambres d'écoulement parallèles de la plaque d'étudier et de valider les phénomènes biochimiques est assez cher et prend du temps. Ceci est principalement dû au fait que de multiples expériences doivent être réalisées pour générer un plan de cisaillement fluidique par rapport au nombre de particules / cellules adhérant. De plus, les chambres d'écoulement à plaques nécessitent de grands volumes de réactifs en raison de leur grande taille (hauteur> 250 pm et une largeur> 1 mm). Enfin, ces dispositifs ne modélisent pas exactement les caractéristiques géométriques (par exemple, des bifurcations) et des conditions de flux (par exemple, la convergence vs flux divergent) qui sont présents in vivo.
Les progrès récents dans la lithographie basée microfabrication 17-19 ont accéléré le domaine de lab-on-a-chiples dispositifs 20 à 21. Ces dispositifs ont contribué à l'élaboration d'une version miniaturisée de la chambre parallèle des flux de plaque avec des dimensions dans le régime de micromètre. La réduction de la dimension donne également des avantages importants en termes de volumes de réactifs, de cellules ou de particules requise pour les expériences. Cependant, une limitation essentielle des dispositifs actuellement disponibles est l'utilisation des canaux linéaires pour modéliser les microvaisseaux, qui ne reproduisent pas la microvascularisation complexe observé in vivo.
Nous avons récemment développé une nouvelle méthode pour recréer des réseaux microvasculaires sur des substrats en plastique jetables résultant en une représentation synthétique des conditions in vivo. Ces dispositifs appelés réseaux microvasculaires SynVivo-synthétiques (SMN) sont développés en utilisant PDMS processus lithographie douce à base. Dispositifs SynVivo-SMN peuvent être utilisés pour obtenir cisaillement carte d'adhésion de l'adhérence cellulaire / particules 22, étude l'administration de médicaments et 23 h cibléave été validé par des données in vivo 24-25. Dans cet article, nous présentons un protocole qui permet la génération de la carte d'adhésion de cisaillement d'une expérience unique dans des volumes aussi petits que 1-5 pi ce qui conduit à d'importantes économies de temps et de ressources.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. D'amorçage du dispositif microfluidique SynVivo-SMN
- Chaque port (entrée / sortie) de l'appareil est constitué de deux ports parallèles - une pour l'écoulement dans des fragments de revêtement de surface (molécules d'adhésion, des matrices de croissance, etc) et / ou des cellules destinées à l'ensemencement et l'autre pour l'exécution de l'essai (figure 1A ).
- Immerger complètement le dispositif microfluidique SynVivo-SMN (figure 1B) dans une boîte de Pétri contenant déminéralisée stérile (DI) et placez le plat dans un dessiccateur à vide. Laisser le dessiccateur à fonctionner jusqu'à ce que tout l'air est éliminé à partir des canaux de l'appareil. Cela devrait prendre environ 15 min.
- Avant de retirer l'appareil de l'eau, placer le tuyau Tygon (OD de 0,06 "et ID de 0,02") amorcée avec de l'eau dans chaque port de l'appareil avec pointes fines pinces. Le tube doit être d'environ 1 pouce de longueur. L'appareil peut maintenant être retiré de l'eau. Figure 1C montre l'image de la Device avec le tube.
2. Revêtement du dispositif microfluidique avec de la protéine souhaitée (par exemple, avidine)
- En utilisant une pipette, déposer une goutte de l'eau (environ 100 pi) autour de la base du tube d'un orifice d'entrée. Retirez délicatement le tube utilisé pour amorcer le dispositif. La goutte d'eau empêche l'air d'entrer dans le dispositif.
- Préparer une seringue de 1 ml chargé avec de l'avidine à une concentration de 20 pg / ml. Connectez la seringue à une aiguille et un tube en acier inoxydable 24 G. Insérer le tube pour l'un des ports du dispositif d'entrée. Serrer l'orifice d'entrée n'étant pas utilisée avec un dispositif de serrage de la mâchoire.
- Injecter de l'avidine à un débit de 1 pl / min pendant 10 min pour permettre la perfusion complète du dispositif. A la fin de la durée d'écoulement, serrer le tube avec la pince à mâchoires et placer le dispositif à 4 ° C pendant une nuit.
3. Circuler particules biotinylé pour les expériences d'adhérence
- Permettre au dispositif derevenir à la température ambiante. Placer l'appareil sur un microscope inversé à fluorescence équipé d'une platine motorisée et une caméra à haute performance.
- Préparer une solution de 2 um particules biotinylés à une concentration de 5 x 10 6 particules / ml dans le tampon phosphate salin (PBS). Charger les particules dans une seringue de 1 ml. Préparer une deuxième seringue de 1 ml de PBS seulement. Chargez chaque seringue sur une pompe à seringue et se connecter à l'aiguille et la tubulure.
- En utilisant une pipette, déposer une goutte de l'eau (environ 100 pi) autour de la base du tube de l'orifice d'entrée. Retirez délicatement le tube utilisé pour recouvrir le dispositif. La goutte d'eau empêche l'air d'entrer dans le dispositif.
- Insérez délicatement le tube de particules pour biotinylés et PBS de l'étape 3.2 dans chacun des ports d'entrée. Figure 2A montre l'image de la mise en place.
- Commencer l'injection de particules biotinylés à un débit de 2,5 ul / min. Surveillance de l'orifice d'entrée sur le microscope. Au premier signede particules, commencer la minuterie et continue de couler pendant 3 min.
- A la fin de la 3 min, arrêter le flux de particules tout en fixant simultanément biotinylés l'écoulement du PBS à un débit de 2,5 ul / min. Laisser PBS de s'écouler dans l'appareil pendant 3 minutes pour se laver de particules libres.
4. Acquisition d'images et effectuer une zone d'intérêt (AOI) Mesures Utilisation du logiciel d'imagerie (NIKON Elements)
- Utilisez la fonction "scan image de grande taille" dans le logiciel d'imagerie pour acquérir l'image de l'ensemble du dispositif.
- nombre séquentielle de bifurcations dans le dispositif et créer un AOI circulaire avec deux fois le diamètre des canaux. Dans ce cas, régler le diamètre AOI à 200 um depuis diamètre du canal est de 100 um.
- Utilisez la fonction de comptage automatisé dans le logiciel d'imagerie pour exporter le nombre de particules dans chaque AOI à une feuille Excel.
- De même, utiliser la fonction de comptage automatisé pour exporter le nombre de particules dans l'ensembledispositif.
5. Analyse de particules Flux Utilisation Computational Fluid Dynamics (CFD) Modèles
- Simulations CFD sont gérés en utilisant un logiciel disponible dans le commerce (CFD-ACE +, ESI Inc.) pour le dispositif topologie SynVivo-SMN. Les résultats sont stockés dans une base de données pour l'analyse des observations expérimentales. Le résultats de la simulation de stocker des informations sur les taux de cisaillement de paroi, la vitesse, le flux de particules, et l'adhérence dans le dispositif.
- Les résultats de simulation sont utilisées pour déterminer le nombre de particules entrant dans chaque zone d'intérêt sur la base de la concentration d'entrée de particules donnée.
6. Génération cisaillement adhérence Carte
- Calculer le% d'adhérence en divisant les particules adhérentes dans la bifurcation par les particules s'écoulant dans la bifurcation, comme indiqué dans l'équation 6.1.
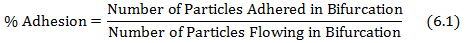
où le nombre de particules adhérées et les particules fluides sont obtenus à partir de la protocol les étapes 4.3 et 5.2, respectivement. - Tracer la carte d'adhésion de cisaillement en utilisant le taux de cisaillement à chaque bifurcation des réseaux obtenus à partir de la base de données à l'étape (5.1) et les valeurs d'adhérence% obtenus à partir de l'équation 6.1.
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 1A montre une image de champ lumineux et schématique de dispositif SynVivo-SMN. Figure 1B montre le dispositif SynVivo-SMN monté sur une lame de verre. Figure 1C montre le dispositif avec des tubes après sensibilisation avec de l'eau dans un dessicateur sous vide.
La figure 2A montre une image de l'expérimental-mis en place. Figure 2B montre un dispositif typique de l'avidine revêt...
Access restricted. Please log in or start a trial to view this content.
Discussion
Parallèles chambres d'écoulement de la plaque, tout en fournissant des indications importantes sur les interactions cellule-cellule et cellule-particules, souffrent de plusieurs limitations telles que la consommation élevée de réactifs et de la nécessité de multiples essais expérimentaux pour générer une carte d'adhérence au cisaillement. L'utilisation des réseaux microvasculaires SynVivo-synthétiques (SynVivo-SMNS) permet la génération d'une carte d'adhésion au cisaillement d'une...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Frais de publication de cet article parrainé par CFD Research Corporation.
Remerciements
Technologie SynVivo a été développé sous subvention # 2R44HL076034 du NHLBI.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
Références
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201(2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9(2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon