Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
SynVivo Sentetik Mikrovasküler Ağları kullanma Kesme Yapışma Haritası Üretimi
Bu Makalede
Özet
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
Özet
Hücre / tanecik yapışma deneyleri, hastalığın patofizyolojisinde rol biyokimyasal etkileşimleri anlaşılması için kritik olan ve yeni tedavilerin geliştirilmesi için arayışı içinde önemli bir uygulamaya sahiptir. Statik koşullar kullanılarak deneyler in vivo ortamı ile korelasyon sınırlama, kesme yapışması bağımlılığını yakalamak için başarısız. Fizyolojik sıvı akımı altında yapışma ölçmek paralel plaka akış oda, bir kesme yapışma haritasının üretilmesi için çok sayıda deney gerekir. Buna ek olarak, in vivo ölçek ve morfolojisi temsil etmez ve deneyler için reaktifler büyük miktarda (~ mi) gerektirir. Bu çalışmada, mikroakışkan cihaz, SynVivo-SMN dayalı bir mikrovasküler ağını kullanarak tek bir deneyden elde kesme yapışma haritanın üretilmesini göstermektedir. Bu cihaz, geometrik ölçek, morfolojik elemanlar, akış özellikleri ve bir hücresel etkileşimler de dahil olmak üzere in vivo damar karmaşık yenidenin vitro biçimi, böylece temel bir biyolojik gerçekçi ortam sağlayarak ve hücresel davranışı, ilaç dağıtım, ve ilaç keşfi uygulamalı araştırma. Deney mikroçip avidin kaplı yüzeyler ile 2 mikron biyotin kaplı partiküllerin etkileşimlerini incelemek ile gösterilmiştir. Mikrovasküler gözlenen makaslama tüm aralığı, fizyolojik koşullar altında parçacıkları için kesme harita karşı tek bir deney sağlayan bir yapışma elde edilir.
Giriş
Hücre-hücre ve hücre-partikül etkileşimlerini incelemek için deneyler, tipik haliyle Mevcut parçacıklar ya da hücrelerin protein matrisleri ya da yapışık hücreler üzerinde inkübe edildiği statik oyuklu plaka formatı içerir. Belirtilen inkübasyon süresi sonunda, yapışkan parçacıkların ya da hücre sayısı 1 mikroskopi kullanılarak ölçülür. Bu deneyler, bu etkileşimlerin arkasında biyokimyasal süreçlerin önemli fikir olsa da, önemli bir sınırlama (mikrodolaşımında tipik), fizyolojik sıvı akışının olmaması ve parçacık yapışması üzerindeki etkisidir.
Bu sınırlamayı aşmak için, in vitro akış gözlerinden son yıllarda geliştirilmiştir. Bu akış gözlerinden bir ortak öğesi 2, in vivo olarak kan damarlarında görülen duvar kesme hızları aynı düşük Reynolds sayılarında perfüze şeffaf bir aparattır. Damar duvarı akış c bir yüzeyi üzerinde biyomoleküllerin kaplama veya hücrelerin büyümesi biri ile modellenirhamber 3. Parçacıklar 4-7 veya 8-16 hücreler daha sonra çeşitli kayma oranlarının altında parçacıkları kalarak sayısını ölçmek için akış oranları istenilen aralığında aktı vardır.
Ancak, biyokimyasal olayları incelemek ve doğrulamak için paralel plaka akış odaları kullanımı oldukça pahalı ve zaman alıcıdır. Bu deneyler, çoklu partiküller yapışmış / hücrelerin sayısı genel akışkan kesme bir haritasını oluşturmak için yapılması gerekir olmasından kaynaklanmaktadır. Buna ek olarak, plaka akış odalar nedeniyle büyük boyutu (yükseklik> 250 mikron genişlik ve> 1 mm) için reaktifler büyük miktarda gerektirir. Son olarak, bu cihazlar doğru in vivo mevcut geometrik özellikleri (örneğin, çatallanma) ve akış koşulları (örn. akışlarını uzaklaşan vs yakınsak) modeli yok.
Litografi temelli Mikrofabrikasyona 17-19 son gelişmeler laboratuvarı-on-a-chip alanını hızlandırmıştırcihazlar 20-21. Bu cihazlar mikrometre rejiminde boyutları ile paralel plaka akış odasının bir minyatür versiyonu gelişmekte vesile olmuştur. Boyutunda azalma da reaktifler, hücreler ya da deneyler için gerekli olan parçacık büyüklükleri açısından önemli avantajlar elde edilir. Bununla birlikte, şu anda mevcut cihazlar önemli bir sınırlama, in vivo olarak gözlenen kompleks mikrovaskuleterini taklit etmez mikrodamarlar, Modele doğrusal kanallarının kullanılmasıdır.
Son zamanlarda in vivo koşulları sentetik temsil edilen bir tek kullanımlık plastik substratlar üzerine mikrovasküler ağlar yeniden oluşturmak için yeni bir metodoloji geliştirdik. Bu cihazlar SynVivo-Sentetik Microvascular Ağları (SMN) yumuşak litografi süreci tabanlı PDMS kullanılarak geliştirilmiştir adlandırılır. SynVivo-SMN cihazlar hücre / parçacık yapışmasının 22 kesme yapışma haritasını elde etmek için kullanılabilir, çalışma ilacı teslimat 23 ve h hedeflenenin vivo veri 24-25 karşı valide edilmiştir ave. Bu yazıda, 1-5 ul böylece kaynak ve zaman önemli tasarruflar elde kadar küçük hacimlerde tek bir deneyden elde kesme yapışma haritanın nesil sağlayan bir protokol mevcut.
Access restricted. Please log in or start a trial to view this content.
Protokol
1.. Astar SynVivo-SMN mikroakışkan Cihazı
- Cihazın her bir bağlantı noktası (giriş / çıkış), iki paralel bağlantı noktaları oluşur - yüzey kaplama parçaları içinde akan için, bir (yapışma molekülleri, büyüme matrisler, vb) ve / veya tohumlama ile analizi (Şekil 1A çalıştırmak için diğer için hücrelerin .)
- Tamamen steril deiyonize (DI) su içeren bir Petri kabındaki SynVivo-SMN mikroakışkan cihazı (Şekil 1B) daldırın ve bir vakum desikatöre koyunuz. Hava tüm cihazın kanalları kaldırılır kadar desikatör çalışmasına izin verir. Bu yaklaşık 15 dakika sürer.
- Su cihazını çıkarmadan önce, ince nokta forseps ile cihazın her noktasına su ile astarlanmalıdır Tygon tüpünü (0.06 OD "ve 0.02 kimliği") koyun. Boru uzunluğu, yaklaşık 1 inç olmalıdır. Cihaz artık sudan uzaklaştırılabilir. Şekil 1C deva ve görüntüyü gösterirboru ile e.
2.. Istenen protein ile mikroakışkan Cihaz kaplama (örneğin, avidin)
- Bir pipet kullanarak, bir giriş deliği boru tabanı etrafında, su (yaklaşık 100 ul) bir damla yerleştirin. Dikkatle asal cihaza kullanılan boru çıkarın. Suyun damla cihazı hava girmesini engeller.
- 20 ug / ml 'lik bir konsantrasyonda avidin ile yüklü bir 1 ml şırınga hazırlayın. Bir 24 G, paslanmaz çelik boru ve iğne için şırınga bağlayın. Cihazın giriş bağlantı noktalarından birine boru yerleştirin. Bir çene kelepçe ile kullanılmaktadır olmayan giriş noktası sıkıştırın.
- Cihazın tam perfüzyon izin vermek için 10 dakika için 1 ml / dk 'lık bir akış hızında enjekte edilir avidin. Akış süresi sonunda, çene kelepçe ile boru kelepçe ve gece boyunca 4 ° C'de cihazı yerleştirin.
3.. Yapışma Deneyleri Biyotinilat Partiküllerini Akan
- Cihazı izin verOda sıcaklığına kadar gelir. , Bir motorlu kaide ile yüksek performanslı bir kamera ile donatılmış bir ters flüoresan mikroskop üzerine yerleştiriniz.
- Fosfat tamponlu salin (PBS) içinde 5 x 10 6 partikül / ml 'lik bir konsantrasyonda biyotinile edilmiş 2 um parçacıklar içinde bir çözeltisi hazırlandı. Bir 1 ml şırınga içine parçacıkların yerleştirin. Sadece PBS ikinci bir 1 ml şırınga hazırlayın. Bir şırınga pompa üzerine yerleştirin ve her bir şırınga ve iğne boru bağlanabilir.
- Bir pipet kullanarak, giriş deliği boru tabanı etrafında, su (yaklaşık 100 ul) bir damla yerleştirin. Dikkatlice kat cihaz için kullanılan boru çıkarın. Suyun damla cihazı hava girmesini engeller.
- Dikkatle giriş portları her birine adım 3.2 'den biyotinilatlı parçacıklar ve PBS için boru adlı yerleştirin. Şekil 2A set-up görüntü gösterir.
- 2.5 ul / dk 'lık bir akış hızında enjekte biyotinile parçacıkları başlatın. Mikroskop giriş noktasını izleyin. Ilk işaretiparçacıkların, zamanlayıcı başlar ve 3 dakika boyunca akışı devam eder.
- Eş zamanlı olarak 2,5 ul / dk 'lık bir akış hızında PBS akışını bakan ise 3 dakika sonunda, biyotinlenmiş parçacıkların akışını durdurmak. PBS bağlanmamış parçacıkları yıkamak için 3 dakika boyunca cihazdaki akmasına izin verin.
4. Görüntüler Kazanılması ve Görüntüleme Yazılımı (NIKON Elemanları) kullanarak Faiz (AOI) Ölçümlerinin Alanı Yapımı
- Tüm cihazın görüntüsünü elde etmek için görüntüleme yazılımı "tarama büyük resim" işlevini kullanın.
- Cihazdaki Sırasıyla sayı çatallanma ve kanalların iki katı çapa sahip olan dairesel AOI oluşturun. Kanal çapı 100 um olduğu için, bu durumda, 200 um çapı AOI ayarlayın.
- MS Excel sayfası her AOI parçacıkların sayısını ihracat görüntüleme yazılımı otomatik sayım işlevini kullanın.
- Benzer şekilde, in the entire parçacıkların sayısını vermek için otomatik sayım özelliği kullanmakcihaz.
5.. Computational Fluid Dynamics (CFD) modelleri kullanarak Partikül Akı Analizi
- CFD simülasyonları SynVivo-SMN cihaz topoloji için mevcut ticari yazılım (CFD-ACE + ESI, Inc) kullanılarak çalıştırılır. Sonuçlar deneysel gözlemleri analiz etmek için bir veritabanında saklanır. Duvar kayma oranları, hız, parçacık akı, ve cihazda yapışması üzerinde simülasyon sonuçları saklar.
- Simülasyon sonuçları, belirli bir giriş partikül konsantrasyonuna bağlı olarak, her AOI giren parçacıkların sayısını belirlemek için kullanılır.
6.. Yaratma Kesme Yapışma Haritası
- Denklem 6.1 'de gösterildiği gibi, çatallanma akan parçacıkların çatallanma olarak yapışmış parçacıklar bölünmesiyle yapışmasının% hesaplayın.
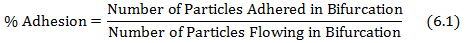
yapışmış parçacıklar ve akan parçacık sayısı p elde edilir buradaotokol sırasıyla, 4.3 ve 5.2 adımları. - Basamak (5.1) 'de veri tabanından elde ağları ve denklem 6.1' den elde edilen% yapışma değerlerinin her bifürkasyonunda kesilme hızı kullanılarak ilk kesme yapışma çizilir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Şekil 1A-SynVivo SMN cihazının bir şematik ve parlak saha görüntüsünü gösterir. Şekil 1B, bir cam slayt üzerine monte SynVivo-SMN cihazı. Şekil 1C bir vakumlu desikatör içinde su ile astar boru takımı ile birlikte cihazı göstermektedir göstermektedir.
Şekil 2A, 2 um biyotinile edilmiş parçacıkların bağlayıcı Aşağıda, tipik bir avidin kaplı SynVivo-SMN cihazını göstermektedir, deney set up....
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Paralel plaka akış odası, hücre-hücre ve hücre-parçacık etkileşimleri hakkında önemli bilgiler sağlarken, bu tür yüksek reaktif maddelerin tüketimi ve bir kesme yapışma haritası oluşturmak için birden fazla deney çalışmaları için ihtiyaç olarak çeşitli kısıtlamalara maruz kalmıştır. SynVivo Sentetik Mikrovasküler Ağlar (SynVivo-SMNs) kullanılması vivo koşullarında taklit eden koşullarda tek bir deneyden gelen bir kesme yapışma haritanın üretilmesini sağlar. Ayrıca, ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
CFD Research Corporation tarafından desteklenen bu yazı için yayın ücreti.
Teşekkürler
SynVivo teknoloji enstitünün hibe # 2R44HL076034 altında geliştirilmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
Referanslar
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201(2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9(2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır