A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דור של שאר הידבקות מפה באמצעות רשתות כלי הדם סינטטיים SynVivo
In This Article
Summary
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
Abstract
מבחני הידבקות תא / חלקיקים הם קריטיים להבנת האינטראקציות ביוכימיים מעורבות בפתופיזיולוגיה מחלה ויש יישומים חשובים במסע לפיתוח תרופות חדשניות. מבחני באמצעות תנאים סטטיים מצליחים ללכוד את התלות של הידבקות בגזירה, הגבלת המתאם שלהם עם סביבת in vivo. תאי זרימת צלחת מקבילים שלכמת הידבקות תחת זרימת נוזל פיזיולוגית צריכים ניסויים מרובים עבור הדור של מפת הידבקות גזירה. בנוסף, הם לא מייצגים את vivo קנה מידה ומורפולוגיה ובדורשים כמויות גדולות (~ מיליליטר) של חומרים כימיים לניסויים. במחקר זה, אנו מדגימים את הדור של מפת הידבקות גזירה מניסוי בודד באמצעות רשת כלי הדם מכשיר microfluidic, SynVivo-SMN מבוסס. מכשיר זה יוצר מחדש מורכב בכלי דם vivo כולל בקנה מידה גיאומטרית, אלמנטים מורפולוגיים, זרימת תכונות ואינטראקציות הסלולר בפורמט במבחנה, ובכך לספק סביבה ביולוגית מציאותית למחקר בסיסי ויישומי בהתנהגות סלולרית, אספקת סמים, וגילוי תרופות. Assay הודגם על ידי בוחן את האינטראקציה של 2 מיקרומטר החלקיקים מצופה ביוטין עם משטחים מצופים avidin של השבב האלקטרוני. מגוון השלם של גזירה שנצפתה בנימי הדם מתקבל בהידבקות assay מאפשר אחת לעומת מפת גזירה לחלקיקים בתנאים פיסיולוגיים.
Introduction
מבחני הנוכחיים ללמוד לתאי תאים ואינטראקציות חלקיקי תאים בדרך כלל כרוכים פורמט צלחת גם סטטי שבו חלקיקים או תאים מודגרת על מטריצות חלבונים או תאים חסיד. בסוף זמן הדגירה שצוין, המספרים של חלקיקים או תאים חסיד הם לכמת באמצעות מיקרוסקופ 1. למרות שמבחנים אלה מספקים תובנה משמעותית לתהליכים ביוכימיים מאחורי האינטראקציות הללו, למגבלה העיקרית היא חוסר זרימה פיזיולוגית נוזל (אופיינית של זרימת דם) והשפעתה על הידבקות של חלקיקים.
כדי להתגבר על מגבלה זו, במבחנה זרימת תאים פותחו בשנים האחרונות. אלמנט משותף של זרימת תאים אלה הוא מנגנון שקוף perfused במספרי ריינולדס נמוכים כדי להתאים שיעורי גזירה קיר נצפו בכלי דם בvivo 2. קיר הכלי הוא מודל או על ידי ציפוי של ביומולקולות או צמיחה של תאים על משטח אחד של הזרימה גhamber 3. חלקיקים 4-7 או תאים 8-16 מכן זרמו בטווח רצוי של ספיקות לכמת את מספר הדבקות חלקיקים תחת שיעורי גזירה שונים.
עם זאת, השימוש בזרימת צלחת תאים במקביל ללימודים ולאמת את התופעות ביוכימיות הוא די יקר וזמן רב. זאת בעיקר בשל העובדה כי ניסויים מרובים צריכים להתנהל ליצירת מפה של הגזירה fluidic לעומת מספר חלקיקים / תאים דבקים. בנוסף, זרימת צלחת תאים דורשים כמויות גדולות של חומרים כימיים בשל גודלם הגדול (גובה> 250 מיקרומטר ומ"מ הרוחב> 1). לבסוף, מכשירים אלה אינם מדויקים מודל תכונות גיאומטריות (למשל, bifurcations) ותנאי זרימה (למשל, מתכנס לעומת לסטות תנועות) שנמצאות בגוף חי.
ההתקדמות שחלה באחרונה בmicrofabrication יתוגרפיה מבוססת 17-19 האיצה את השדה של מעבדה על שבבהתקני 20-21. התקנים אלה כבר סייעו בפיתוח גרסה מוקטנת של זרימת צלחת קאמרית המקבילה עם ממדים במשטר מיקרומטר. הירידה בממד גם תשואות יתרונות משמעותיים במונחים של כמויות של חומרים כימיים, תאים או חלקיקים הנדרשים לניסויים. עם זאת, מגבלה העיקרית של המכשירים הזמינים כרגע היא השימוש בערוצים ליניארי למודל microvessels, שאינו מחקים את נימי הדם המורכבים שנצפו in vivo.
יש לנו לאחרונה פיתחו מתודולוגיה חדשנית ליצירה מחדש של רשתות כלי הדם על גבי מצעי פלסטיק חד פעמי וכתוצאה מהייצוג סינטטי של in vivo התנאים. מכשירים אלה מכונים רשתות כלי הדם SynVivo-סינתטיות (SMN) מפותחים באמצעות PDMS תהליך הרך ליתוגרפיה מבוססת. מכשירי SynVivo-SMN יכולים לשמש כדי לקבל מפת הידבקות גזירה של הידבקות תא / חלקיקים 22, מחקר ממוקד משלוח סמים 23 ושעותולהעיף אומת נגד בנתונים vivo 24-25. במאמר זה, אנו מציגים פרוטוקול המאפשר לדור של מפת הידבקות גזירה מניסוי בודד בכמויות קטנות כמו 1-5 μl ובכך וכתוצאה מכך החיסכון משמעותי של משאבים וזמן.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. קרקע מכשיר microfluidic SynVivo-SMN
- כל יציאה (כניסה / יציאה) של המכשיר מורכבת משתי יציאות במקבילות - אחד לזורם בmoieties ציפוי פני השטח (מולקולות הדבקות, מטריצות צמיחה, וכו ') ו / או תאים לזריעה ואחרת להפעלת assay (איור 1 א ).
- לחלוטין להטביע את מכשיר microfluidic SynVivo-SMN (איור 1) בצלחת פטרי המכילה מים deionized סטרילי (DI) ומניח את הצלחת לייבוש ואקום. לאפשר ייבוש לרוץ עד שכל האוויר הוא להסיר את הערוצים של המכשיר. זה אמור לקחת כ 15 דקות.
- לפני הסרת ההתקן מהמים, במקום צינור Tygon (OD של 0.06 "ותעודת זהות של 0.02") דרוך עם מים לכל יציאה של המכשיר עם מלקחיים בסדר נקודה. צינורות צריכים להיות כ 1 סנטימטר באורך. המכשיר כעת ניתן להסיר מן המים. תרשים 1C מציג תמונה של devicE עם צינורות.
2. ציפוי מכשיר microfluidic עם חלבון רצוי (למשל, Avidin)
- בעזרת פיפטה, מקום טיפה של מים (כ 100 μl) מסביב לבסיס של צינור יציאת כניסה אחת. מוציא בזהירות את צינורות המשמשים לראש המכשיר. טיפת מים תמנע אוויר מלהיכנס למכשיר.
- הכן את מזרק 1 מיליליטר עמוס avidin בריכוז של 20 מיקרוגרם / מיליליטר. חבר את המזרק למחט נירוסטה 24 G וצינורות. הכנס את צינורות לאחת מיציאות המפרצון של המכשיר. הצמד את יציאת הכניסה לא מנוצל עם מהדק לסת.
- הזרק avidin בקצב זרימה של μl / 1 דקות ל10 דקות כדי לאפשר לטפטוף של המכשיר מלא. בסופו של זרימת הזמן, מהדק את צינורות עם מהדק הלסת ולהניח את המכשיר על 4 מעלות צלזיוס למשך לילה.
3. מזרימים חלקיקי Biotinylated לניסויים בהידבקות
- אפשר להתקןמגיע לטמפרטורת חדר. מניחים את המכשיר על מיקרוסקופ פלואורסצנטי הפוך מצוידים בשלב ממונע וביצועים גבוהים מצלמה.
- הכן פתרון של 2 מיקרומטר חלקיקי biotinylated בריכוז של 5 x 10 6 / מיליליטר חלקיקים בפוספט הצפת מלוח (PBS). טען את החלקיקים לתוך מזרק 1 מיליליטר. הכן את מזרק 1 מיליליטר של PBS שני בלבד. טען כל מזרק במשאבת מזרק ולהתחבר למחט וצינורות.
- בעזרת פיפטה, מקום טיפה של מים (כ 100 μl) מסביב לבסיס של צינור יציאת כניסה. מוציא בזהירות את צינורות משמשים מעיל המכשיר. טיפת מים תמנע אוויר מלהיכנס למכשיר.
- בזהירות להכניס את צינורות של חלקיקי biotinylated וPBS משלב 3.2 לכל אחת מיציאות המפרצון. איור 2A מציג תמונה של ההגדרה.
- התחל הזרקת חלקיקי biotinylated בקצב זרימה של 2.5 μl / min. לפקח על יציאת כניסה על המיקרוסקופ. עם הסימן הראשוןשל חלקיקים, מתחיל את שעון העצר ולהמשיך את הזרימה במשך 3 דקות.
- בסופו של 3 דקות, לעצור את הזרם של חלקיקי biotinylated תוך בוהה הזרימה של PBS בקצב זרימה של 2.5 μl / min בו זמנית. לאפשר PBS לזרום במכשיר במשך 3 דקות כדי לשטוף את החלקיקים מאוגדים.
4. רכישת תמונות והפיכת שטח ריבית מדידות (AOI) באמצעות תוכנת הדמיה (NIKON אלמנטים)
- השתמש בפונקצית "תמונה גדולה סריקה" בתוכנת ההדמיה לרכישת התמונה של המכשיר כולו.
- המספר ברצף bifurcations במכשיר וליצור AOI עגול עם הקוטר כפול של הערוצים. במקרה זה, קבע את קוטר AOI ל200 מיקרומטר מאז קוטר ערוץ 100 מיקרומטר.
- השתמש בפונקצית הספירה האוטומטית בתוכנת ההדמיה כדי לייצא את מספר החלקיקים בכל אחד AOI לגיליון MS Excel.
- כמו כן, השתמש בתכונת הספירה האוטומטית לייצא את מספר החלקיקים בכלמכשיר.
5. חלקיקים שטף ניתוח באמצעות דינמיקת נוזלים חישובית מודלים (CFD)
- סימולציות CFD מנוהלות באמצעות תוכנה זמינה באופן מסחרי (CFD-ACE +, ESI Inc) לטופולוגיה מכשיר SynVivo-SMN. התוצאות מאוחסנות במסד נתונים לניתוח תצפיות ניסיוניות. לאחסן מידע תוצאות סימולציה על שיעורי קיר גזירה, מהירות, שטף חלקיקים, והידבקות שבמכשיר.
- תוצאות הסימולציה משמשות כדי לקבוע את מספר החלקיקים הנכנסים כל AOI מבוסס על ריכוז חלקיקי כניסה נתון.
6. יצירה שאר הידבקות מפה
- חישוב% מהידבקות על ידי חלוקת החלקיקים דבקו בהסתעפות על ידי החלקיקים הזורמים בהסתעפות כפי שמוצג במשוואה 6.1.
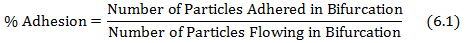
שבו מספר חלקיקי דבק והחלקיקים זורמים מתקבלים מprotocol צעדים 4.3 ו5.2, בהתאמה. - מגרש את מפת הידבקות הגזירה באמצעות שיעור הגזירה בכל הסתעפות של הרשתות נלקחו מבסיס הנתונים בשלב (5.1) וערכי הידבקות% מתקבלים ממשוואה 6.1.
Access restricted. Please log in or start a trial to view this content.
תוצאות
איור 1 א מציג סכמטית ותמונת שדה בהירה של מכשיר SynVivo-SMN. איור 1 מציג את מכשיר SynVivo-SMN רכוב על שקופיות זכוכית. תרשים 1C מציג את המכשיר עם צינורות הבאים תחול במים בייבוש ואקום.
איור 2 א מראה תמונה של למע?...
Access restricted. Please log in or start a trial to view this content.
Discussion
זרימת צלחת תאים מקבילים, תוך מתן תובנות משמעותיות לתוך תאי תאי אינטראקציות ותא חלקיקים, סובלים מכמה מגבלות כגון הצריכה גבוהה של חומרים כימיים והצורך בריצות ניסיוניות מרובות כדי ליצור מפת הידבקות גזירה. השימוש ברשתות SynVivo סינטטיות כלי הדם (SynVivo-SMNs) מאפשר את הדור של מפת...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אגרת פרסום לכתבה זו בחסות חברת מחקר CFD.
Acknowledgements
טכנולוגית SynVivo פותחה תחת מענק # 2R44HL076034 מNHLBI.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
References
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201(2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9(2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved