Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Erzeugung von Scherhaft Karte Mit SynVivo Synthetische mikrovaskuläre Networks
In diesem Artikel
Zusammenfassung
Flow chambers used in adhesion experiments typically consist of linear flow paths and require multiple experiments at different flow rates to generate a shear adhesion map. SynVivo-SMN enables the generation of shear adhesion map using a single experiment utilizing microliter volumes resulting in significant savings in time and consumables.
Zusammenfassung
Handy / Partikelhaftung Tests sind entscheidend für das Verständnis der biochemischen Interaktionen in Krankheit Pathophysiologie beteiligt und haben wichtige Anwendungen in der Suche nach der Entwicklung neuartiger Therapeutika. Tests mit statischen Bedingungen nicht um die Abhängigkeit der Haftung auf Scher erfassen, was ihre Korrelation mit in vivo-Umgebung. Parallelplattenflusskammern, die die Haftung unter physiologischen Fluidstrom zu quantifizieren müssen mehrere Experimente zur Erzeugung einer Scherhaft Karte. Darüber hinaus müssen sie nicht unbedingt die in vivo-Skala und Morphologie und erfordern große Volumina (~ ml) Reagenzien für die Experimente. In dieser Studie zeigen wir die Erzeugung von Scherhaftung Karte aus einem einzigen Experiment unter Verwendung einer mikrovaskulären Netzwerk basierend Mikrofluidikvorrichtung SynVivo-SMN. Das Gerät erstellt die komplexen in vivo Gefäßsystem einschließlich geometrischen Maßstab, morphologische Elemente, Strömungsmerkmale und zellulären Interaktionen in einIn-vitro-Format, wodurch eine biologisch realistische Umgebung für grundlegende und angewandte Forschung in Zellverhalten, Drug Delivery und Drug Discovery. Der Test wurde durch die Untersuchung der Wechselwirkung der 2 um Biotin-beschichteten Teilchen mit Avidin-beschichteten Oberflächen der Mikrochip gezeigt. Der gesamte Bereich der Scherung in der Mikrovaskulatur beobachtet in einem einzelnen Assay ermöglicht Adhäsion gegenüber der Scher Karte für die Partikel unter physiologischen Bedingungen erhalten wird.
Einleitung
Aktuelle Assays auf Zell-Zell-und Zell-Teilchen-Wechselwirkungen untersuchen typischerweise statische Well-Plattenformat, in welchem Teilchen oder Zellen auf Protein-Matrices oder adhärente Zellen inkubiert. Am Ende der angegebenen Inkubationszeit werden die Zahlen der anhaftenden Teilchen oder Zellen unter Verwendung von 1-Mikroskopie quantifiziert. Auch wenn diese Untersuchungen liefern wichtige Einblicke in die biochemischen Prozesse hinter dieser Wechselwirkungen ist eine wesentliche Einschränkung, der Mangel an physiologischen Flüssigkeitsstrom (typisch für die Mikrozirkulation) und ihre Auswirkungen auf die Partikelhaftung.
Um diese Einschränkung zu überwinden, wurden in-vitro-Strömungskammern in den letzten Jahren entwickelt worden. Ein gemeinsames Element dieser Strömungskammern ist ein transparentes Gerät bei niedrigen Reynolds-Zahlen an der Wand der Blutgefäße in vivo 2 beobachtet Scherraten entsprechen durchblutet. Die Behälterwand wird entweder durch Beschichtung von Biomolekülen oder das Wachstum von Zellen auf einer Oberfläche des Strömungs c modelliertHamber 3. Partikel oder Zellen 4-7 8-16 werden dann flossen bei gewünschten Durchsatzbereich, die Anzahl der anhaftenden Partikeln unter verschiedenen Scherraten zu quantifizieren.
Jedoch ist die Verwendung von parallelen Plattenströmungskammern zu studieren und zu validieren die biochemische Phänomene ziemlich teuer und zeitaufwendig. Dies ist vor allem aufgrund der Tatsache, dass mehrere Versuche benötigen, um zum Erzeugen einer Karte von der Fluidscher gegen die Anzahl der Partikel / Zellen haften geführt werden. Außerdem Platte Strömungskammern erfordern große Mengen von Reagenzien aufgrund ihrer Größe (Höhe> 250 um und einer Breite von> 1 mm). Schließlich sind diese Geräte nicht genau modellieren geometrische Merkmale (zB Bifurkationen) und Durchflussbedingungen (z. B. gegen konvergierenden divergierenden Ströme), die in vivo vorhanden sind.
Jüngste Fortschritte in der Lithographie Mikro 17-19 haben den Bereich der Lab-on-a-Chip beschleunigtGeräte 20-21. Diese Geräte waren maßgeblich an der Entwicklung eines miniaturisierten Version der Parallelplattenlaufkammer mit Abmessungen im Mikrometerbereich. Die Reduzierung der Dimension ergibt auch erhebliche Vorteile in Bezug auf die Mengen von Reagenzien, Zellen oder Partikel für die Experimente erforderlich. Eine wesentliche Einschränkung, die derzeit erhältlichen Vorrichtungen ist jedoch die Verwendung von linearen Kanälen Mikrogefäßen, die den in vivo beobachteten komplexen Mikrogefäß nicht zu imitieren ist modellieren.
Wir haben kürzlich ein neues Verfahren zur Wieder mikrovaskulärer Netzwerke auf Einweg-Kunststoffsubstraten, was zu synthetischen Darstellung der in vivo-Bedingungen entwickelt. Diese Geräte bezeichnet SynVivo-Synthetic mikrovaskuläre Networks (SMN) werden mit PDMS-basierte Soft-Lithographie-Prozess entwickelt. SynVivo SMN-Geräte können verwendet werden, um die Scherhaft Karte von Zell / Partikelhaftung 22 zu erhalten, Studien gezielten Wirkstofftransport und 23 have gegen in-vivo-Daten 24-25 validiert. In diesem Beitrag stellen wir ein Protokoll, dass die Erzeugung der Schubhaft Karte aus einem einzigen Experiment in Volumen so klein wie 1-5 ul was zu erheblichen Einsparungen von Ressourcen und Zeit ermöglicht.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Auffüllen der SynVivo-SMN Mikrofluidikvorrichtung
- Jeder Port (Einlass / Auslass) der Vorrichtung besteht aus zwei parallelen Ports umfaßt - eine für Oberflächenbeschichtungseinheiten fließt (Adhäsionsmoleküle, Wachstums Matrizen, etc.) und / oder Zellen zum Impfen und die andere für die Testdurchführung (1A ).
- Komplett Tauchen Sie das SynVivo-SMN Mikrofluidik-Vorrichtung (Abbildung 1B) in einer Petrischale sterilem deionisiertem (DI), das Wasser und die Schale in einen Vakuumtrockenschrank. Erlauben der Exsikkator ausgeführt, bis die gesamte Luft aus den Kanälen der Vorrichtung entfernt. Dies sollte etwa 15 Minuten dauern.
- Bevor Sie das Gerät aus dem Wasser, legen Tygon-Schlauch (OD von 0,06 "und ID von 0,02") mit Wasser vorbereitet in jedes Port des Gerätes mit feinen Punkt Pinzette. Der Schlauch sollte etwa 1 cm lang sein. Das Gerät kann nun aus dem Wasser entfernt werden. 1C zeigt Bild des DevicE mit dem Schlauch.
2. Beschichtung der mikrofluidischen Vorrichtung mit gewünschten Protein (z. B. Avidin)
- Mit einer Pipette einen Tropfen Wasser (etwa 100 ul), um die Basis des einen Einlaßanschlußschlauch. Den Schlauch mit dem Gerät verwendet prime vorsichtig entfernen. Der Wassertropfen wird Luft in das Gerät zu verhindern.
- Bereiten einer 1 ml Spritze mit Avidin beladen in einer Konzentration von 20 ug / ml. Schließen Sie die Spritze zu einer 24 G Nadel aus Edelstahl und Schläuche. Stecken Sie den Schlauch an einer der Einlassöffnungen des Gerätes. Klemmen Sie die Einlassöffnung nicht mit einem Backenschelle eingesetzt.
- Injizieren Avidin bei einer Flussrate von 1 &mgr; l / min für 10 Minuten, um eine vollständige Perfusion der Vorrichtung zu ermöglichen. Am Ende des Durchflusszeit, klemmen Sie den Schlauch mit dem Kieferklemme und stellen Sie das Gerät bei 4 ° C über Nacht.
3. Mitteln des biotinylierten Partikel Haftung für Experimente
- Lassen Sie das Gerät anauf Raumtemperatur kommen. Stellen Sie das Gerät auf einem inversen Fluoreszenzmikroskop mit einem motorisierten Bühne und einem Hochleistungs-Kamera ausgestattet.
- Eine Lösung von 2 um biotinylierten Partikel in einer Konzentration von 5 x 10 6 Partikeln / ml in phosphatgepufferter Kochsalzlösung (PBS). Laden der Teilchen in einer 1 ml-Spritze. Bereiten Sie eine zweite 1-ml-Spritze von nur PBS. Legen Sie jede Spritze auf eine Spritzenpumpe und eine Verbindung zu Nadel und Schläuche.
- Mit einer Pipette einen Tropfen Wasser (etwa 100 ul), um die Basis des Einlasses Schläuche. Den Schlauch zu beschichten das Gerät verwendet, vorsichtig entfernen. Der Wassertropfen wird Luft in das Gerät zu verhindern.
- Vorsichtig den Schlauch für biotinylierten Teilchen und PBS aus Schritt 3.2 in jede der Einlassöffnungen. 2A zeigt Bild von der Set-up.
- Einspritzen beginnen biotinylierten Partikel mit einer Durchflussrate von 2,5 ml / min. Überwachung der Einlaßöffnung auf dem Mikroskop. Beim ersten Anzeichenvon Partikeln, beginnen Sie den Timer und Fluss weiterhin für 3 min.
- Am Ende der 3 min, Auslaufen des biotinylierten Partikel, während gleichzeitig die Strömung des starren PBS bei einer Flussrate von 2,5 ml / min. Lassen PBS in der Einrichtung für 3 min fließen zu waschen ungebundene Partikel.
4. Erwerb von Bildern und Erstellen Area of Interest (AOI) Messungen mit Imaging-Software (NIKON Elements)
- Mit der Funktion "Scan-große Bild" in der Imaging-Software, um das Bild der gesamten Einrichtung zu erwerben.
- Nacheinander die Anzahl Gabelungen im Gerät und eine kreisförmige AOI mit der doppelten Durchmesser der Kanäle. In diesem Fall den AOI Durchmesser bis 200 um, da die Kanaldurchmesser beträgt 100 um.
- Verwenden Sie die automatisierte Zählung Funktion in der Bildbearbeitungssoftware, um die Anzahl der Teilchen in jedem AOI in eine MS Excel-Tabelle exportieren.
- Ebenso nutzen die automatisierte Zählung-Funktion, um die Anzahl der Teilchen in der gesamten exportierenGerät.
5. Particle Flux Analyse mit Computational Fluid Dynamics (CFD) Modelle
- CFD-Simulationen werden mit kommerziell erhältlicher Software (CFD-ACE +, Inc. ESI) für den SynVivo-SMN Gerätetopologie laufen. Die Ergebnisse werden in einer Datenbank zur Analyse von experimentellen Beobachtungen gespeichert. Die Simulationsergebnisse speichern Informationen über Wandscherraten, Geschwindigkeit, Partikelfluss und Haftung im Gerät.
- Die Simulationsergebnisse werden verwendet, um die Anzahl der Partikel, die in jeder AOI basierend auf einem gegebenen Eintrittspartikelkonzentration zu bestimmen.
6. Genescherhaft Karte
- Berechnen% der Adhäsion durch Dividieren der anhaftenden Teilchen in der Gabelung von den in der Verzweigung, wie in Gleichung 6.1 gezeigt fließenden Teilchen.
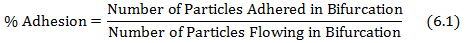
wobei die Anzahl der Partikel haftet und den fließenden Teilchen aus p erhaltenrotocol Schritte 4.3 und 5.2 auf. - Zeichnen Sie die Scherfestigkeit Karte mit der Scherrate bei jeder Gabelung der von der Datenbank in Schritt (5.1) erhalten Netze und die aus Gleichung 6.1% erhalten Haftwerte.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
1A zeigt eine schematische und eine helle Bildfeld SynVivo SMN-Gerät. 1B zeigt die SynVivo SMN-Gerät auf einem Glasträger montiert. 1C zeigt das Gerät mit folgenden Rohr im Vakuumtrockenschrank Grundierung mit Wasser.
2A zeigt ein Bild der Versuchs-Einrichtung. 2B zeigt eine typische Avidinbeschichtete SynVivo SMN-Gerät nach der Bindung von 2 um biotinylierten Partikel. Beachten Sie, dass Partikel bevor...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Parallelplattenflusskammer und bietet wesentliche Erkenntnisse über Zell-Zell-und Zell-Teilchen-Wechselwirkungen, leiden unter mehreren Einschränkungen wie hoher Verbrauch an Reagenzien und die Notwendigkeit für mehrere Versuchsdurchläufe, um eine Scherhaft Karte zu erzeugen. Die Verwendung von synthetischen Mikrovaskuläre SynVivo-Netzwerke (SynVivo-SMNS) ermöglicht die Erzeugung einer Scherhaft Karte aus einem einzigen Experiment unter Bedingungen in vivo-Bedingungen nachahmen. Zusätzlich wird deutliche...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Veröffentlichungsgebühr für diesen Artikel von CFD Research Corporation gesponsert.
Danksagungen
SynVivo Technologie wurde unter dem Förder # 2R44HL076034 vom NHLBI entwickelt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| SynVivo-SMN | CFD Research | SMN-001 | Exclusive at CFDRC |
| CFD-ACE+ | ESI Inc. | N/A | |
| Avidin | Invitrogen | 43-4401 | Any avidin source will work for this assay |
| Biotinylated Particles | Polysciences | 24173-1 | Any source of biotinylated particles will work for the assay |
| Tygon Tubing | VWR | 63018-044 | Size is typical for use with SynVivo-SMN |
| NIKON Elements | NIKON Instruments | N/A | Any other imaging software can be used |
Referenzen
- Weitz-Schmidt, G., Chreng, S. Cell adhesion assays. Methods Mol Biol. 757, 15-30 (2012).
- Parsons, S. A., Jurzinsky, C., Cuvelier, S. L., Patel, K. D. Studying leukocyte recruitment under flow conditions. Methods Mol Biol. 946, 285-300 (2013).
- Luscinskas, F. W., Gimbrone, M. A. Jr Endothelial-dependent mechanisms in chronic inflammatory leukocyte recruitment. Annu Rev Med. 47, 413-421 (1996).
- Adriani, G., et al. The preferential targeting of the diseased microvasculature by disk-like particles. Biomaterials. 33, 5504-5513 (2012).
- Decuzzi, P., et al. Flow chamber analysis of size effects in the adhesion of spherical particles. Int J Nanomedicine. 2, 689-696 (2007).
- Zou, X., et al. PSGL-1 derived from human neutrophils is a high-efficiency ligand for endothelium-expressed E-selectin under flow. Am J Physiol Cell Physiol. 289, 415-424 (2005).
- Sakhalkar, H. S., et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proc Natl Acad Sci U S A. 100, 15895-15900 (2003).
- Van Kruchten, R., Cosemans, J. M., Heemskerk, J. W. Measurement of whole blood thrombus formation using parallel-plate flow chambers - a practical guide. Platelets. 23, 229-242 (2012).
- Ganguly, A., Zhang, H., Sharma, R., Parsons, S., Patel, K. D. Isolation of human umbilical vein endothelial cells and their use in the study of neutrophil transmigration under flow conditions. J Vis Exp. 66 (66), (2012).
- Shirure, V. S., Reynolds, N. M., Burdick, M. M. Mac-2 binding protein is a novel E-selectin ligand expressed by breast cancer cells. PLoS One. 7, (2012).
- Ploppa, A., Schmidt, V., Hientz, A., Reutershan, J., Haeberle, H. A., Nohé, B. Mechanisms of leukocyte distribution during sepsis: an experimental study on the interdependence of cell activation, shear stress and endothelial injury. Crit Care. 14, 201(2010).
- Oh, H., Diamond, S. L. Ethanol enhances neutrophil membrane tether growth and slows rolling on P-selectin but reduces capture from flow and firm arrest on IL-1-treated endothelium. J Immunol. 181, 2472-2482 (2008).
- Resto, V. A., Burdick, M. M., Dagia, N. M., McCammon, S. D., Fennewald, S. M., Sackstein, R. L-selectin-mediated lymphocyte-cancer cell interactions under low fluid shear conditions. J Biol Chem. 283, 15816-15824 (2008).
- Enders, S., Bernhard, G., Zakrzewicz, A., Tauber, R. Inhibition of L-selectin binding by polyacrylamide-based conjugates under defined flow conditions. Biochim Biophys Acta. 1770, 1441-1449 (2007).
- Prabhakarpandian, B., Goetz, D. J., Swerlick, R. A., Chen, X., Kiani, M. F. Expression and functional significance of adhesion molecules on cultured endothelial cells in response to ionizing radiation. Microcirculation. 8, 355-364 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunology. 2, 9(2001).
- Zheng, W., Zhang, W., Jiang, X. Precise control of cell adhesion by combination of surface chemistry and soft lithography. Adv Healthc Mater. 2, 95-108 (2013).
- Qian, T., Wang, Y. Micro/nano-fabrication technologies for cell biology. Med Biol Eng Comput. 48, 1023-1032 (2010).
- Biswas, A., Bayer, I. S., Biris, A. S., Wang, T., Dervishi, E., Faupel, F. Advances in top-down and bottom-up surface nanofabrication: techniques, applications & future prospects. Adv Colloid Interface Sci. 170, 2-27 (2012).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu Rev Biomed Eng. 3, 335-373 (2001).
- McDonald, J. C., et al. Fabrication of microfluidic systems in poly(dimethylsiloxane). Electrophoresis. 21, 27-40 (2000).
- Prabhakarpandian, B., et al. Synthetic microvascular networks for quantitative analysis of particle adhesion. Biomed Microdevices. 10, 585-595 (2008).
- Rosano, J. M., et al. A physiologically realistic in vitro model of microvascular networks. Biomed Microdevices. 11, 1051-1057 (2009).
- Tousi, N., Wang, B., Pant, K., Kiani, M. F., Prabhakarpandian, B. Preferential adhesion of leukocytes near bifurcations is endothelium independent. Microvasc Res. 80, 384-388 (2010).
- Prabhakarpandian, B., et al. Bifurcations: focal points of particle adhesion in microvascular networks. Microcirculation. 18, 380-389 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten